| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg | |||
| 500mg | |||
| Other Sizes |
| 靶点 |
human FFA1 ( pIC50 = 8.13 )
|
|---|---|
| 体外研究 (In Vitro) |
AMG 837 (1 nM-10 μM) 以葡萄糖依赖性方式刺激胰岛素分泌,对从小鼠分离的胰岛的 EC50 为 142±20 nM[1]。 AMG 837 刺激 Ca2+ 通量,对 CHO 细胞中的人、小鼠和大鼠受体的 EC50 值分别为 13.5、22.6 和 31.7 nM[1]。
GPR40激动剂(FFA1)已被提出作为治疗2型糖尿病的一种手段。通过高通量筛选命中的先导优化,我们发现了一种名为AMG837的新型GPR40激动剂。这些研究的目的是了解AMG 837的临床前药理学特性。通过GTPγS结合、磷酸肌醇积累和Ca(2+)通量测定来表征AMG 837对GPR40的活性。在分离的原代小鼠胰岛上评估AMG 837对胰岛素释放的活性。[1] 与外消旋化合物相比,化合物8/AMG837对GPR40的效力预期增加了两倍(EC50=13[±7]nM),其活性转移到大鼠和小鼠形式的GPR40(EC50=23和13nM)。由于我们对该化合物的兴趣,与DHA相比,确定了化合物8的内在功效。因此,发现化合物8是GPR40的部分激动剂,在我们的标准测定条件下,其最大活性为DHA的85%。19除了在Ca2+通量测定中的活性外,化合物8还在小鼠β细胞系(MIN6)中显示出功能活性。如图1所示,化合物8是MIN6细胞中胰岛素分泌的强效刺激剂,其EC50与水母发光蛋白Ca2+通量测定中的EC50相当。 虽然对GPR40具有很强的效力,但化合物8/AMG837对密切相关的GPCR GPR41和GPR43没有活性。尽管化合物8可能与一些PPAR激动剂在结构上相似,但在基于细胞的PPAR-α、-δ和-γ检测中没有显示出明显的活性。除了对α2-肾上腺素能受体的弱抑制(IC50=3μM)外,64个受体的外部面板也没有显示出明显的活性。总体而言,化合物8在体外既高效又具有选择性。[2] 这些激动剂的重要特征是它们彼此之间以及在三个不同的结合位点发生变构相互作用。放射性标记的激动剂[3H]AMG 837和[3H]AM 1638以1:1的化学计量比标记两个不同的位点(图5,a和C)。AM 1638将[3H]AMG 837的亲和力提高了约3倍(图3),并且已经证明了AMG837对[3H]AM 1638的相互增强作用(图4)。亲和力的增加并不伴随着结合位点Bmax数量的增加(图5,B和D)。这些结合数据满足了简单1:1变构相互作用的变构三元复合物模型的预测(Lazareno和Birdsall,1995),并代表了少数几个使用两个相互作用位点的放射性配体表征GPCR中相互双向变构相互作用的例子之一。此外,AM 1638减缓了[3H]AMG 837的解离动力学(图7A),其效力由平衡数据和变构三元复合物模型预测(Lazareno和Birdsall,1995;Lazareno等人,1998)。 第三种合成配体AM 8182也与[3H]AMG 837发生变构相互作用,但具有负协同性(图4),并显示出减缓[3H]AM 837解离速率的预期效力(图7B)。这一发现可能表明AM 8182与AM 1638结合在同一位点。然而,AM 8182对[3H]AM 1638的结合没有影响(图4),这表明AM 8182和AM 1638之间存在中性协同作用;即AM 8182与AM 1638和AMG837都是变构的,因此与第三个结合位点结合。 一个重要的问题是,这些位点中的哪一个可能结合内源性脂肪酸,如DHA?结合研究表明,DHA与[3H]AMG 837具有变构作用(负协同作用)(图3),与[3H]AM 1638表现出轻微的正协同作用(图4)。因此,DHA与AM 8182一样,不与放射性配体标记的两个位点中的任何一个结合。可以利用AM 8182对[3H]AM 1638结合缺乏影响及其已知的抑制[3H]AMG 837结合的亲和力来证明,AM 8182浓度的增加会以平行的方式改变[3H]AM-1638结合的DHA增强曲线,并达到AMG182和DHA之间竞争性相互作用的预期程度(图6)。这一结果证实了三个相互作用位点的存在,如图16[3]所示。 |
| 体内研究 (In Vivo) |
AMG 837(0.03-0.3 mg/kg;口服,每日一次,持续 21 天)可降低体内葡萄糖挑战后的血糖水平并增加胰岛素水平[1]。 AMG 837(0.03-0.3 mg/kg;单次口服)可改善 Sprague-Dawley 大鼠的葡萄糖耐量并增强胰岛素分泌[1]。 AMG 837(0.5 mg/kg;口服)具有出色的口服生物利用度(F = 84%),总血浆 Cmax 为 1.4 µM[1]。动物模型:8周龄Zucker Fatty Rats[1] 剂量:0.03、0.1、0.3 mg/kg 给药方法:口服灌胃,每天一次,持续21天 结果:葡萄糖耐量试验(GTT)期间葡萄糖AUC值降低至7%, 0.03、0.1 和 0.3 mg/kg 时分别为 15% 和 25%。中剂量组和高剂量组的胰岛素水平增加。在 21 天的治疗期间,体重没有受到影响。动物模型:8周龄Sprague-Dawley大鼠[1] 剂量:0.03、0.1、0.3 mg/kg 给药方式:单次口服给药 结果:半最大剂量0.05 mg/kg可降低餐后血糖。
为了确定AMG837在体内的抗糖尿病活性,我们使用葡萄糖耐量试验在正常Sprague-Dawley大鼠和肥胖Zucker脂肪大鼠中测试了AMG 837。AMG 837在GPR40受体的钙通量测定中是一种强效的部分激动剂,并在体外和体内增强葡萄糖刺激的胰岛素分泌。在正常和Zucker脂肪大鼠的葡萄糖耐量试验中,急性施用AMG 837降低了葡萄糖波动,增加了葡萄糖刺激的胰岛素分泌。在Zucker脂肪大鼠中,每天服用AMG 837 21天后,葡萄糖波动的改善持续存在。临床前研究表明,AMG 837是一种有效的GPR40部分激动剂,可以降低餐后血糖水平。这些研究支持AMG 837治疗2型糖尿病的潜在效用[1]。 AMG837刺激正常啮齿动物的胰岛素分泌并降低餐后血糖水平[1] 接下来,我们测试了AMG 837改善Sprague-Dawley大鼠葡萄糖耐量和刺激胰岛素分泌的能力。选择Sprague-Dawley大鼠是因为它们血糖正常,允许在正常血糖水平下和葡萄糖推注后的挑战状态下测试AMG 837。AMG 837在多种物种中显示出优异的药代动力学特性(Houze JB等人,正在制备中)。大鼠单次口服0.5mg/kg剂量后的药代动力学曲线显示出优异的口服生物利用度(%F = 84) 总血浆Cmax为1.4µM。AMG 837在腹腔葡萄糖激发前30分钟以0.03mg/kg、0.1mg/kg和0.3mg/kg的剂量经口灌胃给药。在葡萄糖给药前后测定葡萄糖和胰岛素水平。 在葡萄糖耐量试验之前(AMG 837给药后30分钟),AMG 837对葡萄糖水平没有任何影响。在给予葡萄糖后,血浆葡萄糖水平以AMG 837剂量依赖的方式受到抑制(图3A)。与赋形剂治疗的动物相比,在低、中、高剂量下,葡萄糖AUC分别提高了3.9%、14.5%(p<0.05)和18.8%(p<0.01)(图3B)。AMG 837降低大鼠餐后血糖的半最大剂量约为0.05mg/kg。 餐后血糖的改善是葡萄糖刺激的胰岛素分泌增加的结果。在用AMG 837治疗的动物中,葡萄糖激发后血浆胰岛素水平呈剂量依赖性增加(图3C)。血浆胰岛素水平的升高迅速且持续时间短,在葡萄糖给药后5分钟和15分钟最为明显。综上所述,这些结果表明AMG 837的活性在体内依赖于葡萄糖。 我们进一步测试了单剂量AMG 837是否可以改善连续血糖挑战后的餐后血糖。Sprague-Dawley大鼠服用单剂量(0.3mg/kg)AMG 837,然后间隔3小时进行两次腹腔葡萄糖挑战。AMG 837在两次葡萄糖挑战中都改善了血糖水平(p<0.01,图3D,E)。正如在单次葡萄糖激发中观察到的那样,每次葡萄糖激发期间的胰岛素分泌峰值在葡萄糖给药后不久就增加了(图3F)。这些结果表明,单剂量AMG 837对胰腺β细胞的药理作用持续数小时。 AMG837对Zucker肥胖大鼠每日一次给药21天后的疗效[1] 接下来,我们测试了单次和多次服用AMG 837后,AMG 837对胰岛素抵抗的Zucker fatty(fa/fa)大鼠的影响。对Zucker脂肪大鼠模型进行了研究,因为它显示出糖耐量受损、高胰岛素血症和轻度高血糖[24],[25]。在IPGTT之前,AMG 837首先以0.3、1和3mg/kg的单剂量进行了测试。与正常Sprague-Dawley大鼠相比,AMG 837给药后30分钟的葡萄糖水平呈下降趋势,胰岛素水平呈上升趋势,尽管这两个参数都没有达到统计学意义(图4A,C)。由于AMG 837对GPR40的活性是葡萄糖依赖性的,因此与Sprague-Dawley大鼠相比,胰岛素抵抗的Zucker脂肪大鼠的基础葡萄糖水平较高可能足以引发反应。在葡萄糖挑战后,所有剂量的AMG 837的葡萄糖水平都较低,葡萄糖偏移曲线在很大程度上重叠(图4A)。所有剂量的葡萄糖AUC均降低了约46%(p<0.001,图4B)。正如在Sprague-Dawley大鼠中观察到的那样,葡萄糖激发后5分钟和15分钟,血浆胰岛素水平飙升最为显著(图4C)。 为了了解AMG 837在多次给药后的效果,AMG 837以0.03、0.1和0.3mg/kg的剂量每天经口灌胃给药21天。首次给药后30分钟,进行IPGTT。AMG 837在IPGTT期间改善了葡萄糖水平(图5A),0.03、0.1和0.3 mg/kg的葡萄糖AUC分别降低了17%、34%(p<0.001)和39%(p<0.001)(图5B)。这与葡萄糖给药后胰岛素分泌增加有关(图5E)。由于在0.3mg/kg以下但不高于0.3mg/kg时可以观察到对葡萄糖挑战的药理学反应的分离(图4),这表明0.3mg/kg大约是该大鼠模型中的最大剂量。 为了测试AMG 837在多次给药后的效果,每天继续服用AMG 837 21天。在第21天最后一次给药后30分钟进行了第二次IPGTT,AMG 837在葡萄糖激发后降低了葡萄糖水平(图5C)。在GTT期间,0.03、0.1和0.3 mg/kg的葡萄糖AUC值分别降至7%、15%(p<0.05)和25%(p<0.001)(图5D)。与第1天相比,所有组在第21天葡萄糖激发前的胰岛素水平均较高,这可能表明这些动物存在进行性胰岛素抵抗。在用AMG 837治疗的啮齿动物中,葡萄糖激发后中高剂量组的胰岛素水平升高(图5F)。在21天的治疗期间,AMG 837治疗对体重没有影响(图5G)。综上所述,这些结果表明,AMG 837的药理活性即使在21天后仍然存在。在最终剂量为0.03 mg/kg、0.1 mg/kg和0.3 mg/kg AMG 837后30分钟,AMG 837的总血浆浓度分别为26±6 nM、75±13 nM和204±49 nM(图5H)。 |
| 酶活实验 |
GTPγS结合试验[1]
使用抗Gα-蛋白闪烁邻近测定格式的GTPγS结合测定基本上如所述[23]。在康宁96孔板(康宁目录#3604)中进行了测定。细胞膜由稳定转染GPR40的A9细胞系(A9_GPR40)制备。将细胞膜与不同浓度的AMG837、0.1µM GDP、400 pM[35S]-GTPγ在结合缓冲液(由20 mM Hepes pH 7.4、100 mM NaCl和5 mM MgCl2组成)中以200µl/孔的体积混合。将板在室温下孵育60分钟。接下来,向每个孔中加入20µl 3%的NP-40,并将平板进一步孵育30分钟。随后加入20µl抗Gq抗体(抗Gαq/11抗体,1∶400稀释),并将平板再孵育60分钟。最后,向每个孔中加入50µl抗兔SPA珠,并孵育平板3小时。使用Microbeta测量捕获的抗体[35S]-GTPγ。 平衡结合试验。[3] 对表达hFFA1的A9膜进行平衡结合分析。用结合缓冲液(20mM Hepes,pH 7.5,5mM MgCl2,100mM NaCl和0.1%(w/v)无脂肪酸BSA)连续稀释测试化合物。游离脂肪酸可能存在于检测中,在功能检测中表现出组成活性,并干扰放射性配体结合检测。因此,结合试验中包括低浓度的无脂肪酸BSA(0.1%)。不含脂肪酸的BSA,高达0.5%,对结合没有影响。将膜和放射性配体重新悬浮在结合缓冲液中。96孔测定板的每个孔都含有稀释的测试化合物、放射性配体(5 nM[3H]AMG 837或10 nM[3H]AM 1638)和A9-hFFA1细胞膜蛋白(5μg/孔),总体积为200μl,并在室温下平衡4小时。在存在或不存在不同浓度AM 8182的情况下,使用不同浓度的DHA,用5 nM ~3H]AM 1633和20μg/孔膜蛋白进行了一些交叉相互作用异源结合实验。膜蛋白浓度使得不超过10%的添加的放射性配体与受体结合。每个数据点有2到12个重复。非特异性结合是在10μM浓度的AMG837或AM 1638存在的情况下测定的,具体取决于所使用的放射性配体。在GF/C过滤板上收获板,用五次冰冷的缓冲液洗涤。然后将50μl闪烁剂添加到板的每个孔中,并在TopCount微孔板闪烁计数器上对板进行计数。所有化合物都溶解在二甲亚砜中,在1%的最高终浓度下,二甲基亚砜对结合没有影响。 饱和结合和相互作用实验。[3] 使用放射性标记的部分激动剂[3H]AMG 837或完全激动剂[3H]AM 1638的浓度增加(0.1-40 nM)生成饱和结合曲线。该测定在96孔板上进行,该板含有5μg用于[3H]AMG 837结合的膜蛋白或20μg/孔用于[3H]AM 1638,并在室温下孵育4小时。在10μM浓度的未标记的冰冷AMG837或AM 1638(视情况而定)存在的情况下,测定非特异性结合。饱和相互作用实验在100 nM AM 1638([3H]AMG 837结合曲线)或100 nMAMG837([3H]AM 1638)存在的情况下进行。终止结合反应,并如上所述测量放射性。每个数据点使用3至12个重复样本生成饱和度曲线。在任何放射性配体浓度下,不超过10%的添加放射性配体与受体结合。 解离结合动力学。[3] 在不存在或存在一定浓度的激动剂(AM 1638或AM 8182)的情况下,测量[3H]AMG 837与FFA1受体的解离率。将含有膜蛋白(5μg)和5nM[3H]AMG 837的测定板在室温下预平衡2小时(以230rpm振荡)。在时间0,测定总结合,并在存在或不存在不同浓度变构配体的情况下,将饱和量的冰冷AMG837(10μM)加入到含有预标记膜的板的不同孔中。在不同时间(2-240分钟)过滤膜,然后用冷缓冲液洗涤五次,如上所述测量放射性。 |
| 细胞实验 |
水母发光蛋白测定
CHO细胞在含有10%FBS的DMEM/F12中,每板含有8×106个细胞,放置在15cm的平板上。第二天,用5µg GPR40表达质粒和5µg与30µL Lipofectamine 2000复合的水母发光蛋白表达质粒转染细胞。在质粒滴定实验中,GPR40表达质粒的量减少,但通过加入空载体DNA使转染的DNA总量保持恒定。转染后16至24小时,用PBS洗涤细胞,并用2mL胰蛋白酶(在HBSS中为0.25%)从板上分离。将含有所需量HSA(0.01%或0.625%w/v)或人血清(100%v/v)的28mL HBSS加入分离的细胞中,并加入腔肠素至终浓度为1µg/mL。在测定前,让细胞在含腔肠素的缓冲液中孵育2小时。AMG837和DHA储备溶液在DMSO中制备,然后在含有与细胞孵育时相同的HSA的HBSS缓冲液中稀释。化合物在37°C下与HSA复合1小时。使用微量涂片测量水母发光蛋白活性。
水母发光蛋白测定:[2] 基于细胞的水母发光蛋白测定可用于表征化合物对GPR40信号通路的调节活性。使用Lipofectamine 2000将CHO细胞转染在含有1400万个细胞的15cm平板中,该平板含有5µg GPR40表达载体和5µg水母发光蛋白表达载体。转染后17-24小时后,用磷酸缓冲盐水(PBS)洗涤细胞,并用2mL胰蛋白酶(0.25%(w/v))从组织培养皿中分离。用28mL含有20mM Hepes(H/HBSS)和0.01%无脂肪酸牛血清白蛋白(BSA)或0.625%无脂肪酸人血清白蛋白(HSA)的Hanks缓冲盐溶液停止胰蛋白酶化。将共蓝拉嗪加入1 ug/mL,并在室温下孵育细胞2小时。每15分钟轻轻混合一次细胞。将化合物溶解在二甲亚砜中以制备10mM储备溶液。化合物在含有0.01%BSA的H/HBSS中稀释。制备试验化合物的连续稀释液以确定剂量反应。 使用EG&G Berthold 96孔光度计进行水母发光测量,并在细胞和化合物混合后的20秒间隔内测量响应。绘制2-20秒的曲线下面积以确定剂量反应。EC50(达到50%最大反应的有效浓度)由剂量反应图确定。 水母发光蛋白测定。[3] 稳定表达FFA1和水母发光蛋白DNA的CHO细胞在15cm培养皿中生长,24小时后使用2ml 1×胰蛋白酶-EDTA(0.25%胰蛋白酶和21mM EDTA在Hanks缓冲盐溶液中)收获,并通过离心(5分钟,600g)造粒。将沉淀物重新悬浮在含有0.01%(w/v)无脂肪酸HSA和20mM Hepes的HBSS中,并在室温下与1μg/ml腔肠素和试验化合物一起孵育2小时。使用96孔光度计进行水母发光测量,作为配体诱导的受体激活和钙释放的读数。在向细胞中加入化合物后的20秒间隔内测量反应(An等人,1998)。 与A9细胞相比,这种稳定的细胞系表达的FFA1水平较低。通过测量[3H]AMG 837(1 nM)与以与A9膜相同的方式制备的膜(10μg蛋白质)的结合,得到的Bmax水平的最佳估计值约为0.5 pmol/mg蛋白质,假设AMG837的亲和力与A9膜中测量的亲和力相同。无法检测到[3H]AM 1638(5或10 nM)与CHO细胞膜的特异性结合(数据未显示)。 |
| 动物实验 |
8-week old Zucker Fatty Rats
0.03, 0.1, 0.3 mg/kg Oral gavage once daily for 21 days In vivo procedures [1] AMG837 was formulated for oral dosing using 1% methylcellulose (CMC), 1% Tween 80. For evaluation of AMG837 following a single dose in rats, animals were fasted overnight and then randomized into dose groups based on their body weights. Thirty minutes after oral administration of their respective treatments, the animals received a 1 g/kg glucose challenge dose by intraperitoneal injection. Blood samples were collected at 0, 5, 15, 30, 60, and 120 minutes via tail vein after the glucose challenge. Glucose levels were monitored with a Glucometer. Plasma insulin was measured using a rat insulin ELISA kit. For evaluation of AMG837 in Zucker fatty rats, animals were randomized based on body weight and received either vehicle, 0.03 mg/kg, 0.1 mg/kg, or 0.3 mg/kg AMG837 once daily for 21 days by oral gavage. Treatments were administered between 0900 and 1000 h during the light cycle. On days 1 and 21, an intraperitoneal glucose tolerance test (IPGTT) was performed as described above. |
| 药代性质 (ADME/PK) |
AMG837 displays excellent pharmacokinetic properties in multiple species (Houze JB et al, in preparation). The pharmacokinetic profile following a single 0.5 mg/kg oral dose in rats displayed excellent oral bioavailability (%F = 84) and a total plasma Cmax of 1.4 µM. AMG 837 was dosed by oral gavage at 0.03 mg/kg, 0.1 mg/kg and 0.3 mg/kg 30 minutes prior to an intraperitoneal glucose challenge. Glucose and insulin levels were determined before and after administration of glucose.
AMG837 administration did not have any effect on glucose levels prior to the glucose tolerance test (30 minutes following AMG 837 administration). Following administration of glucose, plasma glucose levels were suppressed in an AMG 837 dose-dependent manner (figure 3A). At the low, mid and high dose, glucose AUC improved 3.9%, 14.5% (p<0.05) and 18.8% (p<0.01) compared to that of vehicle treated animals, respectively (figure 3B). The half-maximal dose of AMG 837 to lower post-prandial glucose in rats was approximately 0.05 mg/kg.[1] In addition to its favorable profile in vitro, compound 8/AMG837 distinguished itself by displaying an excellent pharmacokinetic profile in multiple species. As shown in Table 3, compound 8 combines low clearance, long half-life, and high oral bioavailability in four preclinical species.[2] In order to confirm that the potential antidiabetic activity of compound 8/AMG837 was mediated by GPR40, an oral glucose tolerance test (OGTT) was carried out in wild-type and GPR40 KO mice. The DPP-4 inhibitor sitagliptin was used at a maximally efficacious dose as a positive control.20 Compounds were dosed orally 60 min prior to the oral glucose challenge. As shown in Figure 2, compound 8 substantially blunted plasma glucose excursion compared to both vehicle and positive control in wild-type animals consistent with its activity as an insulin secretagogue as shown in MIN6 cells (Fig. 2a). The total glucose AUC was also reduced in a statistically significant manner (Fig. 2c). In contrast, no effect in the OGTT was seen in the GPR40 KO animals after dosing with compound 8 where the positive control retained activity (Fig. 2b). The complete absence of a response in the GPR40 KO animals establishes that the effects of compound 8 are GPR40 mediated. The behavior of compound 8/AMG837 in this GTT study is consistent with the hypothesis that selective GPR40 agonists could serve as glucose-dependent insulin secretagogues.[2] |
| 参考文献 |
|
| 其他信息 |
The discovery that certain long chain fatty acids potentiate glucose stimulated insulin secretion through the previously orphan receptor GPR40 sparked interest in GPR40 agonists as potential antidiabetic agents. Optimization of a series of β-substituted phenylpropanoic acids led to the identification of (S)-3-(4-((4'-(trifluoromethyl)biphenyl-3-yl)methoxy)phenyl)hex-4-ynoic acid (AMG837) as a potent GPR40 agonist with a superior pharmacokinetic profile and robust glucose-dependent stimulation of insulin secretion in rodents. [2]
Activation of FFA1 (GPR40), a member of G protein-coupling receptor family A, is mediated by medium- and long-chain fatty acids and leads to amplification of glucose-stimulated insulin secretion, suggesting a potential role for free fatty acid 1 (FFA1) as a target for type 2 diabetes. It was assumed previously that there is a single binding site for fatty acids and synthetic FFA1 agonists. However, using members of two chemical series of partial and full agonists that have been identified, radioligand binding interaction studies revealed that the full agonists do not bind to the same site as the partial agonists but exhibit positive heterotropic cooperativity. Analysis of functional data reveals positive functional cooperativity between the full agonists and partial agonists in various functional assays (in vitro and ex vivo) and also in vivo. Furthermore, the endogenous fatty acid docosahexaenoic acid (DHA) shows negative or neutral cooperativity with members of both series of agonists in binding assays but displays positive cooperativity in functional assays. Another synthetic agonist is allosteric with members of both agonist series, but apparently competitive with DHA. Therefore, there appear to be three allosterically linked binding sites on FFA1 with agonists specific for each of these sites. Activation of free fatty acid 1 receptor (FFAR1) by each of these agonists is differentially affected by mutations of two arginine residues, previously found to be important for FFAR1 binding and activation. These ligands with their high potencies and strong positive functional cooperativity with endogenous fatty acids, demonstrated in vitro and in vivo, have the potential to deliver therapeutic benefits.[3] Therapeutic Potential. The large positive functional cooperativity between the synthetic ligands (up to 30-fold) allows lower doses of a combination of ligands to be used to achieve a given level of stimulation than would be required for a single ligand alone. Up to a 30-fold lower dose of one ligand or up to 10-fold lower doses of both ligands can generate a given response and should reduce potential unwanted effects. This is illustrated in Fig. 10C in which threshold doses of 1.5 nM AM 1638 and 20 nM AMG 837, when applied in combination, produce an response equivalent to approximately 30 nM AMG 1638 and >300 nM AMG837 when administered singly. The FFA1 receptor agonists reported here may not only be pharmacological tools but also have the potential utility for the treatment of type 2 diabetes and have implications in pathophysiological settings of the receptor.[3] |
| 分子式 |
C52H42CAF6O7
|
|---|---|
| 分子量 |
932.954115390778
|
| 精确质量 |
932.25
|
| 元素分析 |
C, 66.94; H, 4.54; Ca, 4.30; F, 12.22; O, 12.00
|
| CAS号 |
1259389-38-2
|
| 相关CAS号 |
AMG 837 hemicalcium; 1291087-14-3; AMG 837; 865231-46-5; AMG 837 sodium salt; 865231-45-4; 1259389-38-2 (calium hydrate)
|
| PubChem CID |
154584011
|
| 外观&性状 |
White to off-white solid powder
|
| tPSA |
101
|
| 氢键供体(HBD)数目 |
2
|
| 氢键受体(HBA)数目 |
14
|
| 可旋转键数目(RBC) |
12
|
| 重原子数目 |
67
|
| 分子复杂度/Complexity |
655
|
| 定义原子立体中心数目 |
2
|
| SMILES |
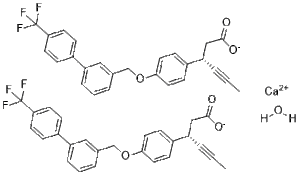
CC#C[C@@H](CC(=O)[O-])C1=CC=C(C=C1)OCC2=CC(=CC=C2)C3=CC=C(C=C3)C(F)(F)F.CC#C[C@@H](CC(=O)[O-])C1=CC=C(C=C1)OCC2=CC(=CC=C2)C3=CC=C(C=C3)C(F)(F)F.O.O.[Ca+2]
|
| InChi Key |
QDINKBCSIAWNMP-XYDYARRRSA-L
|
| InChi Code |
InChI=1S/2C26H21F3O3.Ca.H2O/c2*1-2-4-21(16-25(30)31)20-9-13-24(14-10-20)32-17-18-5-3-6-22(15-18)19-7-11-23(12-8-19)26(27,28)29;;/h2*3,5-15,21H,16-17H2,1H3,(H,30,31);;1H2/q;;+2;/p-2/t2*21-;;/m00../s1
|
| 化学名 |
calcium;(3S)-3-[4-[[3-[4-(trifluoromethyl)phenyl]phenyl]methoxy]phenyl]hex-4-ynoate;hydrate
|
| 别名 |
AMG 837; AMG837; AMG-837; AMG-837 Calcium Hydrate; 1259389-38-2; AMG 837 (calcium hydrate); calcium;(3S)-3-[4-[[3-[4-(trifluoromethyl)phenyl]phenyl]methoxy]phenyl]hex-4-ynoate;hydrate; AMG 837 hemicalcium hydrate; AMG 837 hemicalcium salt
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 请将本产品存放在密封且受保护的环境中,避免吸湿/受潮。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO: ≥ 42 mg/mL (~92.2 mM)
|
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: 2.5 mg/mL (5.49 mM) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 悬浮液;超声助溶。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (5.49 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.5 mg/mL (5.49 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.0719 mL | 5.3593 mL | 10.7187 mL | |
| 5 mM | 0.2144 mL | 1.0719 mL | 2.1437 mL | |
| 10 mM | 0.1072 mL | 0.5359 mL | 1.0719 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
|
|
|
|