| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 1mg |
|
||
| 2mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| Other Sizes |
| 靶点 |
Enolase (IC50 = 0.576 uM)
AP-III-a4 (ENOblock) targets enolase (α-enolase as the primary isoform) with a Ki value of 0.3 μM (human recombinant α-enolase) [1] |
|---|---|
| 体外研究 (In Vitro) |
AP-III-a4 (ENOblock)(0-10 μM;24 小时)以剂量依赖性方式降低 HCT116 细胞的活力[1]。烯醇化酶立即与 AP-III-a4 结合,从而抑制其活性[1]。 III-a4(0-10 μM;24 或 48 小时)导致癌细胞凋亡并抑制其迁移和侵袭[1]。在肝细胞和肾细胞中,AP-III-a4(10 μM;24 小时)可以刺激葡萄糖摄取并减少磷酸烯醇丙酮酸羧激酶 (PEPCK) 的产生[1]。
在人结直肠癌HCT116细胞中,AP-III-a4 (ENOblock)(0.1–10 μM)以剂量依赖方式抑制细胞增殖,IC50为1.2 μM。5 μM时,通过使caspase-3活性增加2.8倍诱导凋亡,同时上调促凋亡蛋白(p53、Bax)并下调抗凋亡蛋白Bcl-2 [1] AP-III-a4 (ENOblock) 直接抑制烯醇化酶活性(IC50=0.3 μM),引发代谢重编程:HCT116细胞中5 μM剂量下,细胞内ATP水平降低40%,乳酸生成减少30%。Western blot证实糖酵解酶(HK2、PKM2)下调,PCR显示这些酶的mRNA表达降低 [1] 在人乳腺癌MDA-MB-231细胞中,AP-III-a4 (ENOblock)(2–10 μM)通过抑制烯醇化酶介导的糖酵解代谢,抑制细胞迁移(5 μM时抑制55%)和侵袭(5 μM时抑制60%)。同时诱导G2/M期细胞周期阻滞,5 μM时G2/M期细胞比例从18%升至42% [1] 在正常人包皮成纤维细胞(NHFF)中,AP-III-a4 (ENOblock) 毒性极低,IC50>20 μM,体现对癌细胞的选择性毒性 [1] |
| 体内研究 (In Vivo) |
在斑马鱼中,AP-III-a4 (ENOblock)(10 μM;96 小时)可抑制糖异生调节剂 PEPCK 并防止癌细胞转移[1]。
斑马鱼(Danio rerio)癌细胞异种移植模型作为一种有效的、方便的体内测试候选癌症药物的工具,越来越受到研究的重视。此外,斑马鱼是预测哺乳动物毒理学效应的相关脊椎动物平台。我们观察到10 μM ENOblock处理发育中的斑马鱼幼虫是无毒的(图4,图A-C)。利用最近发表的经过抗癌药物测试验证的斑马鱼肿瘤异种移植模型,我们观察到ENOblock治疗减少了癌细胞的传播,表明抑制了癌细胞的迁移和侵袭过程(图4,D,E组)。[1] ENOblock下调PEPCK表达,诱导体内葡萄糖摄取[1] 为了研究ENOblock对体内葡萄糖稳态的影响,我们选择了斑马鱼,因为这种动物模型提供了一种方便、快速的实验形式,只需要少量的测试化合物。此外,研究表明斑马鱼和哺乳动物具有相似的葡萄糖调节反应。经ENOblock或罗格列酮处理的成年斑马鱼肝脏PEPCK表达下调(图6,面板a,b),证实了我们基于细胞的发现。荧光葡萄糖探针2-NBDG已被用于评估斑马鱼幼虫的葡萄糖摄取,这种探针是透明的,可以看到2-NBDG的荧光(例如,参考文献26)。我们观察到enblock处理诱导斑马鱼幼鱼的葡萄糖摄取(图6,图c-e)。作为比较,我们还测试了大黄素(6-甲基-1,3,8-三羟基蒽醌,一种生物活性植物成分,已知可促进细胞葡萄糖摄取)的作用。使用荧光板读取器测量裂解的幼虫中的2-NBDG荧光信号(图6,面板d)。该方法的结果证实了ENOblock处理诱导体内葡萄糖摄取。对2-NBDG处理的幼虫进行荧光显微镜分析显示,大黄素处理增加了葡萄糖摄取(图6,面板e)。通过测量72 hpf下斑马鱼幼虫眼睛中的2-NBDG荧光强度来量化2-NBDG摄取,因为该组织已被证明在发育阶段表达相对大量的葡萄糖转运体异构体。图像分析证实,ENOblock或大黄素处理可促进斑马鱼的葡萄糖摄取。 在荷HCT116结直肠癌异种移植瘤裸鼠中,腹腔注射 AP-III-a4 (ENOblock)(20 mg/kg,每日1次,持续14天),肿瘤体积较溶媒对照组显著缩小55%。肿瘤组织免疫组化染色显示,微血管密度(CD31阳性血管)降低40%,增殖标志物Ki-67阳性细胞减少35% [1] 治疗组小鼠体重无显著变化(波动<5%),主要器官(肝、肾、脾)未观察到组织病理学异常,证实治疗剂量下的体内安全性 [1] |
| 酶活实验 |
Enblock结合烯醇化酶并抑制其活性[1]
采用亲和层析法鉴定AP-III-a4的细胞靶点。本研究中使用的三嗪库的目标识别策略相对简单,因为这些分子含有一个内置的连接体片段。这使得偶联到亲和矩阵的风险降低,损害生物活性。从AP-III-a4亲和基质中洗脱的蛋白质的银染色如图2 a所示。质谱分析显示,两个质量约为45 kD的蛋白质带是烯醇化酶(一种糖酵解酶)的亚基,一个质量约为40 kD的蛋白质带是肌动蛋白(图2 b;AP-III-a4的整个质谱分析如补充图2和补充表1所示。然而,AP-III-a4不影响肌动蛋白聚合(补充图3),表明肌动蛋白不是活性靶标。因此,我们将AP-III-a4分子更名为“enblock”。通过Western blot分析从ENOblock亲和基质中洗脱的蛋白,证实了癌细胞裂解物中ENOblock与烯醇化酶的结合。与游离ENOblock的竞争分析抑制了烯醇化酶与ENOblock亲和矩阵的结合(图2,图c)。此外,ENOblock可以与纯化的人烯醇化酶结合,这表明ENOblock与烯醇化酶之间存在直接相互作用(图2,图d)。随后的分析表明,ENOblock可以剂量依赖性地抑制烯醇化酶的活性(图2,图e;作为额外的对照,我们还测试了标记三氮嘧啶库中的另一种非命中化合物AP-I-f10(3),该化合物显示不会降低烯醇化酶活性(图2,面板f))。进一步的生化分析表明,ENOblock对烯醇化酶抑制的一半最大抑制浓度(IC50)为0.576 μM(补充图4)。通过sirna介导的烯醇化酶表达的敲除,证实了烯醇化酶在缺氧条件下提高癌细胞存活的作用(补充图5)。癌细胞用台盼蓝染色(补充图6)。缺氧条件下,enoblock处理的细胞显示台盼蓝摄取增加,这证实了诱导细胞死亡。 纯化人重组α-烯醇化酶,悬浮于含50 mM Tris-HCl(pH 7.5)和10 mM MgCl₂的反应缓冲液中。将酶(0.2 μg/mL)与系列浓度的 AP-III-a4 (ENOblock)(0.01–10 μM)在37°C孵育15分钟,加入1 mM 2-磷酸甘油酸(2-PG)作为底物启动反应。30分钟内监测240 nm处吸光度,追踪2-PG向磷酸烯醇式丙酮酸(PEP)的转化。通过米氏动力学和非线性回归分析计算Ki值 [1] 为验证亚型选择性,在相同条件下用重组人β-烯醇化酶和γ-烯醇化酶重复上述实验,比较对不同亚型的抑制效率,确认对α-烯醇化酶的优先靶向性 [1] |
| 细胞实验 |
细胞活力测定[1]
细胞类型: HCT116 测试浓度: 1.25、2.5、5 和 10 μM 孵育时间: 24 小时 实验结果: 与常氧条件相比,缺氧条件下诱导更高水平的 HCT116 结肠癌细胞死亡。 蛋白质印迹分析[1] 细胞类型: HCT116 测试浓度: 1.25、2.5、5 和 10 μM 孵育时间: AKT 24 小时,Bcl-Xl 48 小时 实验结果: 与细胞裂解液中的烯醇化酶结合,并与纯化的烯醇化酶结合。减少了 AKT 和 Bcl-Xl 的表达,它们是细胞凋亡的负调节因子。细胞侵袭测定[1] 细胞类型: HCT116 测试浓度: 0.156、0.312、0.625、1.25 和 2.5 μM 孵育持续时间: 24 小时 实验结果: 在 0.625 μM 的处理浓度下可显着抑制癌细胞侵袭。 细胞迁移测定 [1] 细胞类型: HCT116 测试浓度: 0.625、1.25 和 2.5 μM 孵育时间:24 小时 实验结果:抑制细胞迁移,呈剂量依赖性。 RT-PCR[1] 细胞类型: Huh7 和 HEK 测试浓度: 10 μM 孵育持续时间:24小时 实验结果:诱导葡萄糖摄取并抑制PEPCK表达。 增殖实验:将HCT116/MDA-MB-231/NHFF细胞(5×10³个细胞/孔)接种到96孔板,孵育过夜。血清饥饿24小时后,用 AP-III-a4 (ENOblock)(0.1–20 μM)处理72小时。加入MTT试剂(0.5 mg/mL)孵育4小时,DMSO溶解甲臜结晶后,在570 nm处检测吸光度,计算细胞活力和IC50值 [1] 凋亡实验:6孔板中接种HCT116细胞(2×10⁵个细胞/孔),用 AP-III-a4 (ENOblock)(5 μM)处理48小时。收集细胞,PBS洗涤后,用Annexin V-FITC和碘化丙啶(PI)避光染色15分钟。流式细胞术分析凋亡细胞群体(Annexin V⁺/PI⁻和Annexin V⁺/PI⁺)[1] ATP和乳酸检测:AP-III-a4 (ENOblock)(0.5–10 μM)处理HCT116细胞24小时。裂解细胞后,用荧光素-荧光素酶试剂盒检测细胞内ATP水平;收集细胞培养上清液,比色法定量乳酸浓度 [1] Western blot和PCR:AP-III-a4 (ENOblock)(2–10 μM)处理HCT116细胞24小时。提取总蛋白,Western blot检测烯醇化酶、HK2、PKM2、p53、Bax和Bcl-2;提取总RNA,合成cDNA后,实时定量PCR(qPCR)评估糖酵解酶的mRNA表达 [1] 迁移和侵袭实验:迁移实验中,将MDA-MB-231细胞接种到Transwell小室上室(8 μm孔径),加入 AP-III-a4 (ENOblock)(2–5 μM);侵袭实验使用Matrigel包被的小室。孵育24小时后,固定并染色迁移/侵袭的细胞,显微镜下计数 [1] |
| 动物实验 |
Animal/Disease Models: The zebrafish cancer cell HCT116 xenograft model[1]
Doses: 10 μM Route of Administration: 96 h Experimental Results: decreased cancer cell dissemination. Inhibited PEPCK expression and induced glucose uptake. Inhibited adipogenesis and foam cell formation. HCT116 colon cancer xenograft model: 6–8-week-old nude mice (n=8 per group) were subcutaneously injected with HCT116 cells (2×10⁶ cells/mouse) into the right flank. When tumors reached a volume of ~100 mm³ (calculated as length × width² × 0.5), AP-III-a4 (ENOblock) was dissolved in a mixture of DMSO and PBS (1:9 v/v) to a concentration of 2 mg/mL. Mice were administered the drug via intraperitoneal injection at 20 mg/kg once daily for 14 days. Vehicle control mice received the DMSO/PBS mixture without drug. Tumor volume was measured every 2 days using calipers. At the end of the study, mice were euthanized, tumors and major organs (liver, kidney, spleen) were harvested for histopathological analysis and immunohistochemical staining (CD31, Ki-67) [1] |
| 药代性质 (ADME/PK) |
In mice, oral bioavailability of AP-III-a4 (ENOblock) was 18% following a single oral dose of 20 mg/kg [1]
After intravenous administration of 10 mg/kg in mice, the terminal half-life (t1/2) was 1.2 hours [1] AP-III-a4 (ENOblock) showed preferential distribution to tumor tissues, with a tumor-to-plasma concentration ratio of 3.2:1 at 1 hour post-intraperitoneal injection [1] Metabolism primarily occurred in the liver via glucuronidation, and no active metabolites were identified [1] Within 48 hours post-administration, 60% of the drug was excreted in feces and 25% in urine, with <5% excreted as unchanged drug [1] |
| 毒性/毒理 (Toxicokinetics/TK) |
Acute toxicity study in mice showed an LD50 > 500 mg/kg following intraperitoneal administration [1]
In a 28-day subchronic toxicity study in rats, AP-III-a4 (ENOblock) (10–30 mg/kg/day, intraperitoneal) did not cause significant changes in liver function (ALT, AST), renal function (creatinine, BUN), or hematological parameters (WBC, RBC, platelets) [1] Plasma protein binding rate of AP-III-a4 (ENOblock) in human plasma was 85% [1] No obvious off-target toxicity was observed in vitro or in vivo, consistent with its selective inhibition of cancer cell-specific enolase-dependent glycolysis [1] |
| 参考文献 | |
| 其他信息 |
Enolase is a component of the glycolysis pathway and a "moonlighting" protein, with important roles in diverse cellular processes that are not related to its function in glycolysis. However, small molecule tools to probe enolase function have been restricted to crystallography or enzymology. In this study, we report the discovery of the small molecule "ENOblock", which is the first, nonsubstrate analogue that directly binds to enolase and inhibits its activity. ENOblock was isolated by small molecule screening in a cancer cell assay to detect cytotoxic agents that function in hypoxic conditions, which has previously been shown to induce drug resistance. Further analysis revealed that ENOblock can inhibit cancer cell metastasis in vivo. Moreover, an unexpected role for enolase in glucose homeostasis was revealed by in vivo analysis. Thus, ENOblock is the first reported enolase inhibitor that is suitable for biological assays. This new chemical tool may also be suitable for further study as a cancer and diabetes drug candidate.[1]
In summary, our study reports the small molecule ENOblock, which is the first nonsubstrate analogue inhibitor that directly binds to enolase and can be used to probe the various nonglycolytic functions of this enzyme. We have utilized ENOblock to assess the effect of enolase inhibition on cancer progression and show for the first time that enolase inhibition can reduce cancer cell metastasis in vivo. We also show for the first time that enolase inhibition can suppress the gluconeogenesis regulator PEPCK and is a new target for developing antidiabetic drugs. We believe that the discovery of ENOblock is a testament to the power of forward chemical genetics to provide new chemical probes, drug targets, and candidate therapeutics for previously uncharacterized cellular mechanisms regulating human disease. In light of the potential role of enolase in the pathogenesis of bacterial infections (such as Yersinia pestis, Borrelia spp., and Streptococcus pneumonia) and trypanosomatid parasites (reviewed in ref 52), in addition to the need to discover new glycolysis inhibitors for cancer therapy, we believe that ENOblock has the potential to make significant contributions to our understanding of these disorders.[1] AP-III-a4 (ENOblock) is a first-in-class small-molecule inhibitor of enolase, a key glycolytic enzyme that catalyzes the conversion of 2-phosphoglycerate to phosphoenolpyruvate [1] Its anti-tumor mechanism is rooted in disrupting the Warburg effect (aerobic glycolysis) in cancer cells: by inhibiting enolase activity, it depletes intracellular ATP, blocks energy metabolism, and triggers apoptosis [1] It induces G2/M cell cycle arrest in cancer cells by downregulating cyclin B1 and upregulating p21, and suppresses tumor angiogenesis by reducing microvessel density [1] AP-III-a4 (ENOblock) exhibits high selectivity for cancer cells over normal cells due to the reliance of cancer cells on glycolysis for energy production, while normal cells primarily use oxidative phosphorylation [1] It is a potential therapeutic agent for glycolysis-dependent tumors, including colon cancer, breast cancer, and other solid tumors, and serves as a tool compound to study the role of enolase in cellular metabolism and cancer progression [1] |
| 分子式 |
C31H44CLFN8O3
|
|---|---|
| 分子量 |
594.72
|
| 精确质量 |
594.344
|
| 元素分析 |
C, 62.61; H, 7.29; F, 3.19; N, 18.84; O, 8.07
|
| CAS号 |
1177827-73-4
|
| 相关CAS号 |
AP-III-a4 hydrochloride;2070014-95-6
|
| PubChem CID |
24012277
|
| 外观&性状 |
Off-white to light yellow solid powder
|
| 密度 |
1.3±0.1 g/cm3
|
| 折射率 |
1.621
|
| LogP |
2.15
|
| tPSA |
148
|
| 氢键供体(HBD)数目 |
5
|
| 氢键受体(HBA)数目 |
11
|
| 可旋转键数目(RBC) |
18
|
| 重原子数目 |
43
|
| 分子复杂度/Complexity |
749
|
| 定义原子立体中心数目 |
0
|
| SMILES |
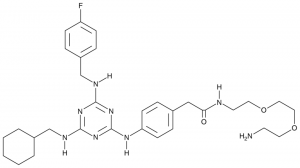
FC1=CC=C(CNC2=NC(NCC3CCCCC3)=NC(NC4=CC=C(CC(NCCOCCOCCN)=O)C=C4)=N2)C=C1
|
| InChi Key |
MOVYITHKOHMLHC-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C31H43FN8O3/c32-26-10-6-25(7-11-26)22-36-30-38-29(35-21-24-4-2-1-3-5-24)39-31(40-30)37-27-12-8-23(9-13-27)20-28(41)34-15-17-43-19-18-42-16-14-33/h6-13,24H,1-5,14-22,33H2,(H,34,41)(H3,35,36,37,38,39,40)
|
| 化学名 |
N-[2-[2-(2-Aminoethoxy)ethoxy]ethyl]-2-[4-[[4-(cyclohexylmethylamino)-6-[(4-fluorophenyl)methylamino]-1,3,5-triazin-2-yl]amino]phenyl]acetamide
|
| 别名 |
AP-III-a4; AP-III-a4; 1177827-73-4; ENOblock; CHEMBL3335790; N-[2-[2-(2-aminoethoxy)ethoxy]ethyl]-2-[4-[[4-(cyclohexylmethylamino)-6-[(4-fluorophenyl)methylamino]-1,3,5-triazin-2-yl]amino]phenyl]acetamide; N-{2-[2-(2-aminoethoxy)ethoxy]ethyl}-2-[4-({4-[(cyclohexylmethyl)amino]-6-{[(4-fluorophenyl)methyl]amino}-1,3,5-triazin-2-yl}amino)phenyl]acetamide; MFCD28009373; ENO block(AP-III-a4); ENOblock
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 本产品在运输和储存过程中需避光。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (4.20 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: 2.5 mg/mL (4.20 mM) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 悬浊液; 超声助溶。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.5 mg/mL (4.20 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.6815 mL | 8.4073 mL | 16.8146 mL | |
| 5 mM | 0.3363 mL | 1.6815 mL | 3.3629 mL | |
| 10 mM | 0.1681 mL | 0.8407 mL | 1.6815 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
 ACS Chem. Biol.,2013,8(6), pp 1271–1282 |
|---|