| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 2mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| 1g | |||
| Other Sizes |
| 靶点 |
NF-κB; IκB-α (IC50 = 10 μM)
|
|---|---|
| 体外研究 (In Vitro) |
体外活性:BAY 11-7085 通过抑制 NF-κB 来抑制 TNFα 诱导的粘附分子 E-选择素、VCAM-1 和 ICAM-1 的表达,在 10 μM 浓度下在 HUVEC 细胞中未检测到细胞毒性。 BAY 11-7085 增强紫杉醇对 NFkappaB 活性的抑制作用,并降低紫杉醇处理细胞的活力。此外,Bay11-7085和LY294002的组合在PEL细胞中产生协同凋亡作用。激酶测定:在凝胶激酶测定中,对磷酸化 IκB-α 的蛋白质进行如下详述。如所示,在存在或不存在抑制剂(20 μM,预处理 1 小时)的情况下,从用 TNFα(100 单位/ml)处理 15 分钟的 HUVEC 中制备全细胞提取物。在含有 0.5 mg/ml HIS-IκB-α 的 10% SDS 凝胶上分离蛋白质。将凝胶用 20% 丙醇、50 mM Hepes、pH 7.6 洗涤两次 30 分钟,用缓冲液 A(50 mM Hepes、pH 7.6、5 mM 2-巯基乙醇)洗涤两次 30 分钟,然后洗涤 1 小时与含有 6 M 尿素的缓冲液 A 一起孵育,在缓冲液 A 和 0.05% Tween 20 中的 3、1.5 和 0.75 M 尿素中各孵育 1 小时,在含有 0.05% Tween 20 的缓冲液 A 中孵育 1 小时。激酶测定进行 1 小时30 °C,存在 50 μM ATP、5 μCi/ml [32P]ATP、20 mM Hepes、pH 7.6、20 mM MgCl2、20 mM β-甘油磷酸、20 mM 对硝基苯磷酸盐、1 mM 钒酸钠, 2 mM 二硫苏糖醇。凝胶用5%三氯乙酸和1%焦磷酸钠洗涤,干燥,并曝光于胶片上。测定不含 HIS-IκB-α 的单独凝胶作为对照。细胞测定:分离人脐静脉内皮细胞(HUVEC)并维持在培养物中。通过形态学和MTT测定来评估细胞毒性。
ICAM-1、VCAM-1和E-选择素表面表达新型抑制剂的鉴定[1] 如Gerritsen等人(42)所述,通过荧光免疫测定法测量,两种结构相关的化合物,化合物1和化合物2/BAY 11-7085(图1),被鉴定为细胞因子诱导的ICAM-1表面表达的抑制剂。如“实验程序”所述,通过荧光免疫测定法测定药物对TNFα诱导的E-选择素、VCAM-1和ICAM-1表面表达的影响。化合物1和化合物2抑制了所有三种粘附分子的表面表达,IC50值在5-10μm范围内(图2)。为了确定受试化合物的作用是否可逆,我们将化合物1(10μm)存在下用TNFα刺激的细胞中的E-选择素水平与在没有受试药物的情况下用化合物1预处理细胞,然后用TNFα进行1小时“洗脱期”和3小时刺激时获得的水平进行了比较。用10μm化合物处理HUVEC可抑制57%的E-选择素表达,在TNFα治疗前“洗掉”药物时,也观察到类似的抑制水平(图3)。因此,化合物1不可逆地抑制E-选择素的表面表达。化合物1的其他作用是可逆的(见下文),表明无法逆转TNFα诱导的E-选择素表达的抑制不是由于化合物被细胞保留。即使用该剂量(10μm)的受试化合物处理细胞16小时后,MTT法也没有检测到细胞毒性(MTT法中的IC50范围为25-38μm)。因此,该药物很可能不可逆地改变细胞靶点。 抑制核NF-κB[1] TNFα诱导的粘附分子E-选择素、VCAM-1和ICAM-1的表达需要转录因子NF-κB(5、6、7、8、9、10、11、12)。因此,我们评估了受试化合物对NF-κB核转位的影响。我们进行了电泳迁移率变化分析,以确定在化合物1或化合物2/BAY 11-7085存在下,用TNFα处理的HUVEC核提取物中NF-κB的水平。如前所述,在没有试验化合物的情况下,TNFα诱导的NF-κB核转位发生在15分钟内(图4A,泳道2和图4B,泳道2)。在20μm时,两种测试化合物都完全抑制了核NF-κB(图4A,泳道4,图4B,泳道3)。较低剂量的化合物1(10μm)也降低了核NF-κB(图4A,泳道3)。 目前大多数治疗子宫内膜异位症的药物旨在下调雌激素活性。然而,药物治疗后的高复发率一直是最严重的问题。BAY 11-7085是一种可溶性NKκB激活抑制剂,已被证明可以抑制细胞增殖并诱导多种细胞凋亡。为了研究BAY 11-7085在治疗子宫内膜异位症中的潜在应用,我们通过改良的甲基噻唑四唑试验、5-溴-2'-脱氧尿苷掺入试验和核小体间DNA断裂试验研究了该药物对培养的卵巢子宫内膜异位囊肿间质细胞(ECSC)的细胞增殖和凋亡的影响。还通过流式细胞术测定了BAY 11-7085对ECSC细胞周期的影响。通过Western blot分析检测ECSC中凋亡相关分子的表达。BAY 11-7085显著抑制了ECSC的细胞增殖和DNA合成,并诱导了这些细胞的凋亡和G0/G1期细胞周期阻滞。此外,在用BAY 11-7085治疗后,在ECSC中观察到B细胞淋巴瘤/白血病-2(Bcl-2)和Bcl-X(L)表达下调,同时半胱氨酸天冬氨酸蛋白酶-3、-8和-9被激活。这些结果表明,BAY 11-7085通过抑制抗凋亡蛋白诱导ECSC凋亡,半胱氨酸天冬氨酸蛋白酶-3、-8和-9介导的级联参与了这一机制。因此,BAY 11-7085可以用作治疗子宫内膜异位症的治疗剂[2]。 BAY 11-7085对ECSC和NESC细胞增殖和细胞存活率的影响。[2] 通过改良的MTT法研究了BAY 11-7085对ECSC和NESC细胞增殖和细胞存活率的影响。如图1A所示,随着BAY 11-7085浓度的增加,存活的ECSC和NESC的数量显著减少(在10μM的浓度下,分别减少了66.1%和54.7%)。BAY 11-7085对ECSC细胞活力的抑制作用强于对NESC的抑制作用(图1B)。 为了进一步评估BAY 11-7085对细胞增殖的影响,通过BrdU掺入试验评估了BAY 11-7095处理后ECSC和NESC的DNA合成。如图2所示,BAY 11-7085治疗以剂量依赖的方式显著抑制了ECSC的BrdU掺入(在10μM浓度下减少53.2%),而BAY 11-7085对NESC的BrdU掺入仅具有微弱的抑制作用(在10微米浓度下减少38.2%)。 BAY 11-7085对内皮细胞和非内皮细胞凋亡的影响。[2] 通过评估核小体间DNA断裂的存在来评估BAY 11-7085对ECSC和NESC的凋亡作用。BAY 11-7085诱导了ECSC中核小体间DNA的断裂(图3和图4)。通过电泳在BAY 11-7085处理的ECSC中检测到DNA梯状条带,表明存在凋亡细胞(图3)。添加越来越多的BAY 11-7085显著诱导了ECSC和NESC的凋亡(在10μM的浓度下,分别增加了725.1%和368.2%;图4A)。BAY 11-7085对ECSC凋亡的刺激作用强于NESC(图4B)。 BAY 11-7085对内皮细胞周期的影响。[2] 通过流式细胞术测定BAY 11-7085对ECSC细胞周期的影响。如图5所示,在BAY 11-7085(10μM)存在下培养2天的ECSC导致这些细胞在细胞周期的G0/G1期积累,同时S期细胞的比例降低。在所有重复实验中都得到了类似的结果。 BAY 11-7085对内皮细胞凋亡相关蛋白表达的影响。[2] 为了分析上述发现的潜在机制,我们评估了ECSC中凋亡相关蛋白的表达。如图6所示,BAY 11-7085下调了ECSC中Bcl-2和Bcl-XL蛋白的表达,上调了切割的caspase-3、切割的caspase-8和切割的caspase-9蛋白的表达。ECSC中Bax、Fas和Fas配体蛋白的水平保持不变。在所有重复实验中都得到了类似的结果。 |
| 体内研究 (In Vivo) |
BAY 11-7085 抑制脑膜炎相关的 NF-κB 活性增加,从而改善受感染大鼠的临床状态,并显着减轻脑膜炎相关的 CNS 并发症和脑膜炎症。 BAY 11-7085 提高了紫杉醇诱导的对携带 Caov-3 细胞的无胸腺裸鼠腹内播散和腹水产生的抑制作用。
化合物2/BAY 11-7085[2]的抗炎作用 在两种体内炎症模型中评估了化合物2/BAY 11-7085。如图10所示,化合物2在大鼠角叉菜胶足爪模型中显示出剂量依赖性的肿胀减少。化合物2也在已建立的大鼠佐剂性关节炎中进行了评估(图11)。在溶媒处理的对照组中,两只后爪的平均体积增加了0.39±0.15 ml。化合物2以20 mg/kg而非5 mg/kg的剂量腹腔注射,显著降低了大鼠的平均爪水肿,达到与阳性对照地塞米松以1 mg/kg腹腔注射观察到的水平相似的水平。因此,该化合物在大鼠角叉菜胶爪和大鼠佐剂性关节炎模型中都起到了抗炎作用。 |
| 酶活实验 |
下面描述了凝胶激酶测定的程序,用于确定哪些蛋白质磷酸化 IκB-α。如图所示,在存在或不存在抑制剂(20 μM,预处理 1 小时)的情况下,从已暴露于 TNFα(100 单位/ml)15 分钟的 HUVEC 中制备全细胞提取物。使用含有 0.5 mg/ml HIS-IκB-α 的 10% SDS 凝胶来分离蛋白质。将凝胶用 20% 丙醇、50 mM Hepes、pH 7.6 洗涤两次 30 分钟,用缓冲液 A(50 mM Hepes、pH 7.6、5 mM 2-巯基乙醇)洗涤两次 30 分钟,然后洗涤 1 小时与含有 6 M 尿素的缓冲液 A 一起孵育,在缓冲液 A 和 0.05% Tween 20 中的 3、1.5 和 0.75 M 尿素中各孵育 1 小时,在含有 0.05% Tween 20 的缓冲液 A 中孵育 1 小时。激酶测定在 30℃下进行 1 小时。 30 °C,含有 50 μM ATP、5 Ci/ml [32P]ATP、20 mM Hepes、pH 7.6、20 mM MgCl2、20 mM 甘油磷酸盐、20 mM 磷酸对硝基苯酯、1 mM 钒酸钠和 2 mM 二硫苏糖醇。将凝胶干燥,曝光胶片,然后用5%三氯乙酸和1%焦磷酸钠洗涤。测试不含 HIS-IκB-α 的不同凝胶作为对照。
免疫复合物激酶测定[1] 从对照和TNFα处理的HUVEC制备提取物。细胞用Triton裂解缓冲液(TLB,20 mm Tris,pH 7.4,1%Triton X-100,10%甘油,137 mm NaCl,2 mm EDTA,25 mmβ-甘油磷酸酯,1 mm原钒酸钠,2 mm焦磷酸盐,1 mm苯甲基磺酰氟,10μg/ml亮肽)溶解。提取物在4°C下以14000×g离心15分钟。JNK、p38或ERK蛋白激酶通过在4°C下与结合蛋白-A琼脂糖的特异性兔多克隆抗体孵育1小时进行免疫沉淀。兔多克隆JNK-1和p38抗体已被描述。免疫沉淀物用TLB洗涤两次,用激酶缓冲液(20 mm Hepes,pH 7.4,20 mmβ-甘油磷酸,20 mm MgCl2,2 mm二硫苏糖醇,0.1 mm原钒酸钠)洗涤两次。通过在25μl的最终体积中加入1μg底物蛋白和50μm[γ-32P]ATP(10 Ci/mmol)来启动激酶测定。在30°C下15分钟后,通过加入Laemmli样品缓冲液终止反应。对照实验表明,在这些条件下,磷酸化反应与时间呈线性关系至少30分钟。通过SDS-聚丙烯酰胺凝胶电泳和放射自显影检查底物蛋白的磷酸化。 凝胶内激酶测定[1] 根据Hibi等人的方法对磷酸化IκB-α的蛋白质进行凝胶内激酶测定,如下所述。如所示,在化合物1(20μm,预处理1小时)存在或不存在的情况下,用TNFα(100单位/ml)处理HUVEC 15分钟,制备全细胞提取物。在含有0.5mg/ml HIS-IκB-α的10%SDS凝胶上分离蛋白质。将凝胶在20%丙醇、50 mm Hepes(pH 7.6)中洗涤两次30分钟,在缓冲液A(50 mm Hepe,pH 7.6,5 mm 2-巯基乙醇)中洗涤二次30分钟。随后,用含有6 m尿素的缓冲液A孵育1小时,在缓冲溶液A中的3、1.5和0.75 m尿素中各孵育1个小时,在含有0.05%吐温20的缓冲液中孵育1 h。激酶测定在30°C下在50μm ATP、5μCi/ml[32P]ATP、20 mm Hepes、pH 7.6、20 mm MgCl2、20 mmβ-甘油磷酸、20 mm对硝基苯磷酸、1 mm钒酸钠、2 mm二硫苏糖醇的存在下进行1小时。用5%三氯乙酸和1%焦磷酸钠洗涤凝胶,干燥并暴露于薄膜中。将不含HIS-IκB-α的单独凝胶作为对照进行检测。 |
| 细胞实验 |
ECSC 细胞与BAY 11-7085(0.01 至 10 μM)一起孵育 48 小时。然后,每孔加入 20 μL WST-1 染料,并将细胞再孵育 4 小时。每个实验均在 10% FBS 的情况下进行。 540 nm 处的吸光度用于评估细胞增殖[2]。
细胞表面荧光免疫分析[1] 如前所述,使用饱和浓度的单克隆抗体上清液和次级荧光偶联的F(ab′)2山羊抗鼠IgG(加利福尼亚州旧金山Caltag实验室),在4°C下,在微量滴定板中对活的人脐静脉内皮细胞单层进行细胞表面结合测定。使用自动微量滴定板读数器测定荧光强度。 白介素-6和白介素-8测定[1] 在96孔微量滴定板上生长至融合的HUVEC上评估化合物1和2对白细胞介素-6(IL-6)和白细胞介蛋白-8(IL-8)产生的影响。将细胞与浓度为0、1、5、10或25μm的药物预孵育,然后与TNFα(10单位/ml)和药物孵育16小时。取出培养上清液,使用酶联免疫测定试剂盒测定IL-6和IL-8含量。 电泳迁移率变化分析[1] 如前所述,在10μg/ml抑肽酶、10μg/ml亮肽、1.5μg/ml pepstatin A、40μm ALLN(钙蛋白酶抑制剂1)、1mm原钒酸钠和1mm氟化钠的存在下,从试验或对照HUVEC制备核提取物。将寡核苷酸进行凝胶纯化、退火,并用[α-32P]dCTP(50μCi;比活3000 Ci/mmol)和大肠杆菌DNA聚合酶I的Klenow片段进行末端标记。在10 mm Tris、pH 7.5、1 mm二硫苏糖醇、1 mm EDTA、5%甘油和1μg聚(dI·dC)的存在下进行结合反应,并如前所述进行电泳。使用以下寡核苷酸:VCAM-κB(vNF-WT)、5′CTGGGTTTCTCTTGAAGGATTTCCCTC和互补链。蛋白质-DNA复合物在4%聚丙烯酰胺凝胶上分离。 蛋白质印迹[1] 在HUVEC的实验处理后,制备细胞溶质和核蛋白提取物,在10%SDS-聚丙烯酰胺凝胶上进行电泳,并如前所述在25 mm Tris、192 mm甘氨酸、5%甲醇中在100 V下转移到硝化纤维中1小时(10,27)。使用1:1000稀释的抗IκBα和抗p38抗血清。以1:1000的稀释度使用针对磷酸化p38(Tyr-182)的兔抗血清。使用1:1000稀释的小鼠抗磷酸酪氨酸抗体。使用1:10000辣根过氧化物酶连接的驴抗兔或羊抗小鼠二次抗血清,通过增强化学发光方案检测免疫反应蛋白。将印迹暴露在胶片上1-15分钟,然后显影。 评估ECSC和NESC的细胞增殖和细胞存活率。[2] 按照制造商的方案,使用WST-1通过改良的甲基噻唑四唑(MTT)试验在96孔板中测定经BAY 11-7085处理后的ECSC和NESC的细胞增殖和细胞存活率。我们将5×104个细胞在添加了10%FBS的DMEM中分配到96孔平底微孔板的每个孔中,并孵育过夜。然后移除培养基,将细胞与200μl含有不同浓度BAY 11-7085(0.01-10μM)的实验培养基一起孵育48小时。此后,向每个孔中加入20μl WST-1染料,并将细胞进一步孵育4小时。所有实验均在10%FBS存在下进行。通过测量540nm处的吸光度来评估细胞增殖。数据计算为BAY 11-7085处理细胞与未处理对照细胞的比值。 采用细胞增殖酶联免疫吸附试验,通过5-溴-2′-脱氧尿苷(BrdU)掺入法测定经BAY 11-7085处理后ECSC和NESC的细胞增殖。我们将1×104个细胞放入添加了10%FBS的DMEM中,放入96孔平底微孔板的每个孔中,并孵育过夜。然后移除培养基,将细胞与100μl含有不同浓度BAY 11-7085(0.01-10μM)的实验培养基一起孵育48小时。然后,我们向每个孔中加入10μl BrdU(10mM),并将样品孵育2小时。然后根据制造商的方案评估BrdU掺入情况。所有实验均在10%FBS存在下进行。通过测量450nm处的吸光度来评估细胞增殖。数据计算为BAY 11-7085处理细胞与未处理对照细胞的比值。 ECSC核小体间DNA断裂的评估。[2] 如前所述,使用快速凋亡DNA梯检测试剂盒评估了BAY 11-7085治疗后ECSC核小体间DNA断裂。将ECSC的细胞(1×107)铺在100毫米的培养皿上,培养皿中装有10毫升补充了10%热灭活FBS的DMEM,并培养过夜。然后用含有BAY 11-7085(10μM)的新鲜培养基(DMEM+10%FBS)替换上清液。刺激24小时后,根据制造商的方案从这些细胞中提取DNA。通过琼脂糖凝胶电泳(1.2%)分析DNA断裂。通过溴化乙锭染色使DNA条带可视化,并在紫外光下使用透照器拍摄。 评估BAY 11-7085诱导的ECSC和NESC凋亡。[2] 如前所述,通过细胞死亡检测ELISA(罗氏)直接测定核小体DNA断裂来定量BAY 11-7085诱导的ECSC和NESC凋亡。该检测使用针对片段DNA中组蛋白的特异性单克隆抗体,可以测定细胞裂解物细胞质部分中的单核小体和寡核小体。简而言之,将1×106个细胞铺在24孔培养板上,在1ml含有10%热灭活FBS的培养基中培养过夜。用含有不同量BAY 11-7085(0.01-10μM)的新鲜培养基(DMEM+10%FBS)代替上清液。刺激24小时后,根据制造商的说明裂解细胞,然后离心(200 g,5分钟)。使用抗组蛋白生物素抗体测定上清液中含有的单核小体和寡核小体。以2,2′-偶氮二(3-乙基苯并噻唑啉磺酸盐)为底物,在405nm波长下用光度法测定核小体抗体的浓度。数据计算为BAY 11-7085处理细胞与未处理对照细胞的比值。 流式细胞术分析细胞周期。[2] 如前所述,在有或没有BAY 11-7085的培养2天后,通过流式细胞术分析细胞周期。简而言之,ECSC在添加了10%FBS的DMEM中以<60%的融合率培养2天,有或没有BAY 11-7085(10μM)的存在。然后将它们胰蛋白酶化,用磷酸盐缓冲盐水(PBS)洗涤,用甲醇固定,在4°C的黑暗中用5μg/ml碘化丙啶、1 mg/ml RNase和0.1%Nonidet P-40溶液孵育30分钟。染色后立即使用CellFIT程序对细胞周期进行流式细胞术分析,其中使用RFit模型计算S期。 ECSC中凋亡相关蛋白表达的评估。[2] 通过蛋白质印迹分析,研究了内皮细胞中凋亡相关蛋白(Bcl-2、Bcl-XL、Bax、Fas、Fas配体、caspase-3、caspase-8和caspase-9)和甘油醛-3-磷酸脱氢酶(GAPDH)的表达。在100毫米培养皿上培养亚流ECSC 24小时,有或没有BAY 11-7085(10μM)。 |
| 动物实验 |
Rats: Rats receive 0.1 mL of 1% suspension of carrageenan in distilled water as a subplantar injection into the footpad of the right hind paw. Rats receive either a fine suspension of BAY 11-7085/compound 2 (1, 5 or 50 mg/kg) in vehicle or vehicle (polyethylglycol 400 diluted 1:5 in 5% bovine serum albumin/water) intraperitoneally for one hour prior to injection. Rats pretreated with 20 mg/kg of ibuprofen are part of a positive control group that is also present. The injection volume of the paw is measured four hours after carrageenan administration. Edema volume is calculated[1].
Carrageenan Paw Edema [1] Male Harlan Sprague Dawley rats 150–175 g were used. A 1% suspension of carrageenan in distilled water was administered to rats as 0.1 ml subplantar injection into the footpad of the right hind paw as described previously. One h prior to injection rats were treated intraperitoneally with vehicle (polyethylglycol 400 diluted 1:5 in 5% bovine serum albumin/H2O) or a fine suspension of compound 2/BAY 11-7085 (1, 5, or 50 mg/kg) in vehicle. A positive control group was also included in which rats were pretreated with 20 mg/kg ibuprofen. Four hours after carrageenan administration, the volume of the injected paw was measured by means of a water displacement plethysmograph. Edema volumes were determined as the difference between the paw volumes of each rat at time 0 and 4 h. Each group contained five animals. Data were analyzed by a one-way analysis of variance and, if indicated, differences between groups analyzed by Bonferroni's modifiedt test. A p < 0.05 was considered significant. Adjuvant Arthritis [1] Inbred, male Lewis rats 8–10 weeks of age weighing 250–275 g were used. Five animals per group were used, and the animals were allowed to feed ad libitum on laboratory rat chow and water. Heat-inactivated Mycobacterium butyricum was suspended at 10 mg/ml in mineral oil and administered as 0.1-ml injection (1 mg/animal) at the base of the tail. Paw volumes were determined by a water displacement plethysmograph as described above. Volumes were determined on the indicated dates and values compared with initial time 0 measurements. Vehicle (0.5% methyl cellulose) or drug (compound 2/BAY 11-7085 or dexamethasone at the indicated concentrations) was administered once a day as an intraperitoneal injection (200 μl). Data from these studies are expressed as the mean difference in foot pad volume. At day 20 animals were sacrificed by CO2 inhalation. |
| 参考文献 |
|
| 其他信息 |
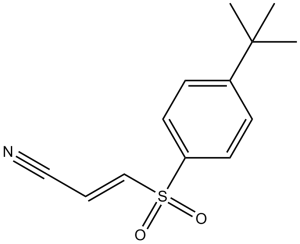
BAY 11-7085 is a sulfone that is benzene substituted by [(E)-2-cyanoethenyl]sulfonyl and tert-butyl groups at position 1 and 4, respectively. It is an irreversible inhibitor of IkappaB-alpha phosphorylation in cells (IC50 = 10 muM) and prevents the activation of NF-kappaB. It has a role as an anti-inflammatory agent, a ferroptosis inducer, a NF-kappaB inhibitor, an apoptosis inducer, an autophagy inducer, an antibacterial agent, an EC 2.7.11.10 (IkappaB kinase) inhibitor and an antineoplastic agent. It is a nitrile, a sulfone and a member of benzenes.
We have identified two compounds that inhibit the expression of endothelial-leukocyte adhesion molecules intercellular adhesion molecule-1, vascular cell adhesion molecule-1, and E-selectin. These compounds act by inhibiting tumor necrosis factor-alpha-induced phosphorylation of IkappaB-alpha, resulting in decreased nuclear factor-kappaB and decreased expression of adhesion molecules. The effects on both IkappaB-alpha phosphorylation and surface expression of E-selectin were irreversible and occurred at an IC50 of approximately 10 microM. These agents selectively and irreversibly inhibited the tumor necrosis factor-alpha-inducible phosphorylation of IkappaB-alpha without affecting the constitutive IkappaB-alpha phosphorylation. Although these compounds exhibited other activities, including stimulation of the stress-activated protein kinases, p38 and JNK-1, and activation of tyrosine phosphorylation of a 130-140-kDa protein, these effects are probably distinct from the effects on adhesion molecule expression since they were reversible. One compound was evaluated in vivo and shown to be a potent anti-inflammatory drug in two animal models of inflammation. The compound reduced edema formation in a dose-dependent manner in the rat carrageenan paw edema assay and reduced paw swelling in a rat adjuvant arthritis model. These studies suggest that inhibitors of cytokine-inducible IkappaBalpha phosphorylation exert anti-inflammatory activity in vivo.[1] The anti-inflammatory effects of the test compounds in two animal models are striking and are consistent with the action of other pharmacologic agents that inhibit adhesion molecule expression and leukocyte recruitment. Since these novel compounds inhibit NF-κB signaling, they would be expected to affect κB-dependent expression of many other genes including IL-1, IL-6, tissue factor, and TNFα in lymphoid cells, monocytes, and endothelial cells (reviewed in Ref. 24). Thus, the observed anti-inflammatory action probably reflects not just inhibition of adhesion molecules but also effects on many other important mediators of inflammation in a variety of cell types. Understanding the mechanism by which these agents disrupt the NF-κB/IκB regulatory pathway will be useful in identifying novel anti-inflammatory agents that are both highly specific and effective. Such drugs may be useful as therapeutic agents in disorders involving up-regulation of endothelial adhesion molecules including ischemia, reperfusion injury, asthma, transplantation, inflammatory bowel disease, rheumatoid arthritis, and atherosclerosis. [1] Most of the current medical treatments for endometriosis aim to downregulate estrogen activity. However, a high recurrence rate after medical treatment has been the most significant problem. BAY 11-7085, a soluble inhibitor of NK-kappaB activation, has been shown to inhibit cell proliferation and induce apoptosis of a variety of cells. To examine the potential application of BAY 11-7085 in the treatment of endometriosis, we investigated the effects of this agent on the cell proliferation and apoptosis of cultured ovarian endometriotic cyst stromal cells (ECSCs) by a modified methylthiazole tetrazolium assay, a 5-bromo-2'-deoxyuridine incorporation assay, and internucleosomal DNA fragmentation assays. The effect of BAY 11-7085 on the cell cycle of ECSCs was also determined by flow cytometry. The expression of apoptosis-related molecules was examined in ECSCs with Western blot analysis. BAY 11-7085 significantly inhibited the cell proliferation and DNA synthesis of ECSCs and induced apoptosis and the G0/G1 phase cell cycle arrest of these cells. Additionally, downregulation of the B-cell lymphoma/leukemia-2 (Bcl-2) and Bcl-X(L) expression with simultaneous activation of caspase-3, -8, and -9 was observed in ECSCs after treatment with BAY 11-7085. These results suggest that BAY 11-7085 induces apoptosis of ECSCs by suppressing antiapoptotic proteins, and that caspase-3-, -8-, and -9-mediated cascades are involved in this mechanism. Therefore, BAY 11-7085 could be used as a therapeutic agent for the treatment of endometriosis.[2] In summary, we have demonstrated that BAY 11-7085 is able to induce apoptosis and the G0/G1-phase cell cycle arrest of ECSCs. Downregulation of Bcl-2 and Bcl-XL expression with simultaneous upregulation of cleaved caspase-3, cleaved caspase-8, and cleaved caspase-9 expression was induced by BAY 11-7085 treatment, suggesting that BAY 11-7085 may be applicable for the medical treatment of endometriosis as an adjuvant approach in combination with current medical treatment for this disease. Further studies with other inhibitors of NF-κB, JNK, or p38 MAPK on the cell proliferation and apoptosis of endometriotic cells may contribute to the establishment of more effective and sophisticated treatment strategies for endometriosis. [2] |
| 分子式 |
C13H15NO2S
|
|
|---|---|---|
| 分子量 |
249.33
|
|
| 精确质量 |
249.082
|
|
| 元素分析 |
C, 62.63; H, 6.06; N, 5.62; O, 12.83; S, 12.86
|
|
| CAS号 |
196309-76-9
|
|
| 相关CAS号 |
|
|
| PubChem CID |
5353432
|
|
| 外观&性状 |
White to off white solid powder
|
|
| 密度 |
1.1±0.1 g/cm3
|
|
| 沸点 |
407.1±45.0 °C at 760 mmHg
|
|
| 熔点 |
80-82℃
|
|
| 闪点 |
200.0±28.7 °C
|
|
| 蒸汽压 |
0.0±0.9 mmHg at 25°C
|
|
| 折射率 |
1.535
|
|
| LogP |
2.51
|
|
| tPSA |
66.31
|
|
| 氢键供体(HBD)数目 |
0
|
|
| 氢键受体(HBA)数目 |
3
|
|
| 可旋转键数目(RBC) |
3
|
|
| 重原子数目 |
17
|
|
| 分子复杂度/Complexity |
420
|
|
| 定义原子立体中心数目 |
0
|
|
| SMILES |
S(/C=C/C#N)(C1C=CC(=CC=1)C(C)(C)C)(=O)=O
|
|
| InChi Key |
VHKZGNPOHPFPER-ONNFQVAWSA-N
|
|
| InChi Code |
InChI=1S/C13H15NO2S/c1-13(2,3)11-5-7-12(8-6-11)17(15,16)10-4-9-14/h4-8,10H,1-3H3/b10-4+
|
|
| 化学名 |
(E)-3-(4-tert-butylphenyl)sulfonylprop-2-enenitrile
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.08 mg/mL (8.34 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 20.8 mg/mL澄清DMSO储备液加入400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.08 mg/mL (8.34 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 20.8 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.08 mg/mL (8.34 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 4.0107 mL | 20.0537 mL | 40.1075 mL | |
| 5 mM | 0.8021 mL | 4.0107 mL | 8.0215 mL | |
| 10 mM | 0.4011 mL | 2.0054 mL | 4.0107 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
|
|---|
|
|
|
|---|