| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
LPDE4 (IC50 = 100 nM); HPDE4 (IC50 = 120 nM)
|
|---|---|
| 体外研究 (In Vitro) |
Cilomilast会抑制人类中性粒细胞功能(0.1 nM–10 μM;5 分钟)[2]。暴露于 Cilomilast (0.1 nM–10 μM) 5 分钟会抑制嗜酸性粒细胞化学发光反应[2]。西洛司特(0.001-100 μM;30 分钟)可防止人单核细胞和人全血合成 TNFα[2]。
从一系列苯酰胺衍生物中,roflumilast(3-环丙基甲氧基-4-二氟甲氧基- n -[3,5-二氯吡啶-4-基]-苯酰胺)被鉴定为一种有效的选择性PDE4抑制剂。它抑制人中性粒细胞PDE4的活性,IC(50)为0.8 nM,即使在10,000倍的浓度下也不影响PDE1(牛脑),PDE2(大鼠心脏)和PDE3和PDE5(人血小板)。罗氟米司特在体内形成的主要代谢物(罗氟米司特n -氧化物)和piclamilast (RP 73401)的效力几乎相同,但比罗利普兰和Ariflo的效力高100多倍(Cilomilast;SB207499)。利用细胞特异性反应研究了罗氟司特及其参比化合物在各种人类白细胞中的抗炎和免疫调节潜能:中性粒细胞[n-甲酰基-甲基-leucyl-苯丙氨酸(fMLP)诱导的LTB(4)和活性氧(ROS)的形成],嗜酸性粒细胞(fMLP-和c5a诱导的ROS的形成),单核细胞,单核细胞来源的巨噬细胞,树突状细胞(脂多糖诱导的肿瘤坏死因子α合成),和CD4+ T细胞(抗cd3 /抗cd28单克隆抗体刺激的增殖,IL-2, IL-4, IL-5和干扰素γ释放)。与细胞类型和所研究的反应无关,罗氟司特相应的IC值(半最大抑制)在一个狭窄的范围内(2-21 nM),与罗氟司特n -氧化物(3-40 nM)和piclamilast (2-13 nM)非常相似。相比之下,西洛司特(40-3000 nM)和罗利普兰(10-600 nM)对中性粒细胞的效价最高,差异更大。与代表终末炎症效应细胞的中性粒细胞和嗜酸性粒细胞相比,罗氟司特及其n -氧化物对单核细胞、CD4+ T细胞和树突状细胞的相对效力明显高于西罗司特和罗利普兰,这可能反映了免疫调节潜力的改善。罗氟米司特在体外和体内的疗效(见本期随附文章)表明,罗氟米司特将有助于治疗慢性炎症性疾病,如哮喘和慢性阻塞性肺病。[2] 第一代磷酸二酯酶4 (PDE4)抑制剂,如罗利普兰,抑制免疫和炎症细胞的激活。这些化合物的临床应用受到胃肠道副作用的限制,如胃酸分泌增加和恶心。因此,挑战在于设计新的PDE4抑制剂,既能维持罗利普兰的抗炎作用,又能改善其副作用。在这类新的PDE4抑制剂中,第一个专门设计的治疗指数相对于早期化合物有改善的是Cilomilast/SB 207499 (Ariflo) [c-4-氰基-4-(3-环戊氧基-4-甲氧基苯基)-r-1-环己anecarboxyl酸]。在本研究中,我们比较了西罗米司特/ sb207499与罗利普兰的抗炎和促胃分泌活性。使用的细胞模型是(1)人嗜碱性粒细胞释放组胺,(2)人单核细胞产生肿瘤坏死因子α,(3)人中性粒细胞脱颗粒,(4)人T细胞抗原驱动增殖和细胞因子合成,(5)兔离体胃腺分泌酸。SB 207499以浓度依赖性的方式抑制多种免疫和炎症细胞的激活:(1)嗜碱性粒细胞组胺释放[-log IC25 = 6.6 +/- 0.3, (R)-罗利普兰为8.0],(2)脂多糖诱导单核细胞tnf - α形成[-log IC50 = 7.0 +/- 0.1, (R)-罗利普兰为7.2 +/- 0.1],(3)fmlp诱导中性粒细胞脱粒[-log IC15 = 7.1 +/- 0.2, (R)-罗利普兰为6.4 +/- 0.5],(4)尘螨诱导外周血单核细胞增殖[-log IC40 = 6.5 +/- 0.3, (R)-罗利普兰为6.4 +/- 0.3];(5)豚草诱导干扰素- γ的产生[-log IC50 = 5.4]和白细胞介素-5 [-log IC50 = 5.0]。虽然SB 207499抑制多种免疫和炎症细胞的激活,其效力与罗利普兰相当,但其作为酸性促分泌剂的效力比后者低100倍[-log EC50 = 6.1 +/- 0.1 vs. (R)-罗利普兰的8.3 +/- 0.2]。综上所述,这些数据表明Cilomilast/SB 207499保留了典型PDE4抑制剂罗利普兰的抗炎活性,但刺激胃酸分泌的可能性大大降低。[3] 一种快速有效的刺激骨再生的方法将有助于骨科干细胞治疗。罗利普兰是磷酸二酯酶4 (PDE4)的抑制剂,PDE4介导环磷酸腺苷(cAMP)降解。全身注射罗利普兰促进骨形态发生蛋白2 (BMP-2)诱导的小鼠成骨。然而,关于PDE4抑制剂调控成骨细胞基因表达的确切机制的数据很少。在本研究中,我们研究了BMP-2与第二代PDE4抑制剂Cilomilast联合促进间充质干细胞(MSCs)成骨分化的能力。用PDE4抑制剂(Cilomilast或rolipram)、BMP-2和/或H89处理的MSCs的碱性磷酸酶(ALP)活性与仅用成骨培养基(OM)分化的MSCs的ALP活性进行比较。此外,采用实时聚合酶链反应(RT-PCR)定量检测Runx2、osterix和骨钙素的表达。在原代培养的骨髓间充质干细胞中,西洛司特与罗利普兰同样能促进骨髓间充质干细胞成骨分化。此外,通过H89抑制实验,我们发现Smad通路是介导BMP-2成骨作用的重要信号转导通路,PDE4抑制剂诱导cAMP水平升高可强化这种作用。[4] |
| 体内研究 (In Vivo) |
在小鼠中,Cilomilast/SB-207499(1-100 mg/kg;口服)可显着且剂量依赖性地抑制人 TNFα 的产生[1]。 SB-207499(0.1-100 mg/kg;口服强饲)的 ED50 为 2.3 mg/kg,可恢复利血平引起的小鼠体温过低[1]。在小鼠中,SB-207499(500 μg/耳;bid,持续 6 天)可抑制病灶内 IL-4 浓度和慢性恶唑酮诱导的炎症反应[1]。
第二代磷酸二酯酶4抑制剂Cilomilast/SB 207499 (Ariflo) [c-4-氰基-4-(3-环戊氧基-4-甲氧基苯基)-r-l-环己烷羧酸]在体内抑制炎症细胞因子产生的能力进行了评估,并与第一代磷酸二酯酶4抑制剂罗利普兰进行了比较。为了检测人肿瘤坏死因子α (TNFalpha)的产生,我们将人单核细胞移入Balb/c小鼠体内,并用脂多糖(LPS)刺激。在该模型中,SB 207499以4.9 mg/kg的ED50抑制人TNFalpha的产生。同样,r -罗利普兰抑制人TNFalpha的产生,ED50为5.1 mg/kg, p.o。与它们对TNFalpha产生的等效活性相反,SB 207499 (ED50 = 2.3 mg/kg, p.o)在逆转利平诱导的低温(一种抗抑郁活性模型)方面的效力比r -罗利普兰(ED50 = 0.23 mg/kg, p.o)低10倍。在时间过程研究中,sb207499 (30 mg/kg, p.o)抑制TNFalpha的产生至少10小时;在相同的时间间隔内检测到大量的SB 207499血浆浓度。在慢性恶唑酮诱导的Balb/c小鼠接触敏感性模型中,研究了Cilomilast/ sb207499在体内调节白细胞介素-4产生的能力。在该模型中,局部给药SB 207499(1000微克)可抑制局内白介素-4浓度(55%;P < . 01)。结果表明SB 207499在体内多种情况下是一种有效的炎症细胞因子产生抑制剂。此外,尽管它在抑制TNFalpha产生方面与r -罗利普兰一样有效,但它的中枢神经系统活性却大大降低。因此,SB 207499是评估PDE4抑制剂抗炎潜力的绝佳候选药物。[1] |
| 细胞实验 |
骨髓细胞的制备及细胞培养[4]
根据Kopen等人的方案分离大鼠间质细胞。用α-MEM培养液和加肝素的青霉素/链霉素(分别为50 U/mL和50 mg/mL)冲洗股骨和胫骨,取4周龄雄性Wistar大鼠胫骨和股骨的骨髓。然后将细胞在不含肝素的培养基中洗涤,离心,并在涂有纤维连接蛋白的培养皿中镀。1天后,用PBS洗涤3次去除非贴壁细胞。贴壁细胞在标准培养基中进一步培养3天。MSCs在37℃、5% CO2气氛中生长。每周更换培养基2次,每周进行亚培养。传代3时,胰蛋白酶化细胞,并以38,000/cm2的密度进行电镀,用于实验。3天后,加入有试剂和不含试剂的培养基。处理11天(茜素红染色21天),每3天更换一次培养基。 RNA制备和RT-PCR [4] 根据制造商的说明,使用QuickGene-Mini80从存在PDE4抑制剂、BMP-2、标准和成骨培养基的培养细胞中分离总RNA。使用SuperScript™III CellsDirect cDNA Synthesis系统逆转录总RNA (1 μg)。反应程序为25℃下10 min, 37℃下2 h, 85℃下5 s。用SYBR®Green Real-time PCR Master Mix在20 μ l的反应液中扩增cDNA。在StepOne Plus中进行扩增,初始变性步骤为95°C,持续10分钟,然后在95°C下变性15 s,在指定温度下退火60 s,在72°C下延长60 s,进行35个循环。PCR引物序列和退火温度见表1。 碱性磷酸酶活性测定[4] 用该试剂处理11天后,对细胞培养物进行ALP活性测定。使用TRACP & ALP测定试剂盒测定细胞内ALP活性。用PBS洗涤细胞3次,然后用500 μL含生理盐水和1% NP-40的裂解缓冲液裂解细胞。还从DMSO、标准培养基和成骨培养基中培养的细胞制备裂解物作为对照。然后将细胞裂解液与含有对硝基苯磷酸的实验混合物混合,在37°C下孵育30分钟,此时加入0.4 M NaOH停止反应。孵育后,用分光光度计在405 nm处测定反应释放的对硝基苯酚的量。所有值都根据单元格数归一化。用Bio-Rad蛋白检测试剂盒测定细胞裂解液中的蛋白。数据以每毫克蛋白质的碱性磷酸酶活性的比率表示。 茜素红染色[4] 细胞用PBS洗涤2次,10%福尔马林固定10分钟。细胞用1%茜素红溶液在37℃下染色10分钟,PBS洗涤3次。 |
| 动物实验 |
Animal/Disease Models: Male balb/c (Bagg ALBino) mouse (18-25 g) are injected with human monocytes and LPS[1]
Doses: 1, 5, 10, 50, 100 mg/kg Route of Administration: Po after the injection of human monocytes and before LPS challenge Experimental Results: Inhibited the production of human TNFα, with an ED50 of 4.9 mg/kg. |
| 参考文献 |
|
| 其他信息 |
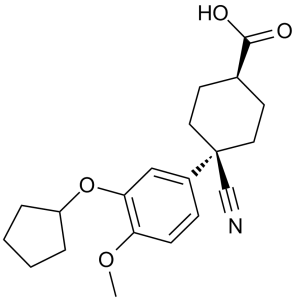
4-cyano-4-(3-cyclopentyloxy-4-methoxyphenyl)-1-cyclohexanecarboxylic acid is a member of methoxybenzenes.
Cilomilast (Ariflo, SB-207,499) is a drug which was developed for the treatment of respiratory disorders such as asthma and Chronic Obstructive Pulmonary Disease (COPD). It is orally active and acts as a selective Phosphodiesterase-4 inhibitor. Following four clinical trials, the drug proved to be effective in treating COPD, however it has never been marketed due to a poor side effect profile. Drug Indication Investigated for use/treatment in chronic obstructive pulmonary disease (COPD). Mechanism of Action Cilomilast shows high selectivity for cAMP-specific PDE4, an isoenzyme that predominates in pro-inflammatory and immune cells and that is 10-fold more selective for PDE4D than for PDE4A, -B or -C. In vitro, Cilomilast suppresses the activity of several pro-inflammatory and immune cells that have been implicated in the pathogenesis of asthma and COPD. Moreover, it is highly active in animal models of these diseases. Cilomilast has been shown to exert potent anti-inflammatory effects both in vitro and in vivo. In this study, we investigated osteoblast differentiation in the combined presence of BMP-2 and PDE4 inhibitors. Our results support the notions that signal transduction via the cAMP pathway is necessary but not sufficient to induce MSC differentiation. In fact, PDE4 inhibitor alone did not induce a complete differentiation of MSCs, even though the PDE4 inhibitor could enhance the effect of BMP-2. Moreover, we demonstrated that the cAMP pathway is not involved in the differentiation of primary MSC induced by BMP-2 alone but is critical in the enhancement of bone formation in the presence of PDE4 inhibitors and BMP-2. We have shown that Cilomilast, a second-generation PDE4 inhibitor, could be a useful new tool in orthopaedic stem cell therapies, because it is able to induce rapid mineralisation in the presence of BMP-2. [4] |
| 分子式 |
C20H25NO4
|
|
|---|---|---|
| 分子量 |
343.42
|
|
| 精确质量 |
343.178
|
|
| 元素分析 |
C, 69.95; H, 7.34; N, 4.08; O, 18.64
|
|
| CAS号 |
153259-65-5
|
|
| 相关CAS号 |
|
|
| PubChem CID |
151170
|
|
| 外观&性状 |
White to off-white solid powder
|
|
| 密度 |
1.2±0.1 g/cm3
|
|
| 沸点 |
549.1±50.0 °C at 760 mmHg
|
|
| 熔点 |
157ºC
|
|
| 闪点 |
285.9±30.1 °C
|
|
| 蒸汽压 |
0.0±1.6 mmHg at 25°C
|
|
| 折射率 |
1.568
|
|
| LogP |
3.3
|
|
| tPSA |
79.55
|
|
| 氢键供体(HBD)数目 |
1
|
|
| 氢键受体(HBA)数目 |
5
|
|
| 可旋转键数目(RBC) |
5
|
|
| 重原子数目 |
25
|
|
| 分子复杂度/Complexity |
511
|
|
| 定义原子立体中心数目 |
0
|
|
| SMILES |
COC1=C(C=C(C=C1)C2(CCC(CC2)C(=O)O)C#N)OC3CCCC3
|
|
| InChi Key |
CFBUZOUXXHZCFB-LDTOLXSISA-N
|
|
| InChi Code |
InChI=1S/C20H25NO4/c1-24-17-7-6-15(12-18(17)25-16-4-2-3-5-16)20(13-21)10-8-14(9-11-20)19(22)23/h6-7,12,14,16H,2-5,8-11H2,1H3,(H,22,23)/t14-,20+
|
|
| 化学名 |
cis-4-Cyano-4-[3-(cyclopentyloxy)-4-methoxyphenyl]cyclohexanecarboxylic acid
|
|
| 别名 |
Cilomilast; SB 207499; Cilomilast; 153259-65-5; Ariflo; SB-207,499; SB 207,499; SB207,499; Cilomilast [USAN:INN]; Ariflo (TN); SB207499; Ariflo; SB-207499;
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (7.28 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (7.28 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.5 mg/mL (7.28 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 配方 4 中的溶解度: 5% DMSO+95% Corn oil:30 mg/mL 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.9119 mL | 14.5594 mL | 29.1189 mL | |
| 5 mM | 0.5824 mL | 2.9119 mL | 5.8238 mL | |
| 10 mM | 0.2912 mL | 1.4559 mL | 2.9119 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
| NCT Number | Recruitment | interventions | Conditions | Sponsor/Collaborators | Start Date | Phases |
| NCT00103922 | Completed | Drug: cilomilast | Pulmonary Disease, Chronic Obstructive | GlaxoSmithKline | November 2004 | Phase 3 |
|
|---|
|
|