| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
| 靶点 |
Ionizable cationic lipid for siRNA delivery
|
|---|---|
| 体外研究 (In Vitro) |
DLinDMA 的结构由三个主要区域组成:烃链、连接基和头基 [1]。
在原代APC中,含LNP的DLinKC2-DMA在体外表现出最有效的siRNA介导的基因沉默。 含有DLinKC2-DMA的LNPs在APC中的吸收率最高。 通过荧光显微镜测定,含有DLinKC2-DMA的NP表现出最大的siRNA细胞质递送。 LNP-siRNA系统通过内吞作用在APC中递送siRNA。含有DLinKC2-DMA的NP对APCs相对无毒[2] 脂质纳米粒(LNPs)是目前使用小干扰RNA沉默肝细胞靶基因的最有效的体内递送系统。抗原呈递细胞(APCs)也是LNP-siRNA的潜在靶标。我们研究了在含有四种不同可电离阳离子脂质的LNPs中配制的siRNA在原代骨髓巨噬细胞(bmMΦ)和树突状细胞中的摄取、细胞内运输和基因沉默能力,即DLinDAP、DLinDMA 、DLinK-DMA和DLinKC2-DMA。根据其抑制GAPDH靶蛋白产生的能力,含有DLinKC2-DMA的LNPs是最有效的制剂。此外,使用荧光标记的siRNA对内体与细胞层siRNA定位的共聚焦研究表明,含有DLinKC2-DMA的LNPs是最有效的细胞内递送剂。DLinK-DMA和DLinKC2 DMA制剂相对于DLinDMA表现出更好的基因沉默能力,但毒性较小[2]。 |
| 体内研究 (In Vivo) |
在小鼠中,DLinDMA 的血液药代动力学特征几乎相同 [1]。
DLinKC2-DMA治疗在体内产生的TNF-α量微不足道[2] 还研究了转染的MΦ响应LNPs产生TNF-α的潜力,作为摄取细胞刺激的读数。BmMΦ在体外与用研究的LNPs配制的不同剂量的siRNA一起孵育,或分离siRNA-DLinKC2-DMA处理的小鼠的脾脏MΦ,并通过流式细胞术在细胞内评估TNF-α的表达。在体外与siRNA LNPs孵育后,在bmMΦ中观察到TNF-α的不同表达水平,DLinDMA是最有效的细胞因子诱导剂(图8a)。然而,在DLinKC2-DMA处理后观察到少量的TNF-α,其水平与我们所知的毒性最小的LNP DLinDAP相似。值得注意的是,用DLinKC2-DMA体内转染的MΦ表达了少量的TNF-α(图8b)。综上所述,数据表明LNP-siRNA复合物有可能以剂量依赖的方式诱导细胞因子,最有效的制剂DLinKC2-DMA在体内MΦ中产生的TNF-α量微不足道。 体内转染的DC保持其激活T细胞的功能并在淋巴结中迁移[2] 为了测试LNP处理的APC的功能特性,我们测试了体内转染的DC在摄取抗原后激活T细胞的能力(补充材料和方法)。为此,分离注射siRNA-DLinKC2-DMA的小鼠脾脏DC,用卵清蛋白喂养,评估其激活T细胞系B3Z35的能力,并与未处理的DC进行比较。流式细胞术分析显示,对照组和体内转染的DC在卵清蛋白抗原交叉呈递后激活T细胞的能力方面没有差异(补充图S6a)。此外,还测试了体内转染GFP+DC的迁移潜力,并在C57Bl6小鼠足垫注射后与对照DC进行了比较。观察到,在对照组和siRNA-DLinKC2-DMA处理的小鼠中,几乎相同数量的细胞从注射部位迁移到腹股沟淋巴结(补充图S6b)。总体而言,数据表明,在用DLinKC2-DMA配制的siRNA体内转染DC后,DC基本上没有功能损伤。 |
| 酶活实验 |
APC的体外沉默。[2]
治疗前一天,清洗bmMΦ和bmDC,并在原始培养皿中补充新鲜培养基。在培养的第8天,以1和5µg/ml的终浓度加入针对GAPDH的SiRNA(有义序列:UGGCCAAGGUCAUCCUGA)或包裹在DLinDAP、DLinDMA、DLinK DMA和DLinKC2 DMA LNPs中的阴性对照打乱SiRNA,并在37°C和5%CO2下孵育72小时。在每个实验中,一个孔用PBS处理,作为阴性对照。每隔一天更换一次培养基,同时将siRNA的浓度保持在所需的浓度。治疗后,测量GAPDH和α-微管蛋白表达,以评估配制的siRNA的疗效和特异性。 |
| 细胞实验 |
LNPs在细胞内递送siRNA。[2]
在第8天,将bmMΦ和bmDCs转移到24孔板上,用1µg/ml游离形式的siRNA-Cy5处理或包封在DLinDAP、DLinDMA 、DLinK DMA和DLinKC2 DMA LNPs中,并保持在37°C。通过冲洗培养基并在2、4、6、8和24小时后收获细胞来停止孵育。细胞还与0.5、1或5µg/ml Cy5标记的siRNA一起孵育24小时,以评估siRNA在细胞内的剂量依赖性递送。为了研究bmAPCs中siRNA的细胞内生物利用度是否与LNPs的细胞摄取相关,平行地用DLinDAP、DLinDMA、DLinK-DMA和DLinKC2-DMA与spDiO标记配制打乱的siRNA,并以10µg/ml的浓度与bmAPCs一起孵育。在相同的时间间隔后,以相同的方式停止孵育。处理后,将bmAPCs转移到微量离心管中,以12000 rpm的速度旋转4分钟,洗涤三次后,将其重新悬浮在300µl FACS染色缓冲液中。使用LSRII流式细胞仪采集样本,以评估细胞内Cy5标记的siRNA以及spDiO标记的LNPs的存在。Cy5荧光团使用HeNe 633激光线激发并在APC(FL 5)通道检测,而spDiO通过氩激光激发并在FL1通道检测。使用FACSDeva软件采集数据,并使用FlowJo软件进行分析。对10000个事件进行了测量。荧光强度相对于未处理的对照进行归一化,并表示为平均荧光单位的百分比增加。 使用ICM评估LNP siRNA的细胞内运输。[2] 为了评估包封siRNA的细胞内分布,进行了脉冲追逐实验。在培养的第8天取出BmMΦ和bmDCs,并在6孔板的玻璃盖玻片上生长,直至70%融合。接下来,加入2µg/ml的Cy5标记的siRNA游离或包封在DLinDAP、DLinDMA 、DLinK DMA和DLinKC2 DMA LNPs中,并孵育2小时。通过移除培养基并用4°C PBS洗涤盖玻片两次来停止孵育。然后加入新鲜培养基,将细胞置于37°C下1、2、4和8小时,以评估siRNA随时间的分布。在每个时间点后,用冷PBS洗涤细胞,用3%多聚甲醛固定10分钟,用0.1%皂苷渗透,用核标记碘化丙啶染色2分钟以鉴定单个细胞。经过几次洗涤后,使用慢褪色介质将盖玻片安装在显微镜载玻片上,并在免疫荧光共聚焦显微镜下进行检查,以评估Cy5标记的siRNA的细胞内模式。在633 nm激光线激发后,用×60物镜捕获了多幅图像。还进行了ICM,以观察不同孵育时间内内内体和溶酶体中LNP包封的Cy5-siRNA的存在。为此,在0.5、1、2、4和8小时的siRNA追逐以及固定和渗透后,用兔抗早期内体抗原1(EEA1)对细胞进行染色。孵育16小时后,将另一组含细胞的载玻片与EEA1和山羊抗溶酶体相关膜蛋白1(LAMP1)共培养。Alexa-488偶联的驴抗兔IgG(H+L)和驴抗山羊IgG(H+N)Alexa-568抗体分别用于检测内体和溶酶体。在所有共聚焦显微镜实验中使用同种型对照,以确认抗体染色的特异性。所有图像均使用尼康C1、TE2000-U免疫荧光共聚焦显微镜和EZ-C1软件采集。使用488nm、568nm和633nm激光线激发荧光染料,并使用×60物镜捕获多幅图像。 |
| 动物实验 |
In vivo screening of cationic lipids for Factor VII activity. [1]
LNP-siRNA systems containing Factor VII siRNA were diluted to the appropriate concentrations in sterile PBS immediately before use and the formulations were administered intravenously through the lateral tail vein in a total volume of 10 ml/kg. After 24 h, animals were anesthetized with ketamine/xylazine and blood was collected by cardiac puncture and processed to serum (microtainer serum separator tubes; Becton Dickinson). Serum was tested immediately or stored at −70 °C for later analysis for Factor VII levels. In vivo nonhuman primate experiments. [1] Cynomolgus monkeys (n = 3 per group) received either 0.03, 0.1, 0.3 or 1 mg/kg siTTR, or 1 mg/kg siApoB (used as control) formulated in KC2-SNALP as 15-min intravenous infusions (5 ml/kg) through the cephalic vein. Animals were euthanized 48 h after administration, and a 0.15–0.20 g sample of the left lateral lobe of the liver was collected and snap-frozen in liquid nitrogen. Prior studies have established uniformity of silencing activity throughout the liver6. TTR mRNA levels, relative to GAPDH mRNA levels, were determined in liver samples using a branched DNA assay. Clinical chemistry and hematology parameters were analyzed before and 48 h after administration. In vivo gene silencing using DLinKC2-DMA LNPs. [2] To study the in vivo gene silencing properties of DLinKC2-DMA-formulated siRNA, on day 0, 6- to 8-week-old C57Bl6 triplicate mice received by tail vein 5 mg/kg siRNA targeting GAPDH (siGAPDH), siRNA against Factor VII (siFVII) as control, formulated with DLinKC2-DMA LNPs, or PBS. They were euthanized 4 days later to assess the gene silencing capacity of siGAPDH in PerC and spleen-derived APCs. Peritoneal cavity APCs were obtained following peritoneal irrigation with 10 ml RPMI containing 5% FBS and centrifugation at 1,500 for 10 minutes. Spleens were harvested, minced in small pieces, and digested in 1 mg/ml collagenase D and CD11b+ and CD11c+ cells were isolated ex vivo using magnetic beads as described previously.50 Cell isolates were aliquoted, and GAPDH and α-Tubulin protein expression was assessed by flow cytometry as described. Data were acquired using LSRII flow cytometer after gating 10,000 events from the F4-80+/CD11b+ for MΦ or CD11chigh for DCs and analyzed by FlowJo software. The other aliquot of spleen-derived APCs was span down, lysed, and protein expression was assessed by western blotting and quantified as described earlier. |
| 参考文献 | |
| 其他信息 |
We adopted a rational approach to design cationic lipids for use in formulations to deliver small interfering RNA (siRNA). Starting with the ionizable cationic lipid 1,2-dilinoleyloxy-3-dimethylaminopropane (DLinDMA), a key lipid component of stable nucleic acid lipid particles (SNALP) as a benchmark, we used the proposed in vivo mechanism of action of ionizable cationic lipids to guide the design of DLinDMA-based lipids with superior delivery capacity. The best-performing lipid recovered after screening (DLin-KC2-DMA) was formulated and characterized in SNALP and demonstrated to have in vivo activity at siRNA doses as low as 0.01 mg/kg in rodents and 0.1 mg/kg in nonhuman primates. To our knowledge, this represents a substantial improvement over previous reports of in vivo endogenous hepatic gene silencing.[1]
|
| 分子式 |
C41H77NO2
|
|---|---|
| 分子量 |
616.072
|
| 精确质量 |
615.595
|
| 元素分析 |
C, 79.93; H, 12.60; N, 2.27; O, 5.19
|
| CAS号 |
871258-12-7
|
| 相关CAS号 |
871258-12-7;
|
| PubChem CID |
11570822
|
| 外观&性状 |
Colorless to light yellow liquid
|
| LogP |
12.576
|
| tPSA |
21.7
|
| 氢键供体(HBD)数目 |
0
|
| 氢键受体(HBA)数目 |
3
|
| 可旋转键数目(RBC) |
35
|
| 重原子数目 |
44
|
| 分子复杂度/Complexity |
651
|
| 定义原子立体中心数目 |
0
|
| SMILES |
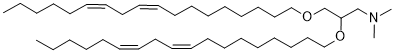
C(CN(C)C)(OCCCCCCCC/C=C\C/C=C\CCCCC)COCCCCCCCC/C=C\C/C=C\CCCCC
|
| InChi Key |
NFQBIAXADRDUGK-KWXKLSQISA-N
|
| InChi Code |
InChI=1S/C41H77NO2/c1-5-7-9-11-13-15-17-19-21-23-25-27-29-31-33-35-37-43-40-41(39-42(3)4)44-38-36-34-32-30-28-26-24-22-20-18-16-14-12-10-8-6-2/h13-16,19-22,41H,5-12,17-18,23-40H2,1-4H3/b15-13-,16-14-,21-19-,22-20-
|
| 化学名 |
N,N-Dimethyl-2,3-bis[(9Z,12Z)-octadeca-9,12-dienyloxy]propan-1-amine
|
| 别名 |
DLinDMA; D-LinDMA; DLinDMA; 871258-12-7; 1,2-dilinoleyloxy-n,n-dimethyl-3-aminopropane; BD8S7LL258; N,N-dimethyl-2,3-bis[(9Z,12Z)-octadeca-9,12-dienoxy]propan-1-amine; N,N-Dimethyl-2,3-bis(((9Z,12Z)-octadeca-9,12-dien-1-yl)oxy)propan-1-amine; 1,2-dilinoleyloxy-3-dimethylaminopropane; 1-Propanamine, N,N-dimethyl-2,3-bis((9Z,12Z)-9,12-octadecadien-1-yloxy)-; D-Lin-DMA
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
Ethanol :≥ 100 mg/mL (~162.32 mM)
DMSO : ~100 mg/mL (~162.32 mM) |
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (4.06 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (4.06 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.5 mg/mL (4.06 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 配方 4 中的溶解度: ≥ 2.5 mg/mL (4.06 mM) (饱和度未知) in 10% EtOH + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL 澄清 EtOH 储备液加入400 μL PEG300 中,混匀;再向上述溶液中加入50 μL Tween-80,混匀;然后加入450 μL 生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 5 中的溶解度: 2.5 mg/mL (4.06 mM) in 10% EtOH + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 悬浊液; 超声助溶。 例如,若需制备1 mL的工作液,可将100μL 25.0mg/mL澄清EtOH储备液加入到900μL 20%SBE-β-CD生理盐水中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 配方 6 中的溶解度: ≥ 2.5 mg/mL (4.06 mM) (饱和度未知) in 10% EtOH + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL 澄清乙醇储备液加入到 900 μL 玉米油中并混合均匀。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.6232 mL | 8.1160 mL | 16.2319 mL | |
| 5 mM | 0.3246 mL | 1.6232 mL | 3.2464 mL | |
| 10 mM | 0.1623 mL | 0.8116 mL | 1.6232 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。