| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg | |||
| Other Sizes |
| 靶点 |
PAFR ( IC50 = 3.6 μM )
|
||
|---|---|---|---|
| 体外研究 (In Vitro) |
体外活性:银杏内酯 B 有效抑制血小板激活因子 (PAF) 受体。用银杏内酯 B (0.5 μM -12 μM) 处理 PMN 会刺激活性氧的快速而微弱的产生(通过化学发光测定)。 Ginkgolide B 增强 fMet-Leu-Phe 和酵母聚糖诱导的 CL 反应。 Ginkgolide B 诱导囊肿细胞分化并改变 Ras/MAPK 信号通路。银杏内酯 B 促进增殖和内皮基因表达,并显着增强血管内皮生长因子诱导的迁移反应和融入 EPC 血管网络的能力。银杏内酯 B 保护 EPC 免受 H2O2 诱导的细胞死亡。银杏内酯 B 诱导 eNOS、Akt 和 p38 磷酸化,从而促进细胞增殖和功能。
银杏内酯B/Ginkgolide B抑制MDCK囊肿的形成和生长。[2] 采用MDCK囊肿模型评估银杏内酯B对囊肿形成的影响。MDCK细胞没有形成包囊,但在没有福司可林的情况下,在没有银杏内酯B或有银杏内酯B的情况下生长成集落(图1A,上图)。然而,在10μM毛喉素存在的情况下,第4天出现囊肿,并在接下来的8天内逐渐扩大(图1A,第三幅图)。当MDCK细胞在10μM毛喉素存在下与银杏内酯B(0.125、0.5或2μM)一起孵育6天时,囊肿形成受到显著抑制(图1A,下图),银杏内酯B的这种作用是剂量依赖性的,在2μM银杏内酯B下抑制率高达69%(图1B)。所有组的总集落数(直径>50μm的包囊加上非包囊集落)与原始接种细胞数相似,表明银杏内酯B对MDCK细胞没有毒性。 为了确定银杏内酯B对囊肿扩大的抑制作用,在10μM毛喉素的存在下,将已建立的囊肿(在与毛喉素一起培养的第4天)暴露于0.125、0.5或2μM银杏内酯B。毛喉素刺激下囊肿持续增大(图2A,上图)。银杏内酯B显著抑制囊肿增大(图2A,中,B)。处理4天后去除银杏内酯B后,这种抑制作用被消除(图2A,底部和C)。 银杏内酯B/Ginkgolide B在胚胎肾囊肿模型中延缓囊肿发育。[2] 为了评估银杏内酯B对整个肾器官肾囊肿形成和生长的影响,如前所述,在100μM 8-Br-cAMP存在或不存在的情况下,将E13.5的小鼠胚胎肾脏在Transwell滤膜上培养。在没有8-Br-cAMP的情况下,肾脏在4天内生长而没有形成囊肿,而如前所述,在有8-Br-cAMP-的情况下可以看到许多囊性结构(图3A,顶部)(37,45)。银杏内酯B显著抑制胚胎肾脏囊肿的形成和生长(图3A,中)。治疗2天后,银杏内酯B洗脱后,囊肿再次生长和扩大,这表明银杏内酯B对囊肿的抑制是可逆的(图3A,底部)。此外,银杏内酯B对囊肿形成和生长的抑制作用呈剂量依赖性(图3B),如定量图像分析所示(图3C)。无论是否培养8-Br-cAMP,银杏内酯B均不影响肾脏生长(数据未显示)。 在这项研究中,我们研究了银杏内酯B/Ginkgolide B(GB)对内皮祖细胞增殖和分化的影响,以及体外涉及的信号通路。分别用WST-8试验、Transwell室试验、细胞计数和血管生成试剂盒评估EPC增殖、迁移、粘附和血管生成活性。用膜联蛋白V和碘化丙啶染色检测细胞凋亡。Western blot检测血管生成相关标志物的蛋白表达,实时聚合酶链式反应(RT-PCR)检测相关基因表达。结果表明,GB促进了内皮细胞的增殖和内皮基因表达,显著增强了血管内皮生长因子诱导的内皮细胞迁移反应和融入血管网络的能力。GB保护EPC免受H2O2诱导的细胞死亡。GB诱导eNOS、Akt和p38的磷酸化,进而促进细胞增殖和功能。总之,本研究表明,在接近医学应用剂量的情况下,GB增加了EPC的数量和功能活性,并涉及Akt/内皮一氧化氮合酶和丝裂原活化蛋白激酶(MAPK)/p38信号通路。这些发现提出了一种有趣的可能性,即GB可能在血管的保护和血运重建中发挥重要作用[3]。 |
||
| 体内研究 (In Vivo) |
银杏内酯 B /Ginkgolide B(2 μM) 显着抑制 MDCK 囊肿形成,且呈剂量依赖性,最多可减少 69%。银杏内酯 B 还显着抑制 MDCK 囊肿模型、胚胎肾囊肿模型和 PKD 小鼠模型中的囊肿增大。缺血前应用银杏内酯 B(50 mg/kg,口服)可显着减少神经元损伤。银杏内酯 B(100 mg/kg,皮下)预处理 30 分钟可减少局灶性缺血小鼠模型中的梗塞面积。在新生大鼠海马神经元和星形胶质细胞的原代培养物中,银杏内酯 B (1 μM) 可保护神经元免受谷氨酸造成的损伤。 Ginkgolide B (100 μM) 可减少 staurosporine 诱导的细胞凋亡损伤。在戊巴比妥或氨基甲酸乙酯麻醉的动物中,银杏内酯 B(1 mg/kg 静脉注射或 10 mg/kg 口服)可抑制支气管收缩、血细胞比容增加以及由 PAF-乙醚(33 ng/kg–100 ng/公斤)。剂量为 3 mg/kg 的银杏内酯 B 可减少雾化 PAF-乙醚引起的支气管收缩。 300 μM 剂量的银杏内酯 B 还可抑制 PAF-乙醚刺激的肺泡巨噬细胞产生超氧化物。银杏内酯 B 可阻断注射到灌注肺中的 PAF-乙醚 (100 ng) 引发的血栓素形成。用银杏内酯 B (100 μM) 预处理肺实质条带可部分抑制 PAF-乙醚 (0.1 μM) 诱导的收缩,并抑制血栓素的形成。伴随着血栓素的释放。银杏内酯B抑制缺血性损伤的成熟。银杏内酯 B 治疗显示梗塞体积、脑水肿和神经功能缺陷显着减少。银杏内酯 B 还可抑制缺血/再灌注 (I/R) 诱导的 NF-κB、小胶质细胞活化和促炎细胞因子的产生。银杏内酯 B 可降低缺血后大脑中的 Bax 蛋白水平并增加 Bcl-2 蛋白水平。银杏内酯 B 可减弱血小板聚集并抑制凝血酶和胶原激活的血小板中的磷脂酰肌醇 3 激酶 (PI3K) 激活和 Akt 磷酸化。银杏内酯 B 可降低 ApoE−/− 小鼠的血浆 PF4 和 RANTES 水平。银杏内酯 B 可减少 P-选择素、PF4、 ApoE−/− 小鼠主动脉斑块中的 RANTES 和 CD40L 表达。此外,银杏内酯 B 抑制 ApoE−/− 小鼠主动脉病变中巨噬细胞和血管细胞粘附蛋白 1 (VCAM-1) 的表达。
银杏内酯B/Ginkgolide B抑制PKD小鼠肾囊肿的发展。[2] 使用肾特异性Pkd1敲除小鼠(Pkd1flox/−;Ksp-Cre)来确定银杏内酯B在体内是否具有任何囊肿抑制活性。从第1天至第4天,每12小时向小鼠皮下注射银杏内酯B 16 mg·kg-1·day-1。在治疗期间,野生型小鼠和Pkd1flox/−;无论是否服用银杏内酯B,Ksp-Cre小鼠的活动和行为都无法区分。治疗后,两组小鼠的体重没有差异(数据未显示)。肾脏大小和重量,单位为Pkd1flox/−;Ksp-Cre小鼠比野生型小鼠大。然而,银杏内酯B显著降低了Pkd1flox/−的肾脏大小和重量;Ksp-Cre小鼠(图4A)。银杏内酯B对所有组的肝脏大小和重量均无影响(图4B)。图4C显示了代表性的中央冠状肾切片。银杏内酯B处理的Pkd1flox/−肾切片;与未经治疗的PKD小鼠相比,Ksp-Cre小鼠显示出更少的各种大小的囊肿。苏木精和伊红染色切片的图像分析显示,与未治疗的PKD小鼠相比,银杏内酯B治疗的PKD小鼠每只肾脏的囊肿面积分数明显较小(图4D)。 我们研究了已知的血小板活化因子(PAF)拮抗剂银杏内酯B对大鼠缺血后神经元损伤的影响。在前脑缺血10分钟后7天,评估海马神经元坏死情况。缺血前应用银杏内酯B(50mg/kg口服)可显著减少神经元损伤。这表明PAF的拮抗作用是银杏内酯B这种有益作用的原因。[4] 标准化银杏叶提取物EGb 761(定义见社论)已被证明在不同的体内和体外模型中产生神经保护作用。由于EGb 761是一种含有黄酮苷、萜内酯(非黄酮部分)和各种其他成分的复杂混合物,因此出现了这些化合物中哪一种介导EGb 761的保护活性的问题。先前的研究表明,非黄酮组分是EGb 761抗缺氧活性的原因。因此,我们研究了非黄酮组分的主要成分银杏内酯A、B、C、J和白果内酯的神经保护和抗凋亡能力。在局灶性脑缺血模型中,缺血前60分钟给予白果内酯(5-20mg/kg,皮下注射),剂量依赖性地减少了损伤发生后2天小鼠脑的梗死面积和大鼠脑的梗死体积。用银杏内酯A(50 mg/kg,皮下注射)和银杏内酯B(100 mg/kg,皮下注射器)预处理30分钟,可减少局灶性缺血小鼠模型的梗死面积。在新生大鼠海马神经元和星形胶质细胞的原代培养中,银杏内酯B(1微M)和白果内酯(10微M)保护神经元免受谷氨酸(1 mM,1小时)引起的损伤,如台盼蓝染色所示。此外,当暴露于氰化物(1 mM,1小时)时,白果内酯(0.1微M)能够提高鸡胚端塞帕隆培养的神经元的存活率。此外,我们试图找出银杏内酯A、B和J以及白果内酯是否也能够抑制神经元凋亡(通过Hoechst 33 258核染色和TUNEL染色确定)。银杏内酯B(10μM)、银杏内酯J(100μM)和白果内酯(1μM)减少了血清剥夺(24小时)或星孢菌素(200 nM,24小时)处理对培养的鸡胚神经元诱导的凋亡损伤。白果内酯(100μM)可使培养的大鼠海马神经元免于血清剥夺(24小时)引起的凋亡,而银杏内酯B/Ginkgolide B(100μm)和白果内酯可减少星孢菌素(300 nM,24小时)诱导的凋亡损伤。银杏内酯A对血清剥夺和星孢菌素处理的神经元都没有影响凋亡损伤。结果表明,EGb 761非黄酮部分的一些成分具有神经保护和抗凋亡能力,白果内酯是最有效的成分。相比之下,银杏酸(100-500微M)诱导神经元死亡,表现出凋亡和坏死的特征,但这些成分从EGb 761中去除的量低于0.0005%。综上所述,有实验证据表明EGb 761具有神经保护作用,这与临床研究表明口服治疗对轻度和中度痴呆患者的疗效一致[5]。 |
||
| 细胞实验 |
MDCK囊肿模型。[2]
I型MDCK细胞(ATCC编号CCL-34)在37°C、5%CO2-95%空气的气氛中,在DMEM和Ham's F-12营养培养基的1:1混合物中培养,该培养基补充了10%胎牛血清、100 U/ml青霉素和100μg/ml链霉素。为了产生囊肿,将400个MDCK细胞悬浮在0.4 ml冰冷的MEM中,MEM含有2.9 mg/ml胶原蛋白、10 mM HEPES、27 mM NaHCO3、100 U/ml青霉素和100μg/ml链霉素(pH 7.4)。将细胞悬浮液铺在24孔板上。在37°C下孵育约90分钟后,将胶原凝胶溶液冷冻干燥。然后,向每个孔中加入1.5 ml含有10μM毛喉素的MDCK细胞培养基,并将平板置于37°C、5%CO2-95%空气的加湿气氛中。 为了使用MDCK囊肿模型评估银杏内酯B对囊肿形成的抑制作用,从第0天到第6天,在含有10%胎牛血清的培养基中,在10μM毛喉素的存在下,分别添加0.125、0.5和2μMGinkgolide B。每12小时更换一次含有毛喉素和银杏内酯B的培养基。在第6天,通过相差光学显微镜计数囊肿(直径>50μm)和非囊肿细胞集落。为了研究银杏内酯B对MDCK囊肿生长的影响,在毛喉素存在的情况下,将已建立的囊肿(在用毛喉素培养的第4天)从第4天至第12天暴露于不同浓度的银杏内酯B中。每12小时更换一次含有福司克林和银杏内酯B的10%胎牛血清培养基,持续8天。此外,为了测试银杏内酯B对囊肿生长抑制的可逆性,将建立的囊肿从第4天至第8天暴露于毛喉素和银杏内酯B,然后从第8天至第12天去除银杏内酯B。每2天获得显示胶原凝胶中相同囊肿的显微照片(通过平板上的标记识别)。使用Image Pro Plus 6.0测量囊肿直径,以确定囊肿的生长速度。每种情况至少测量10个囊肿/孔和3个孔/组。 胚胎肾囊肿模型。[2] 如前所述,解剖胚胎第13.5天(E13.5)的小鼠胚胎肾脏,并将其放置在直径为0.4-μM的透明Falcon多孔细胞培养插入物上。下腔室填充有DMEM/Ham的F-12营养培养基的1:1混合物,该培养基补充了10%胎牛血清、2 mM l-谷氨酰胺、10 mM HEPES、5μg/ml胰岛素、5μg/ml转铁蛋白、2.8 nM硒、25 ng/ml前列腺素E、32 pg/ml T3、250 U/ml青霉素和250μg/ml链霉素。每12小时更换一次培养基。如所示,加入100μM 8-Br-cAMP和银杏内酯B/Ginkgolide B。使用配备×2物镜、520 nm带通滤光片和高分辨率PixeLINK彩色CCD相机的尼康倒置显微镜(尼康TE 2000-S)拍摄肾脏。囊肿面积是通过将囊肿总面积除以肾脏总面积来计算的。 MDCK小管模型。[2] 为了确定银杏内酯B是否促进MDCK细胞形成小管,将MDCK细胞在3T3条件培养基(3T3 CM)中培养12天,其中银杏内酯B的剂量逐渐增加(0.125、0.5或2μM)。每12小时更换一次含有银杏内酯B的培养基。在第12天,使用相差光学显微镜在每个培养皿的20-35个随机位置计数形成小管状结构的细胞数量。此外,为了检查银杏内酯B是否诱导三维胶原凝胶内形成的MDCK囊肿形成微管,如上所述,通过将囊肿暴露于毛喉素4天来建立囊肿。然后,在接下来的8天里,用新鲜的3T3 CM代替培养基,加入或不加入不同浓度的银杏内酯B。每2天对输卵管进行一次监测和拍照。在第12天,通过Image Pro Plus 6.0测量每个囊肿最长小管的长度。 细胞毒性和凋亡。[2] MTT法用于评估银杏内酯B/Ginkgolide B的细胞毒性。将96孔板中的MDCK细胞暴露于0、0.1、1、10或100μM的银杏内酯B中24小时。加入20微升MTT溶液(5mg/ml),在37°C下孵育4小时。然后移除培养基,加入150μl DMSO。测量490nm处的吸光度。细胞活力显示为OD490值。 原位细胞死亡检测试剂盒 用于测量细胞凋亡。将MDCK细胞接种在经八室聚苯乙烯组织培养处理的载玻片上,并与0.125、0.5或2μM的银杏内酯B/Ginkgolide B一起孵育。庆大霉素(2mM)用作阳性对照。三天后,根据制造商的说明进行了测定。每种条件分析了五个微观场。凋亡指数计算如下:凋亡指数(%)=(凋亡细胞数/总细胞数)×100。 细胞增殖。[2] 细胞计数试剂盒-8(CCK-8)用于测定在指定时间点(12、24、36、48、72和96小时)在有或没有10μM毛喉素的情况下,与Ginkgolide B/银杏内酯B一起孵育的MDCK细胞的增殖情况。将96孔板中的MDCK细胞(1000个细胞·100μl−1·孔−1)在37°C加湿5%CO2培养箱中培养。每个孔与10μl CCK-8溶液一起使用,并孵育1小时。测量450nm处的吸光度。细胞增殖率以OD450值表示。 cAMP测量。[2] 在6孔板中培养的MDCK细胞暴露于银杏内酯B/Ginkgolide B0.125、0.5或2μM)30分钟,有或没有10μM毛喉素刺激。按照cAMP RIA试剂盒中推荐的程序,通过RIA测定细胞内cAMP含量。 CFTR功能测定。[2] 如前所述,使用稳定共表达人CFTR和高灵敏度I-传感绿色荧光蛋白YFP-H148Q/I152L的Fischer大鼠甲状腺(FRT)上皮细胞。在测定时,用PBS洗涤细胞,然后用含有毛喉素(20μM)和Ginkgolide B/银杏内酯B(0.01、0.1、1或10μM)的PBS孵育20分钟。使用配备500±10nm激发和535±15nm发射滤光片的FLUOstar荧光板读数器进行测量。通过连续记录荧光(200 ms/点)2秒(基线),然后在快速(<1秒)加入165μl PBS后12秒(其中137 mM Cl−被I−取代),分别测定每个孔的I−流入。通过将数据的最后11.5秒拟合为指数,对初始斜率进行外推,并对减去背景的初始荧光进行归一化,计算I−流入率。所有实验均含有阴性对照(DMSO载体)和阳性对照CFTRinh172。 短路电流测量。[2] Snapwell插入物中的MDCK细胞(经上皮电阻1000-2000Ω)在含有银杏内酯B(0.1、1或10μM)的培养基中培养1或48小时。在短路电流测量前1小时,用培养基冲洗银杏内酯B。将含有MDCK细胞的Snapwell插入物安装在标准Ussing腔室系统上。在插入物的基底外侧膜上加入渗透试剂(250μg/ml两性霉素B)。半腔填充有5ml的65mM NaCl、65mM葡萄糖酸钠、2.7mM KCl、1.5mM KH2PO4、1mM CaCl2、0.5mM MgCl2、Na-HEPES和10mM葡萄糖(顶侧),以及130mM NaCl、2.7mM KCl、1.5mM K2PO4、1mM Ca2、0.5mM氯化镁、Na-HPES和10mM葡萄糖(基侧)(pH 7.3)。使用带有Ag/AgCl电极和1M KCl琼脂桥的DVC-1000电压钳(佛罗里达州萨拉索塔市世界精密仪器公司)连续记录短路电流。 蛋白质印迹。[2] 将MDCK细胞接种在含有10%FBS的DMEM和Ham’s F-12营养培养基的1:1混合物中的6孔板中2小时,然后血清饥饿24小时。然后,将MDCK电池暴露在含有银杏内酯B/Ginkgolide B(0.125、0.5或2μM)的培养基中1小时,有或没有10μM毛喉素刺激。按照制造商的说明进行蛋白质印迹分析。 |
||
| 动物实验 |
|
||
| 参考文献 |
[1]. Biochem Pharmacol . 1987 Sep 1;36(17):2749-52. [2]. Am J Physiol Renal Physiol . 2012 May 15;302(10):F1234-42. [3]. Eur Cell Mater . 2011 May 28:21:459-69. [4]. J Cereb Blood Flow Metab . 1990 Jan;10(1):133-5. [5]. Pharmacopsychiatry . 2003 Jun:36 Suppl 1:S8-14. [6]. Eur J Pharmacol . 1986 Aug 7;127(1-2):83-95. [7]. J Neurochem . 1988 Dec;51(6):1900-5. |
||
| 其他信息 |
Ginkgolide B has been reported in Ginkgo and Ginkgo biloba with data available.
See also: Ginkgolide B (annotation moved to). In summary, our study demonstrated for the first time that ginkgolide B significantly inhibited cyst development. Ginkgolide B induced no apparent toxicity and apoptosis, but inhibited forskolin-induced cyst epithelial cell proliferation and promoted epithelial cell differentiation. The cyst-inhibitory activity of ginkgolide B may be mediated through the Ras/MAPK signaling pathway. Further evaluation is needed for ginkgolide B as a novel promising candidate drug for ADPKD.[1] Ginkgolide B does not affect chloride transporter CFTR function.[2] To determine the effect of ginkgolide B on CFTR function, CFTR activity in FRT cells expressing CFTR was determined by an I−-sensitive fluorescence assay and in MDCK cells by an Ussing chamber assay. There was no difference in CFTR-mediated I− secretion between ginkgolide B-treated and untreated FRT cells (Fig. 7A). Figure 7B shows that ginkgolide B did not reduce the short-circuit current in MDCK cells with forskolin stimulation. Ginkgolide B did not alter CFTR function as seen by short-circuit current in MDCK cells after 1- vs. 48-h incubation with 0.1, 1, or 10 μM ginkgolide B followed by washout. The representative curves are showed in Fig. 7C. Ginkgolide B does not affect intracellular cAMP content.[2] Figure 8 shows the intracellular cAMP levels in MDCK cells incubated with forskolin in the presence or absence of ginkgolide B (at 0.125, 0.5, or 2 μM). Intracellular cAMP content was significantly increased in MDCK cells by forskolin. There was no difference in intracellular cAMP concentration between ginkgolide B-treated and untreated MDCK cells with forskolin stimulation. Ginkgolide B regulates intracellular signaling pathways.[2] To study the mechanism by which ginkgolide B inhibits cysts, the signaling proteins involved in the Ras/MAPK pathway were analyzed by Western blotting. The highest p-ERK expression levels were found in serum-starved MDCK cells exposed to 10 μM forskolin for 60 min (data not shown). Based on this time course, serum-starved MDCK cells were treated with ginkgolide B at 0.125, 0.5, and 2 μM for 60 min in the presence of 10 μM forskolin. Ginkgolide B significantly decreased levels of Ras, B-raf, p-MEK, and p-ERK but increased Raf-1 levels in MDCK cells with forskolin stimulation. Ginkgolide B did not affect the expression of Egr-1. We also examined the effect of ginkgolide B on CREB phosphorylation in MDCK cells cotreated with 10 μM forskolin for 60 min. Forskolin-mediated CREB activation was significantly inhibited by 0.5 and 2 μM ginkgolide B, whereas total CREB content was not affected (Fig. 9). |
| 分子式 |
C20H24O10
|
|
|---|---|---|
| 分子量 |
424.4
|
|
| 精确质量 |
424.136
|
|
| 元素分析 |
C, 56.60; H, 5.70; O, 37.70
|
|
| CAS号 |
15291-77-7
|
|
| 相关CAS号 |
|
|
| PubChem CID |
65243
|
|
| 外观&性状 |
White to off-white solid powder
|
|
| 密度 |
1.6±0.1 g/cm3
|
|
| 沸点 |
762.4±60.0 °C at 760 mmHg
|
|
| 熔点 |
280°C (dec.)
|
|
| 闪点 |
274.3±26.4 °C
|
|
| 蒸汽压 |
0.0±5.8 mmHg at 25°C
|
|
| 折射率 |
1.651
|
|
| LogP |
0.52
|
|
| tPSA |
148.82
|
|
| 氢键供体(HBD)数目 |
3
|
|
| 氢键受体(HBA)数目 |
10
|
|
| 可旋转键数目(RBC) |
1
|
|
| 重原子数目 |
30
|
|
| 分子复杂度/Complexity |
925
|
|
| 定义原子立体中心数目 |
0
|
|
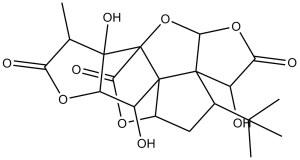
| SMILES |
O[C@H]1[C@]2([H])OC([C@@H](C)[C@]2(O)C23C(=O)O[C@@]4([H])C12C1([C@H](C(O[C@@]1([H])O3)=O)O)[C@@H](C4)C(C)(C)C)=O
|
|
| InChi Key |
SQOJOAFXDQDRGF-UHFFFAOYSA-N
|
|
| InChi Code |
InChI=1S/C20H24O10/c1-6-12(23)28-11-9(21)18-8-5-7(16(2,3)4)17(18)10(22)13(24)29-15(17)30-20(18,14(25)27-8)19(6,11)26/h6-11,15,21-22,26H,5H2,1-4H3
|
|
| 化学名 |
8-tert-butyl-6,12,17-trihydroxy-16-methyl-2,4,14,19-tetraoxahexacyclo[8.7.2.01,11.03,7.07,11.013,17]nonadecane-5,15,18-trione
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (5.89 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.08 mg/mL (4.90 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 20.8 mg/mL澄清的DMSO储备液加入到400 μL PEG300中,混匀;再向上述溶液中加入50 μL Tween-80,混匀;然后加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.08 mg/mL (4.90 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 配方 4 中的溶解度: 30% Propylene glycol , 5% Tween 80 , 65% D5W: 10mg/mL 配方 5 中的溶解度: 5 mg/mL (11.78 mM) in 0.5% CMC-Na/saline water (这些助溶剂从左到右依次添加,逐一添加), 悬浮液; 需要超声助溶并加热至 44°C。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.3563 mL | 11.7813 mL | 23.5627 mL | |
| 5 mM | 0.4713 mL | 2.3563 mL | 4.7125 mL | |
| 10 mM | 0.2356 mL | 1.1781 mL | 2.3563 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
| NCT Number | Recruitment | interventions | Conditions | Sponsor/Collaborators | Start Date | Phases |
| NCT03772847 | Completed | Drug: ginkgolide | Intravenous Alteplase Thrombolysis Neurological Improving |
Second Affiliated Hospital, School of Medicine, Zhejiang University |
July 31, 2018 | Phase 4 |