| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg | |||
| Other Sizes |
| 靶点 |
JMJD3/KDM6B (IC50 = 8.6); UTX/KDM6A (IC50 = 6.6 μM)
|
|---|---|
| 体外研究 (In Vitro) |
在 Flag-JMJD3 转染的 HeLa 细胞中,GSK-J4 盐酸盐通过避免 JMJD3 诱导的核 H3K27me3 免疫染色减少而表现出细胞活性。在未转染的细胞中,GSK-J4 给药提高了总核 H3K27me3 的水平。肿瘤坏死因子-α (TNF-α) 是 16 种 LPS 驱动的细胞因子之一,GSK-J4 可显着降低其表达 [1]。在小鼠足细胞中,GSK-J4 盐酸盐使 H3K27me3 的量增加了三倍以上。在培养的足细胞中,GSK-J4 降低 Jagged-1 蛋白和 mRNA 的水平,同时升高 H3K27me3。同样,当足细胞接受去分化诱导剂 TGF-β1 处理时,GSK-J4 预处理可抑制细胞内 N1-ICD 水平的增加、α-SMA 的增加以及足细胞蛋白 mRNA 水平的降低 [2]。盐酸盐 GSK-J4 虽然对 Th1 和 Th17 细胞分化影响不大,但盐酸盐 (10, 25 nM) 对 DC 起作用,可增强 Treg 细胞的分化、稳定性和抑制能力 [3]。盐酸 GSK-J4 盐酸可抑制 TGF-β1 诱导的 JMJD3 表达 [4]。盐酸盐 GSK-J4 在雌性胚胎干细胞中,盐酸盐抑制 Xist、Nodal 和 HoxC13 的 H3K4 去甲基化 [5]。
|
| 体内研究 (In Vivo) |
盐酸盐 GSK-J4 在糖尿病小鼠中,给予盐酸盐(10 mg/kg;腹腔注射;每周 3 次,持续 10 周)以预防肾损伤 [2]。盐酸盐 GSK-J4 在小鼠模型中,盐酸盐(0.5 mg/kg,腹腔注射)可显着减轻实验性自身免疫性脑脊髓炎的严重程度并推迟其发展[3]。
|
| 酶活实验 |
组蛋白去甲基化酶的jumonji(JMJ)家族是Fe2+-和α-酮戊二酸依赖性加氧酶,是调控转录染色质复合物的重要组成部分。这些酶在甲基化状态和序列特异性背景下使组蛋白中的赖氨酸残基去甲基化。人们已经付出了相当大的努力来获得组蛋白赖氨酸去甲基化酶在真核转录、基因组完整性和表观遗传以及发育、生理和疾病中的作用的机制理解。然而,由于缺乏任何选择性抑制剂,JMJ酶的去甲基化酶活性在调节细胞反应中的相关性仍知之甚少。在这里,我们提出了一种结构导向的小分子和化学蛋白质组学方法来阐明H3K27me3特异性去甲基化酶亚家族(KDM6亚家族成员JMJD3和UTX)的功能作用。人和小鼠JMJD3的配体结构为KDM6去甲基酶亚家族识别辅因子、底物和抑制剂的特异性决定因素提供了新的见解。我们利用这些结构特征产生了第一个对H3K27me3特异性JMJ亚家族具有选择性的小分子催化位点抑制剂。我们证明,这种抑制剂以一种新的方式结合,并减少脂多糖诱导的人类原代巨噬细胞产生的促炎细胞因子,这一过程依赖于JMJD3和UTX。我们的研究结果解决了与H3K27特异性JMJ在调节疾病相关炎症反应中的催化功能相关的模糊性,并为设计小分子抑制剂以允许在JMJ家族中进行选择性药物干预提供了鼓励。[1]
|
| 动物实验 |
Animal/Disease Models: Eightweeks old male db/m and db/db mice on a BKS background[2]
Doses: 10 mg/kg Route of Administration: ip; thrice-weekly for 10 weeks Experimental Results: Attenuated the development of kidney disease in diabetic mice. |
| 参考文献 | |
| 其他信息 |
Histone protein modifications control fate determination during normal development and dedifferentiation during disease. Here, we set out to determine the extent to which dynamic changes to histones affect the differentiated phenotype of ordinarily quiescent adult glomerular podocytes. To do this, we examined the consequences of shifting the balance of the repressive histone H3 lysine 27 trimethylation (H3K27me3) mark in podocytes. Adriamycin nephrotoxicity and subtotal nephrectomy (SNx) studies indicated that deletion of the histone methylating enzyme EZH2 from podocytes decreased H3K27me3 levels and sensitized mice to glomerular disease. H3K27me3 was enriched at the promoter region of the Notch ligand Jag1 in podocytes, and derepression of Jag1 by EZH2 inhibition or knockdown facilitated podocyte dedifferentiation. Conversely, inhibition of the Jumonji C domain-containing demethylases Jmjd3 and UTX increased the H3K27me3 content of podocytes and attenuated glomerular disease in adriamycin nephrotoxicity, SNx, and diabetes. Podocytes in glomeruli from humans with focal segmental glomerulosclerosis or diabetic nephropathy exhibited diminished H3K27me3 and heightened UTX content. Analogous to human disease, inhibition of Jmjd3 and UTX abated nephropathy progression in mice with established glomerular injury and reduced H3K27me3 levels. Together, these findings indicate that ostensibly stable chromatin modifications can be dynamically regulated in quiescent cells and that epigenetic reprogramming can improve outcomes in glomerular disease by repressing the reactivation of developmental pathways.[2]
|
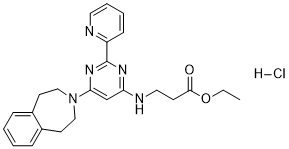
| 分子式 |
C24H27N5O2.HCL
|
|
|---|---|---|
| 分子量 |
453.96
|
|
| 精确质量 |
453.193
|
|
| 元素分析 |
C, 63.50; H, 6.22; Cl, 7.81; N, 15.43; O, 7.05
|
|
| CAS号 |
1797983-09-5
|
|
| 相关CAS号 |
GSK-J4;1373423-53-0
|
|
| PubChem CID |
71729974
|
|
| 外观&性状 |
Light yellow to yellow solids at room temperature
|
|
| tPSA |
80.2Ų
|
|
| 氢键供体(HBD)数目 |
2
|
|
| 氢键受体(HBA)数目 |
7
|
|
| 可旋转键数目(RBC) |
8
|
|
| 重原子数目 |
32
|
|
| 分子复杂度/Complexity |
546
|
|
| 定义原子立体中心数目 |
0
|
|
| SMILES |
O(CC)C(CCNC1=CC(=NC(C2=CC=CC=N2)=N1)N1CCC2=CC=CC=C2CC1)=O.Cl
|
|
| InChi Key |
WBKCKEHGXNWYMO-UHFFFAOYSA-N
|
|
| InChi Code |
InChI=1S/C24H27N5O2/c1-2-31-23(30)10-14-26-21-17-22(28-24(27-21)20-9-5-6-13-25-20)29-15-11-18-7-3-4-8-19(18)12-16-29/h3-9,13,17H,2,10-12,14-16H2,1H3,(H,26,27,28)
|
|
| 化学名 |
ethyl 3-((2-(pyridin-2-yl)-6-(1,2,4,5-tetrahydro-3H-benzo[d]azepin-3-yl)pyrimidin-4-yl)amino)propanoate hydrochloride
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 请将本产品存放在密封且受保护的环境中,避免吸湿/受潮。 |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.08 mg/mL (4.58 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 20.8 mg/mL澄清DMSO储备液加入400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.08 mg/mL (4.58 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 20.8 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: 2% DMSO+dd H2O:10mg/mL 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.2028 mL | 11.0142 mL | 22.0284 mL | |
| 5 mM | 0.4406 mL | 2.2028 mL | 4.4057 mL | |
| 10 mM | 0.2203 mL | 1.1014 mL | 2.2028 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。