| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg | |||
| Other Sizes |
| 靶点 |
HIF-1 (IC50 = 4.4 μM)
|
||
|---|---|---|---|
| 体外研究 (In Vitro) |
HIF-1α 蛋白的稳定性受 LW6 影响。 LW6 刺激野生型 HIF-1α 的氧依赖性降解结构域中的羟基化位点,但不刺激具有 P402A 和 P564A 修饰的 DM-HIF-1α 的羟基化位点。 Von Hippel-Lindau (VHL) 由 LW6 诱导,并与脯氨酰羟基化的 HIF-1α 相互作用,促进蛋白酶体降解。在 LW6 存在的情况下,VHL 敲低不会消除 HIF-1α 蛋白积累,这表明 LW6 通过控制 VHL 表达来降解 HIF-1α[2]。已知 LW6 可显着增加过度表达 BCRP 的 MDCKII-BCRP 细胞中米托蒽醌(BCRP 的底物)的细胞积累。 LW6 在 0.1–10 µM 浓度下也会下调 BCRP 表达[3]。在 20 µM 浓度下,LW6 可抑制缺氧的 A549 细胞中 HIF 1α 的表达,而不需要 von Hippel Lindau 蛋白。除了降低线粒体膜电位外,LW6 还会导致缺氧选择性细胞凋亡[4]。
|
||
| 体内研究 (In Vivo) |
在携带人结肠癌 HCT116 细胞异种移植物的小鼠的冷冻组织免疫组织化学染色中,LW6 表现出有效的体内抗肿瘤功效,并降低 HIF-1α 表达 [2]。
LW6在异种移植物肿瘤模型中抑制HCT116细胞的生长[2] 为了评估LW6的体内抗肿瘤活性,我们通过皮下接种人癌症细胞系HCT116在无胸腺裸鼠中产生肿瘤。当肿瘤体积达到约100mm2时,每天用LW6(10和20mg/kg)治疗荷瘤小鼠,直到研究结束(图5)。与赋形剂治疗的对照组相比,LW6(20mg/kg)的给药显著抑制了HCT116肿瘤的生长,抑制率高达53.6%(图5A)。每天以10mg/kg的剂量治疗LW6,可抑制37.4%的肿瘤生长。这些结果表明,LW6能够剂量依赖性地抑制肿瘤生长。拓扑替康是一种抑制HIF-1α和HIF-2α蛋白积累的临床化合物,可抑制73.7%的肿瘤生长。LW6治疗没有引起明显的体重减轻或副作用,如皮肤溃疡或其他严重症状(图5B) 为了确定LW6的抗肿瘤作用是否是由于HIF-1α的减少,对第14天异种移植物的冷冻切片进行了抗HIF-1α抗体的免疫组织化学染色(图5C)。用拓扑替康或LW6治疗的肿瘤切片显示HIF-1α水平较低,而在未治疗的肿瘤组织中检测到高水平的HIF-1α。这一结果进一步支持LW6,一种HIF抑制剂,作为癌症治疗的潜在先导化合物。 此外,LW6将大鼠口服甲氨蝶呤的暴露量提高了两倍[3]。 |
||
| 酶活实验 |
报告分析[2]
如前所述,通过使用双荧光素酶报告检测系统的报告检测来检测HIF-1α的抑制作用。将75-90%融合的HCT116细胞瞬时共转染pGL3 HRE荧光素酶质粒,该质粒含有来自人VEGF基因的六个拷贝的HRE和编码萤火虫肾荧光素酶的pRL-SV40,并孵育24小时。在报告分析之前,细胞用LW6或17-AAG处理16小时。萤光素酶活性在10秒内进行积分,并使用光度计进行测量。将结果标准化为肾荧光素酶的活性。数据以平均值±标准差表示。 体外结合试验[2] 结合测定所需的肽底物和GST-VBC蛋白如前所述制备。荧光标记的肽底物F-P564(FITC-ACADLALAPYIPADDDFQLR;终浓度1μM)与0.2μg/μl重组His6-PHD2在含有2 mM抗坏血酸、5 mM 2-酮戊二酸、100μM FeCl2和5μM N,N,N′,N′-四(2-吡啶甲基)乙二胺(TPEN)的NETN缓冲液中孵育30分钟,温度为25°C。包含单独含有DMSO而不含His6-PHD2的反应混合物作为阴性对照,另一个对照包含F-HyP564(一种在P564处羟基化的荧光标记肽)。在95°C下加热1分钟终止反应,然后在500 nM GST-VBC的存在下,在EBC缓冲液(50 mM Tris,pH 8.0,120 mM NaCl,0.25%Nonidet P40)中稀释至最终肽浓度为100 nM。使用发光光谱仪LS50B测量荧光偏振值。 MDH2活性测定[1] 根据制造商的说明,使用MDH2活性测定试剂盒测定MDH2的活性。用含有蛋白酶和磷酸酶抑制剂的RIPA缓冲液裂解细胞。在每个孔中,将100μL的蛋白质(100μg/mL)在室温下孵育3小时。用洗涤缓冲液洗涤三次后,向孔中加入50μL在基础缓冲液中稀释的药物。将其在室温下预培养1小时,然后在4°C下预培养3小时。将测定试剂(苹果酸和NAD+的终浓度分别为5和1 mM)加入孔中,并在30和60分钟时测量450 nm处的吸光度。 体外MDH2结合试验[1] 将重组人MDH2(2μg)与探针一起孵育,然后在冰上用360 nm紫外线照射30分钟进行光亲和标记。根据制造商的说明,使用Click-iT蛋白质反应缓冲试剂盒建立探针和Cy3-叠氮化物的点击反应。点击反应后,用甲醇/氯仿/水(60/15/40,v/v)沉淀蛋白质,并在样品缓冲液中煮沸5分钟使其变性。通过SDS-PAGE分离蛋白质,并用Typhoon 9410成像系统检测荧光。 MDH2动力学分析[1] MDH2的酶活性通过草酰乙酸依赖性NADH氧化测定来测量,其中NADH浓度通过测量340nm处的吸光度来确定。反应在100 mM磷酸钾缓冲液(pH 7.4)中进行,缓冲液中含有0.25 nM His-MDH2、600μM草酰乙酸和不同浓度的NADH(60、75、100、150和300μM)。Vmax和Km是使用Sigmaplot 13.0从双倒数Lineweaver–Burk图中确定的,并绘制了速度与NADH浓度的关系图。 |
||
| 细胞实验 |
HRE萤光素酶报告检测[1]
在添加了5%胎牛血清、100 U/mL青霉素和100μg/mL链霉素 的DMEM中培养表达缺氧反应元件(HRE)依赖性萤火虫荧光素酶报告基因和CMV肾菌荧光素酶报道基因的HCT116细胞。将细胞(2×104个细胞/0.1 mL/孔)接种在96孔组织培养板中20小时,用于后续实验。在常氧或缺氧条件下(1%O2、94%N2和5%CO2),细胞在有或没有药物的情况下孵育12小时。使用带有Victor X Light发光阅读器的双荧光素酶测定系统测量细胞的荧光素酶活性。 免疫印迹分析[1] 用PBS洗涤细胞,用RIPA缓冲液(20 mM HEPES(pH 7.4)、1%Triton X-100、10%甘油、1 mM EDTA、5 mM氟化钠、10μg/mL苯甲基磺酰氟(PMSF)和1 mM钒酸钠)在4°C下裂解15分钟,并在13 000 rpm下离心15分钟。然后将裂解物在5×样品缓冲液(50 mM Tris(pH 7.4,4%十二烷基硫酸钠(SDS),10%甘油,4%2-硫代乙醇和50μg/mL溴酚蓝)中以4:1的比例煮沸5分钟。蛋白质样品经过SDS-聚丙烯酰胺凝胶电泳(PAGE),转移到PVDF膜上,用抗HIF-1α或抗β-肌动蛋白进行免疫印迹。蛋白质表达在Kodak Biomax X射线胶片上可见。 在癌症治疗中,缺氧诱导因子HIF-1是辐射耐受和预后不良的原因。作为我们药物发现计划的一部分,一种新型HIF抑制剂LW6被鉴定为一种抑制HIF-1α积累的小化合物。我们发现LW6降低了HIF-1α蛋白的表达,但不影响HIF-1β的表达。MG132是一种蛋白酶体抑制剂,保护HIF-1α免受LW6诱导的蛋白酶体降解,表明LW6影响HIF-1α蛋白的稳定性。我们发现,LW6在氧依赖性降解结构域(ODDD)的羟基化位点促进了野生型HIF-1α的降解,但对P402A和P564A修饰的DM-HIF-1α没有促进。LW6不影响脯氨酰羟化酶(PHD)的活性,但诱导von Hippel-Lindau(VHL)的表达,VHL与脯氨酰羟基化的HIF-1α相互作用,进行蛋白酶体降解。在LW6存在的情况下,VHL的敲除并没有消除HIF-1α蛋白的积累,这表明LW6通过调节VHL的表达来降解HIF-1α。在携带人结肠癌癌症HCT116细胞异种移植物的小鼠中,LW6在体内表现出强大的抗肿瘤功效,并导致组织免疫组织化学染色中HIF-1α表达降低。这些数据表明,LW6在开发用于癌症治疗的HIF-1α抑制剂方面可能是有价值的。[3] 通过使用过表达每种转运蛋白(MDCKII-BCRP和MDCKII-MDR1)的MDCKII细胞,评估LW6对BCRP和P-gp这两种主要外排转运蛋白的功能活性和基因表达的影响。在转染细胞中还评估了其对共给药抗癌药物的细胞毒性和药代动力学的影响。[4] |
||
| 动物实验 |
|
||
| 参考文献 |
|
||
| 其他信息 |
A structure-activity relationship study of hypoxia inducible factor-1α inhibitor 3-aminobenzoic acid-based chemical probes, which were previously identified to bind to mitochondrial malate dehydrogenase 2, was performed to provide a better understanding of the pharmacological effects of LW6 and its relation to hypoxia inducible factor-1α (HIF-1α) and malate dehydrogenase 2 (MDH2). A variety of multifunctional probes including the benzophenone or the trifluoromethyl diazirine for photoaffinity labeling and click reaction were prepared and evaluated for their biological activity using a cell-based HRE-luciferase assay as well as a MDH2 assay in human colorectal cancer HCT116 cells. Among them, the diazirine probe 4a showed strong inhibitory activity against both HIF-1α and MDH2. Significantly, the inhibitory effect of the probes on HIF-1α activity was consistent with that of the MDH2 enzyme assay, which was further confirmed by the effect on in vitro binding activity to recombinant human MDH2, oxygen consumption, ATP production, and AMP activated protein kinase (AMPK) activation. Competitive binding modes of LW6 and probe 4a to MDH2 were also demonstrated.[1]
Purpose: The present study aimed to discover a new potent BCRP inhibitor overcoming multidrug resistance. Methods: Effects of LW6 on the functional activity and gene expression of two major efflux transporters, BCRP and P-gp, were evaluated by using MDCKII cells overexpressing each transporter (MDCKII-BCRP and MDCKII-MDR1). Its effects on the cytotoxicity and pharmacokinetics of co-administered anticancer drugs were also evaluated in transfected cells and rats, respectively. Results: In MDCKII-BCRP cells overexpressing BCRP, LW6 enhanced significantly (p < 0.05) the cellular accumulation of mitoxantrone, a BCRP substrate, and was more potent than Ko143, a well-known BCRP inhibitor. LW6 also down-regulated BCRP expression at concentrations of 0.1-10 µM. Furthermore, cells became more susceptible to the cytotoxicity of anticancer drugs in the presence of LW6. The CC50 values of mitoxantrone and doxorubicin were reduced by three- and tenfold, respectively, in MDCKII-BCRP cells, while LW6 did not affect the cytotoxicity of anticancer drugs in MDCKII-mock cells lacking BCRP transporter. Furthermore, LW6 improved the oral exposure of methotrexate by twofold in rats. In contrast to BCRP, LW6 had no inhibition effect on the functional activity and gene expression of P-gp. Conclusion: LW6 was newly identified as a potent BCRP inhibitor and could be useful to reduce the multidrug resistance of cancer cells via the inhibition of BCRP-mediated drug efflux as well as the down-regulation of BCRP expression.[2] |
| 分子式 |
C26H29NO5
|
|
|---|---|---|
| 分子量 |
435.51
|
|
| 精确质量 |
435.204
|
|
| 元素分析 |
C, 71.70; H, 6.71; N, 3.22; O, 18.37
|
|
| CAS号 |
934593-90-5
|
|
| 相关CAS号 |
|
|
| PubChem CID |
16124726
|
|
| 外观&性状 |
white solid powder
|
|
| 密度 |
1.3±0.1 g/cm3
|
|
| 沸点 |
647.4±55.0 °C at 760 mmHg
|
|
| 闪点 |
345.3±31.5 °C
|
|
| 蒸汽压 |
0.0±2.0 mmHg at 25°C
|
|
| 折射率 |
1.637
|
|
| LogP |
6.49
|
|
| tPSA |
88.35
|
|
| 氢键供体(HBD)数目 |
2
|
|
| 氢键受体(HBA)数目 |
5
|
|
| 可旋转键数目(RBC) |
7
|
|
| 重原子数目 |
32
|
|
| 分子复杂度/Complexity |
659
|
|
| 定义原子立体中心数目 |
0
|
|
| SMILES |
O=C(C1C=C(NC(COC2C=CC(C34CC5CC(C3)CC(C5)C4)=CC=2)=O)C(O)=CC=1)OC
|
|
| InChi Key |
BJRPPNOJYFZSLY-UHFFFAOYSA-N
|
|
| InChi Code |
InChI=1S/C26H29NO5/c1-31-25(30)19-2-7-23(28)22(11-19)27-24(29)15-32-21-5-3-20(4-6-21)26-12-16-8-17(13-26)10-18(9-16)14-26/h2-7,11,16-18,28H,8-10,12-15H2,1H3,(H,27,29)
|
|
| 化学名 |
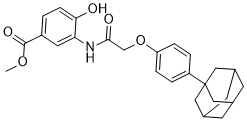
methyl 3-[[2-[4-(1-adamantyl)phenoxy]acetyl]amino]-4-hydroxybenzoate
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: 2.5 mg/mL (5.74 mM) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 悬浮液;超声助溶。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (5.74 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL 澄清 DMSO 储备液加入到 900 μL 玉米油中并混合均匀。 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.2962 mL | 11.4808 mL | 22.9616 mL | |
| 5 mM | 0.4592 mL | 2.2962 mL | 4.5923 mL | |
| 10 mM | 0.2296 mL | 1.1481 mL | 2.2962 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
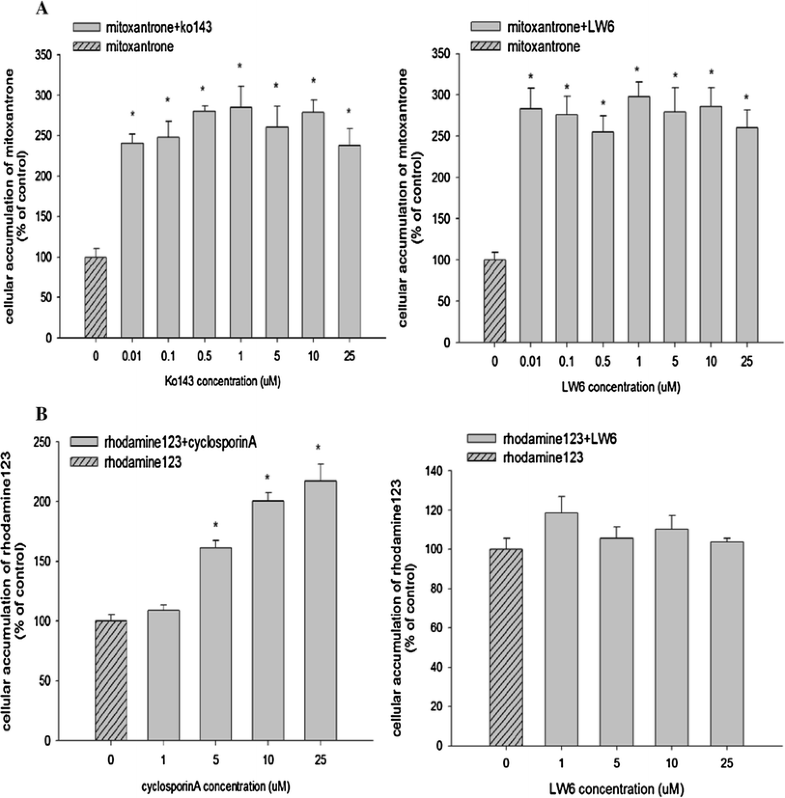 Inhibition effect of LW6 on the cellular accumulation of mitoxantrone in MDCKII-BCRP cells (a) and rhodamine-123 in MDCKII-MDR1 cells (b) (mean±SD,n=6). *pCancer Chemother Pharmacol.2016 Oct;78(4):735-44. |
|---|
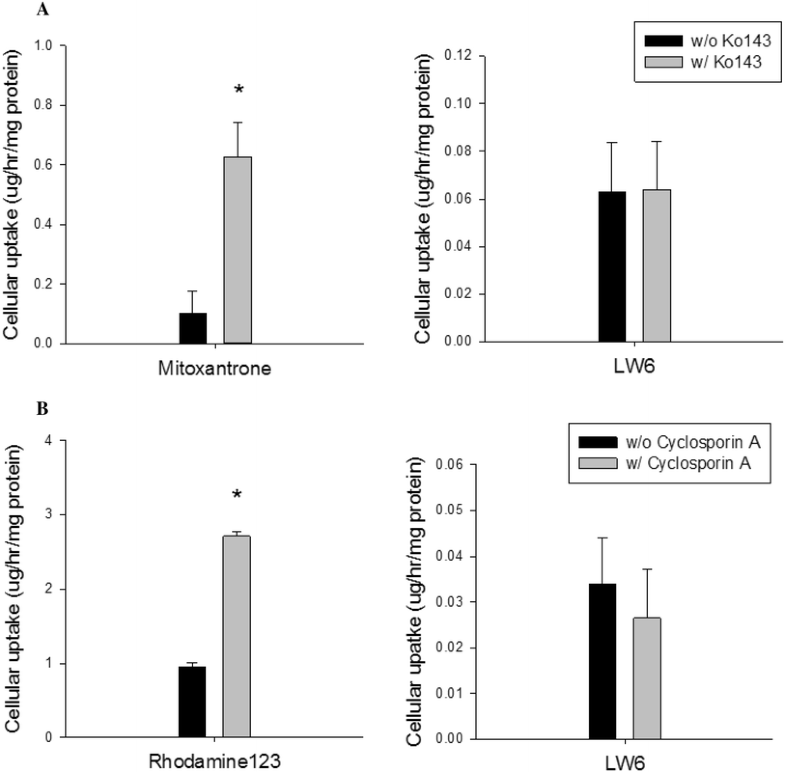 Cellular uptake studies of LW6 in MDCKII-BCRP cells (a) and MDCKII-MDR1 cells (b) (mean±SD,n=6).Cancer Chemother Pharmacol.2016 Oct;78(4):735-44. |
Effect of LW6 on the expression of BCRP.Cancer Chemother Pharmacol.2016 Oct;78(4):735-44. |
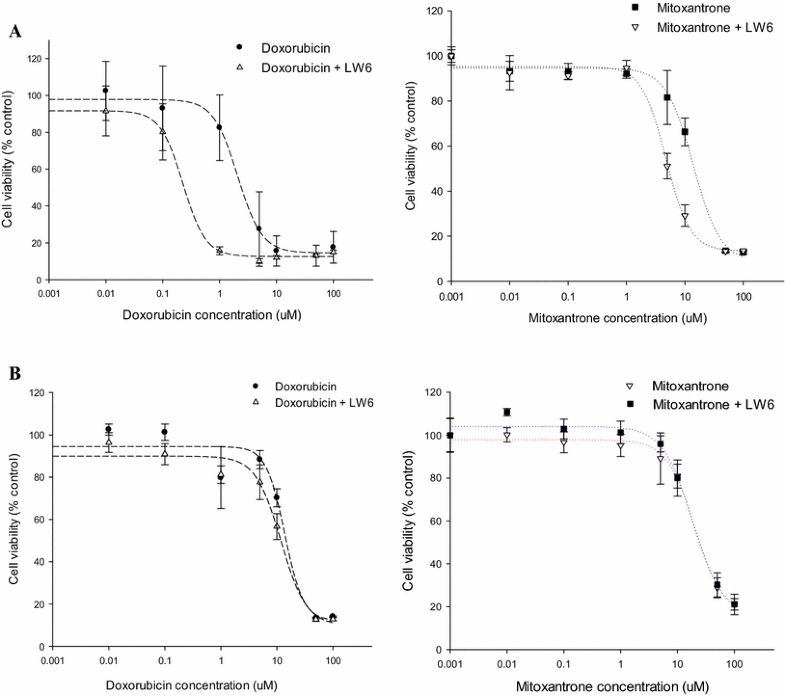 Cytotoxicity of mitoxantrone and doxorubicin with/without LW6 in MDCKII-BCRP.Cancer Chemother Pharmacol.2016 Oct;78(4):735-44. |
|---|
Plasma concentration–time profiles of methotrexate after an oral administration of methotrexate (10mg/kg) in the presence and absence of LW6 (10mg/kg) in rats (mean±SD,n=5).Cancer Chemother Pharmacol.2016 Oct;78(4):735-44. |