| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
MMP-9/matrix metalloproteinase-9 (Kd = 2.1 μM)
|
|---|---|
| 体外研究 (In Vitro) |
MMP-9-IN-1(化合物 2;100 μM;14 小时)不会引起显着的细胞毒性[1]。
MMP-9-IN-1(化合物 2;10 μM)可显着预防 MDA-MB-435和 HT-1080 细胞增殖[1]。 已鉴定化合物对MMP-9诱导的细胞迁移的抑制作用[1] 将表达MMP-9 cDNA或GFP cDNA作为对照的COS-1细胞与或不与化合物(剂量范围为100 nM至100μM)预孵育30分钟,并通过Transwell室迁移试验进行检测。化合物1、2、3和5抑制了表达MMP-9的COS-1细胞的迁移,而化合物4没有显示出活性(图3A-E)。化合物3和5,但不是1和2/MMP-9-IN-1,抑制了对照细胞(GFP转染)和MMP-9转染细胞的迁移(图3C&E)。 为了排除这些化合物减少细胞迁移是由于细胞毒性的可能性,进行了细胞存活率测定。COS-1细胞用化合物处理24小时,然后进行细胞毒性试验。Thapsigargin是一种抑制细胞内Ca2+-ATP酶的内质网应激诱导剂,被用作触发细胞死亡的阳性对照。在使用的最大浓度下,化合物1、2和4的处理没有引起显著的细胞毒性,而化合物3和5的处理则诱导了细胞死亡(图3F)。因此,化合物3和5被排除在进一步评估之外。 在COS-1细胞中测定化合物1和2/MMP-9-IN-1的致死剂量(LD50)。用递增剂量的化合物处理细胞24小时,然后进行细胞存活率测定(增刊图1)。化合物1和2的LD50分别为360±2μM和3.5±0.3mM,表明它们对MMP-9诱导的细胞迁移的抑制不是由于细胞毒性。 为了进一步确定化合物1和2/MMP-9-IN-1对MMP-9诱导的细胞迁移的特异性和选择性,我们研究了化合物1和2对其他MMP诱导的细胞迁徙的影响,其中PEX结构域已被报道在增强细胞迁移中起着关键作用,例如MMP-2和MT1-MMP(MMP-14)。与表达MMP-9的细胞相比,这两种化合物都没有抑制MMP-2或MT1-MMP异位表达COS-1细胞的迁移(图4A)。此外,化合物2不干扰通过3D侵袭测定检测的MT1-MM介导的癌症细胞侵袭(Suppl.图2)。因此,可能与MMP-9的PEX结构域结合的小型合成化合物以增强的特异性和选择性抑制MMP-9诱导的细胞迁移。 化合物1和2对产生内源性MMP-9的癌症细胞迁移的抑制/MMP-9-in-1[1] 我们接下来研究了化合物1和2是否抑制产生病理相关水平的内源性MMP-9的细胞迁移。采用两种表达高内源性MMP-9水平的人侵袭性癌症细胞系HT-1080和MDA-MB-435。用化合物1和2处理细胞显著降低了细胞迁移能力。此外,这两种化合物均以剂量依赖的方式抑制HT-1080和MDA-MB-435细胞的迁移(图4B&C)。 细胞迁移是癌症细胞侵袭性的关键决定因素。因此,在3D I型胶原侵袭试验中评估了HT-1080细胞。正如预期的那样,在用化合物1和2处理的细胞中,HT-1080细胞的细胞侵袭能力受到了显著抑制(图4D&E)。还观察到MDA-MB-435细胞侵袭的抑制(数据未显示)。这些数据表明,化合物对MMP-9介导的细胞迁移的抑制导致抑制癌症细胞侵袭。 化合物1和2/MMP-9-IN-1不影响MMP-9表达或蛋白水解活性[1] 使用抗MMP-9抗体通过蛋白质印迹检测用和不用化合物1和2处理的HT-1080细胞的细胞裂解物中MMP-9的表达水平。使用微管蛋白抗体的蛋白质印迹作为对照。未观察到化合物对MMP-9表达的影响(图5A)。 通过将纯化的proMMP-9与对氨基苯基醋酸汞(APMA)孵育,获得活化的MMP-9。通过切割荧光Mca-P-L-G-L-Dpa-A-R-NH2肽来测量,向APMA活化的MMP-9中添加化合物1和2不会抑制MMP-9的催化活性(图5B)。这些数据表明,化合物1和2对MMP-9诱导的细胞迁移的抑制不是由于MMP-9表达或蛋白水解活性的抑制。 化合物2/MMP-9-IN-1与MMP-9 PEX结构域的结合[1] 我们通过监测MMP-9色氨酸荧光来滴定化合物2与MMP-9的结合。用化合物2饱和纯化的proMMP-9导致MMP-9发射的λmax发生7nm的蓝移(图5C)。仅缓冲液对照对蛋白质荧光没有影响。MMP-9与化合物2结合的Kd为2.1±0.2μM。 为了进一步表征化合物2和MMP-9之间的结合,我们采用了之前产生的MMP-9嵌合体,其中MMP-9的PEX结构域被MMP-2的PEX域取代(MMP-9/MMP-2PEX)。在MMP-9/MMP-2PEX中加入化合物2后,未检测到荧光变化(图5D)。同样,化合物2不与纯化的重组可溶性MT1-MMP结合。这些数据证实化合物2特异性结合MMP-9的PEX结构域。化合物1在280nm处的吸收排除了对其结合性能的评估。 为了测试化合物2是否干扰proMMP-9同源二聚化,在化合物2和4存在或不存在的情况下,对转染有proMMP-9/Myc和proMMP-9/HA cDNA的COS-1细胞进行共免疫沉淀。用化合物2而非无活性化合物4处理转染细胞,导致MMP-9同二聚体形成受阻(图5E)。这种缺陷不是由于化合物2抑制MMP-9的表达,HT-1080细胞裂解物的蛋白质印迹证明了这一点(图5A)。在相互共免疫沉淀试验中也得到了类似的结果(图5E)。该实验证实,化合物2特异性抑制MMP-9同源二聚化 同二聚体MMP-9与细胞表面粘附分子CD44相互作用,导致EGFR和下游MAPK(ERK1/2)通路的激活。为了探索这一网络,我们检查了下游效应器ERK1/2的活性状态。在化合物存在或不存在的情况下,将异位表达MMP-9 cDNA的COS-1细胞血清饥饿18小时,然后使用抗磷酸化ERK1/2和总ERK1/2抗体进行蛋白质印迹。如图5F所示,在化合物2处理的细胞中观察到ERK1/2的活化减少。综上所述,这些数据表明,化合物2对MMP-9介导的细胞迁移的消除是由于MMP-9同源二聚化的破坏,这导致无法与CD44和EGFR-MAPK信号通路相互作用。 化合物2/MMP-9-IN-1[1] 对MMP-9介导的细胞增殖的影响 在化合物2/MMP-9-in-1或4存在或不存在的情况下,用CellTiter-Glo®发光测定法监测转染有MMP-9或GFP cDNA的COS-1细胞(对照)的细胞增殖情况。与之前的观察结果一致,与表达GFP的COS-1细胞相比,表达MMP-9的COS-1电池的细胞增殖率显著增加(P<0.05)(图6A)。化合物4不影响MMP-9诱导的细胞增殖,这与化合物4对MMP-9-诱导的细胞迁移没有影响是一致的。相比之下,化合物2显著降低了MMP-9诱导的细胞增殖(图6A),但不影响转染GFP cDNA的COS-1细胞的增殖(图6B)。为了确定化合物2是否也影响产生内源性MMP-9的癌症细胞的增殖,用10μM化合物2处理HT-1080和MDA-MB-435癌症细胞。用化合物2处理的HT-1080和MDA-MB-435细胞观察到细胞增殖的显著抑制,但用化合物4或DMSO对照处理的细胞没有(图6C&D)。 |
| 体内研究 (In Vivo) |
MMP-9-IN-1(化合物 2;20 mg/kg;腹膜内和瘤内注射交替注射;每周 6 天;持续 14 周)导致具有 MDA-MB-435 的 NCR-Nu 小鼠肿瘤生长显着延迟/GFP肿瘤[1]。 MMP-9-IN-1在体内抑制癌细胞转移[1]。
MMP-9-in-1/化合物2治疗的小鼠肿瘤生长和肺转移减少[1] MDA-MB-435细胞在裸鼠体内具有高度转移性(30,31),并产生高水平的MMP-9,因此可作为探索具有抗MMP-9活性的化合物的体内抑制活性的适当实验模型。为了促进组织的体内分析和肺转移的可视化,MDA-MB-435细胞被GFP cDNA稳定转染,并皮下植入雌性免疫缺陷小鼠的乳腺脂肪垫内。用化合物2/MMP-9-IN-1治疗小鼠导致肿瘤生长严重延迟,而用非活性对照化合物4或单独使用载体治疗未能抑制肿瘤生长(图7A&B)。化合物2不影响肿瘤发病率。 取出荷瘤小鼠的肺部,在荧光显微镜下检查肺部切片(3mm厚)(图7C)。在载体对照组和化合物4治疗组中,MDA-MB-435/GFP荷瘤小鼠出现多个大结节,而化合物2/MMP-9-In-1治疗的小鼠肺转移程度显著降低(图7C)。此外,这些小鼠的肺部肿瘤病灶面积和显示肺部转移的小鼠百分比显著降低(图7D和E)。因此,化合物2的治疗削弱了MMP-9对原发性肿瘤生长和转移的体内作用。在14周期间,在化合物2治疗的小鼠中没有观察到体重的显著变化或其他毒性迹象。 |
| 酶活实验 |
酶活性的荧光测定[1]
在检测前,将荧光肽底物(50μM)(18)与化合物在存在或不存在潜在MMP-9和APMA激活的MMP-9的情况下在25°C下孵育30分钟。在荧光板读数器中测量393nm处的荧光发射和328nm处的激发。 荧光光谱[1] 通过观察结合时色氨酸发射的变化来测定化合物2与MMP-9的结合。在化合物2存在或不存在的情况下,将纯化的重组MMP-9(50 nM)或MMP-9/MMP-2PEX(50 nM)在缓冲液(50 mM Tris-HCl、60 mM KCl和0.05%吐温20,pH 7.4)中稀释。作为蛋白质稳定性和损失的对照,向蛋白质中加入类似的缓冲溶液。在具有双激发和发射单色器的QM-4/200SE光谱荧光计上,使用0.3nm的狭缝宽度在280nm处激发蛋白质样品,并在290-400nm处收集发射扫描。收集了三次发射扫描,并在每种浓度下取平均值。使用Prism软件包(GraphPad V5)确定Kd,以将数据拟合到方程(1)中。 酶活性的荧光测定[2] 检测前,将Mca-PLGL-Dpa-AR-NH2荧光肽底物(DMSO中终浓度为10μM)与化合物和对氨基苯汞醋酸盐(APMA)激活的proMMP-9在25°C下孵育30分钟。在荧光板读数器中测量405nm处的荧光发射和320nm处的激发。 |
| 细胞实验 |
细胞活力[1]
使用CellTiter Glo™发光细胞活力测定法测定化合物的细胞毒性。。将2.5×104个COS-1细胞铺在96孔板上,与化合物1-5一起孵育18小时。使用SpectraMax微孔板阅读器记录发光。在100 pM至10 mM的浓度范围内测量化合物的LD50。使用Prism软件包(GraphPad V5)并拟合方程(2)来确定LD50。 ΔL=(ΔLmax∗[⻐𝐧119841; 119835; 119853𝐨119851])/(LD50+[⻏。 细胞增殖[1] 使用CellTiter-Glo™发光测定法测定细胞增殖。在化合物存在或不存在的情况下,将细胞(5×103)加入96孔板中,并通过发光分析监测9天。 细胞活力 HT1080细胞在含有或不含化合物3c的完全培养基中培养。每日更换培养基和药物,并通过MTT法[3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑]监测细胞存活率。每天,将细胞暴露于MTT中,在37°C下孵育4小时。停止反应,溶解甲氮晶体;将所得溶液进行比色分光光度法测定,并在570nm波长下读取。52 绒毛尿囊膜血管生成和侵袭试验[2] 如前所述,进行了绒毛尿囊膜(CAM)测定。53将受精的白鸡蛋在37°C、70%湿度下孵育3天。然后将胚胎在无菌培养皿中离卵孵化7天。将吸附有经或不经化合物3c处理的HT1080细胞的明胶海绵植入CAM表面,并在植入后第4天对新生血管系统进行计数。54,55为了对绒毛尿囊膜进行组织化学分析,除了在第10天用预处理过的HT1080细胞与IV型胶原溶液(3 mg mL-1)混合接种外,胚胎按照血管生成试验进行处理。孵育7天后,分离含有细胞点胶原混合物的CAM片段,福尔马林固定,并在OCT中包埋后用切片机切成6μm的切片。然后用苏木精染色,用伊红复染。 二维点迁移分析[2] 将转染的细胞与等体积的中和I型胶原(3mg mL-1)在冰上混合。然后将细胞-胶原混合物(1μL 1×107细胞/mL)点样到96孔板上。细胞-胶原点固化后,细胞-胶原半球覆盖100μL完整培养基,孵育8-18小时(孵育时间因细胞类型而异),然后用DAPI核染料染色,并使用尼康Elements基础研究软件分析工具对迁移的细胞进行计数。 |
| 动物实验 |
4-5 week-old female NCR-Nu mice bearing MDA-MB-435/GFP tumor[1]
20 mg/kg Intraperitoneal and intratumoral injection alternately; 6 days/week; for 14 weeks, In vivo Study [1] Human MDA-MB-435 cancer cells (2 × 106) expressing green fluorescent protein (GFP) cDNA were inoculated subcutaneously into 4–5 week-old female NCR-Nu mice with 5 mice per group (Taconic). Once palpable, tumors were measured twice/week and volume was calculated using the following formula: length × width × height × 0.5236. Mice were treated with a vehicle control (DMSO/PBS), compound 2/MMP-9-IN-1, or 4 (20 mg/kg) via intraperitoneal and intratumoral injection alternately (6 days/week). At 14 weeks, the mice were sacrificed and the tumors and lungs were dissected. Fresh lung sections were cut (~3 mm thick) and examined for the presence of GFP-expressing tumor foci. The area of metastatic foci per field of examination was quantified from 10 random sites of three different slides for each mouse using NIH ImageJ software. |
| 参考文献 |
|
| 其他信息 |
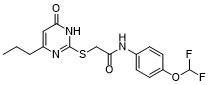
MMP-9-IN-1 is a secondary carboxamide resulting from the formal condensation of the carboxy group of [(4-oxo-6-propyl-1,4-dihydropyrimidin-2-yl)sulfanyl]acetic acid with the amino group of 4-(difluoromethoxy)aniline. It is a specific matrix metalloproteinase-9 (MMP-9) inhibitor. It has a role as an EC 3.4.24.35 (gelatinase B) inhibitor and an antineoplastic agent. It is an organofluorine compound, an aromatic compound, a pyrimidone, an organic sulfide and a secondary carboxamide.
Lack of target specificity by existing matrix metalloproteinase (MMP) inhibitors has hindered antimetastatic cancer drug discovery. Inhibitors that bind to noncatalytic sites of MMPs and disrupt protease signaling function have the potential to be more specific and selective. In this work, compounds that target the hemopexin (PEX) domain of MMP-9 were identified using an in silico docking approach and evaluated using biochemical and biological approaches. Two of the selected compounds interfere with MMP-9-mediated cancer cell migration and proliferation in cells expressing exogenous or endogenous MMP-9. Furthermore, these inhibitors do not modulate MMP-9 catalytic activity. The lead compound, N-[4-(difluoromethoxy)phenyl]-2-[(4-oxo-6-propyl-1H-pyrimidin-2-yl)sulfanyl]-acetamide, specifically binds to the PEX domain of MMP-9, but not other MMPs. This interaction between the compound and the PEX domain results in the abrogation of MMP-9 homodimerization and leads to blockage of a downstream signaling pathway required for MMP-9-mediated cell migration. In a tumor xenograft model, this pyrimidinone retarded MDA-MB-435 tumor growth and inhibited lung metastasis. Thus, we have shown for the first time that a novel small-molecule interacts specifically with the PEX domain of MMP-9 and inhibits tumor growth and metastasis by reducing cell migration and proliferation. [1] A lack of target specificity has greatly hindered the success of inhibitor development against matrix metalloproteinases (MMPs) for the treatment of various cancers. The MMP catalytic domains are highly conserved, whereas the hemopexin-like domains of MMPs are unique to each family member. The hemopexin-like domain of MMP-9 enhances cancer cell migration through self-interaction and heterointeractions with cell surface proteins including CD44 and α4β1 integrin. These interactions activate EGFR-MAP kinase dependent signaling that leads to cell migration. In this work, we generated a library of compounds, based on hit molecule N-[4-(difluoromethoxy)phenyl]-2-[(4-oxo-6-propyl-1H-pyrimidin-2-yl)sulfanyl]-acetamide, that target the hemopexin-like domain of MMP-9. We identify N-(4-fluorophenyl)-4-(4-oxo-3,4,5,6,7,8-hexahydroquinazolin-2-ylthio)butanamide, 3c, as a potent lead (Kd = 320 nM) that is specific for binding to the proMMP-9 hemopexin-like domain. We demonstrate that 3c disruption of MMP-9 homodimerization prevents association of proMMP-9 with both α4β1 integrin and CD44 and results in the dissociation of EGFR. This disruption results in decreased phosphorylation of Src and its downstream target proteins focal adhesion kinase (FAK) and paxillin (PAX), which are implicated in promoting tumor cell growth, migration, and invasion. Using a chicken chorioallantoic membrane in vivo assay, we demonstrate that 500 nM 3c blocks cancer cell invasion of the basement membrane and reduces angiogenesis. In conclusion, we present a mechanism of action for 3c whereby targeting the hemopexin domain results in decreased cancer cell migration through simultaneous disruption of α4β1 integrin and EGFR signaling pathways, thereby preventing signaling bypass. Targeting through the hemopexin-like domain is a powerful approach to antimetastatic drug development. [2] |
| 分子式 |
C16H17N3O3F2S
|
|---|---|
| 分子量 |
369.386
|
| 精确质量 |
369.095
|
| 元素分析 |
C, 52.03; H, 4.64; F, 10.29; N, 11.38; O, 12.99; S, 8.68
|
| CAS号 |
502887-71-0
|
| 相关CAS号 |
502887-71-0
|
| PubChem CID |
135415473
|
| 外观&性状 |
White to off-white solid powder
|
| LogP |
3.2
|
| tPSA |
105
|
| 氢键供体(HBD)数目 |
2
|
| 氢键受体(HBA)数目 |
7
|
| 可旋转键数目(RBC) |
8
|
| 重原子数目 |
25
|
| 分子复杂度/Complexity |
547
|
| 定义原子立体中心数目 |
0
|
| SMILES |
CCCC1=CC(=O)NC(=N1)SCC(=O)NC2=CC=C(C=C2)OC(F)F
|
| InChi Key |
OLTRRVUORWPRGF-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C16H17F2N3O3S/c1-2-3-11-8-13(22)21-16(20-11)25-9-14(23)19-10-4-6-12(7-5-10)24-15(17)18/h4-8,15H,2-3,9H2,1H3,(H,19,23)(H,20,21,22)
|
| 化学名 |
N-[4-(difluoromethoxy)phenyl]-2-[(6-oxo-4-propyl-1H-pyrimidin-2-yl)sulfanyl]acetamide
|
| 别名 |
MMP9-IN-1; MMP-9-IN-1; MMP-9-IN1; OUN87710; OUN 87710; OUN-87710
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO: 66.7~74 mg/mL (180.5~200.3 mM)
|
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: 5 mg/mL (13.54 mM) in 10% DMSO + 40% PEG300 50% PBS (这些助溶剂从左到右依次添加,逐一添加), 悬浮液;超声助溶。
配方 2 中的溶解度: ≥ 2.08 mg/mL (5.63 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 20.8 mg/mL 澄清 DMSO 储备液加入到 900 μL 玉米油中并混合均匀。 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.7072 mL | 13.5358 mL | 27.0717 mL | |
| 5 mM | 0.5414 mL | 2.7072 mL | 5.4143 mL | |
| 10 mM | 0.2707 mL | 1.3536 mL | 2.7072 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。