| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 50mg |
|
||
| Other Sizes |
|
| 靶点 |
Colchicine metabolite; tubulin
|
|---|---|
| 体外研究 (In Vitro) |
有效清除反应性自由基和产生的次级抗氧化自由基对重要细胞内成分的低反应性是断链抗氧化剂的两个关键要求。撇开微管蛋白结合特性不谈,秋水仙碱代谢物在很大程度上仍未测试其他可能的生物活性,包括抗氧化活性。Mourelle等人[Life Sci.45(1989)891]提出,秋水仙素(EIN)在大鼠肝损伤模型中起着抗氧化和保护脂质过氧化的作用。由于EIN以及另外两种秋水仙素代谢产物,2-去甲基秋水仙素(2DM)和3-去甲基秋秋水仙碱(3DM),在其碳环上具有一个羟基,可以参与自由基清除,我们测试了它们是否可以作为破链抗氧化剂。我们使用代谢掺入的氧化敏感顺式帕尼酸(PnA)的荧光高效液相色谱法研究了秋水仙碱代谢物对HL-60细胞中不同类别膜磷脂过氧化的影响。浓度在10(-6)至10(-4)M范围内的秋水仙素代谢物均不能保护磷脂免受过氧自由基偶氮引发剂或过氧化氢存在下髓过氧化物酶(MPO)催化反应引起的过氧化。然而,代谢物确实表现出谷胱甘肽的剂量依赖性耗竭,类似于依托泊苷的行为,依托泊甙是一种具有抗氧化特性的受阻酚,可以对抗脂质过氧化。电子自旋共振(ESR)实验表明,在含有辣根过氧化物酶(HRP)/H(2)O(2)的催化体系中,秋水仙素代谢物发生单电子氧化形成酚氧自由基,进而通过抗坏血酸的氧化引起ESR可检测的抗坏血酸自由基。秋水仙素代谢产物中的苯氧基也可以氧化GSH,这些苯氧基是通过MPO催化HL-60细胞中的H(2)O(2)依赖性反应和模型系统中的HRP/H(2)O2形成的。因此,秋水仙素代谢物具备许多抗氧化剂的先决条件,即碳环上的亲核羟基和清除反应性自由基并形成二级自由基的能力。然而,后者对细胞中的关键生物分子如脂质、硫醇、抗坏血酸保持高反应性,从而使秋水仙素代谢物成为有效的自由基清除剂,但不是有效的破链抗氧化剂。[1]
研究了秋水仙碱及其类似物对角叉菜胶诱导的大鼠足垫水肿的影响。在角叉菜胶注射后3小时和5小时测量秋水仙素类似物的抗炎作用。秋水仙碱、1-二甲基秋水仙碱和3-去甲基秋水仙素显著抑制角叉菜胶水肿,而2-二甲基秋秋水仙碱的活性要低得多。硫代秋水仙素类化合物在C-10处具有硫甲基而不是甲氧基,其效力要低得多。这些结果表明,秋水仙素中C-2和C-10处的甲氧基对于维持抗炎活性是必要的。脱乙酰秋水仙碱的失活表明,C-7处的氨基被吸电子基团取代也很重要。秋水仙素、3-去甲基秋水仙素,N-丁酰脱乙酰秋水仙素和秋水仙碱在体外表现出对角叉菜胶水肿的显著抑制和与微管蛋白的强结合。另一方面,N-羧乙氧基脱乙酰秋水仙素与微管蛋白结合良好,对角叉菜胶水肿没有太大影响。这些结果表明,秋水仙素的抗炎作用可能不是通过微管系统调节的[2]。 |
| 细胞实验 |
脂质过氧化实验[1]
将2毫升细胞悬浮液(每毫升1×106个细胞)转移到带螺旋盖的玻璃管中,并用以下药物之一预孵育15分钟:PMC、苯酚、依托泊苷、2DM、3-去甲基秋水仙素(3DM)、COL、EIN或NDE。秋水仙碱及其代谢产物的浓度在10−6至10−4 M之间。对照样品用载体DMSO处理。预孵育的细胞暴露于三种不同的氧化剂:过氧自由基的脂溶性偶氮引发剂AMVN(0.5 mM,37°C下2小时),水溶性偶氮起始剂AAPH(50 mM,37℃下30分钟)和H2O2(25μM,在37°C孵育1小时期间每15分钟添加一次)。 |
| 毒性/毒理 (Toxicokinetics/TK) |
mouse LD50 intraperitoneal 570 ug/kg Journal of Medicinal Chemistry., 24(636), 1981
|
| 参考文献 | |
| 其他信息 |
3-Desmethylcolchicine has been reported in Colchicum arenarium, Colchicum autumnale, and other organisms with data available.
The colchicine metabolites tested contain electron-donating hydroxy-groups that can readily undergo one-electron oxidation by MPO/H2O2 to their respective phenoxyl radicals. Our results clearly demonstrated that even at high concentrations (up to 100 μM), colchicine metabolites were unable to substantially inhibit MPO/H2O2-catalyzed phospholipid peroxidation in HL-60 cells (in contrast to a vitamin E homolog, PMC, or the phenolic antitumor drug etoposide). Neither did colchicine metabolites enhance phospholipid peroxidation-the effect readily observed in H2O2-treated HL-60 upon exposure to phenol. These results suggest that phenoxyl radicals formed from colchicine homologs are likely to be less reactive than the radicals generated from phenol but reactive enough to directly attack phospholipids and cause their peroxidation. To obtain further evidence for peroxidase-catalyzed production of phenoxyl radicals from colchicine metabolites, we performed model experiments using HRP/H2O2-catalytic system to detect radical formation by one-electron oxidation of ascorbate and ESR monitoring of the ascorbate radicals. We found that colchicine metabolites with hydroxy-groups were indeed oxidized to their phenoxyl radicals ESR-detectable by their subsequent reactions with ascorbate as ascorbate radicals. We further established that phenoxyl radials generated by peroxidases (MPO in HL-60 cells or HRP in model system) from colchicine homologs were able to react with thiols and cause GSH oxidation. This high reactivity of phenoxyl radicals of colchicine metabolites is similar to that of phenoxyl radicals of etoposide or phenol. In contrast, the vitamin E homolog, PMC, protected GSH against peroxidase-catalyzed oxidation suggesting that its phenoxyl radicals are not reactive towards thiols (Kagan et al., 1999). Taken together, the results demonstrate that even though all colchicine metabolites are capable of forming phenoxyl radicals by reaction with more reactive free radical species, they remain sufficiently reactive to cause not only consumption of glutathione and ascorbate but also oxidation of phospholipids. Thus, they are not chain-breaking antioxidants. This finding rules out the hypothesis that EIN, and probably other colchicine metabolites, can prevent lipid peroxidation via direct antioxidant action. It does not, however, rule out the possibility that they can protect against lipid peroxidation by other means such as modulation of neutrophil ‘oxidative burst’ associated with inflammation. [1] |
| 分子式 |
C21H23NO6
|
|---|---|
| 分子量 |
385.41
|
| 精确质量 |
357.158
|
| CAS号 |
7336-33-6
|
| PubChem CID |
299664
|
| 外观&性状 |
White to yellow solid powder
|
| 密度 |
1.31g/cm3
|
| 沸点 |
768.3ºC at 760 mmHg
|
| 熔点 |
163-166ºC
|
| 闪点 |
418.5ºC
|
| 折射率 |
1.61
|
| LogP |
3.157
|
| tPSA |
84.86
|
| 氢键供体(HBD)数目 |
2
|
| 氢键受体(HBA)数目 |
6
|
| 可旋转键数目(RBC) |
4
|
| 重原子数目 |
28
|
| 分子复杂度/Complexity |
724
|
| 定义原子立体中心数目 |
1
|
| SMILES |
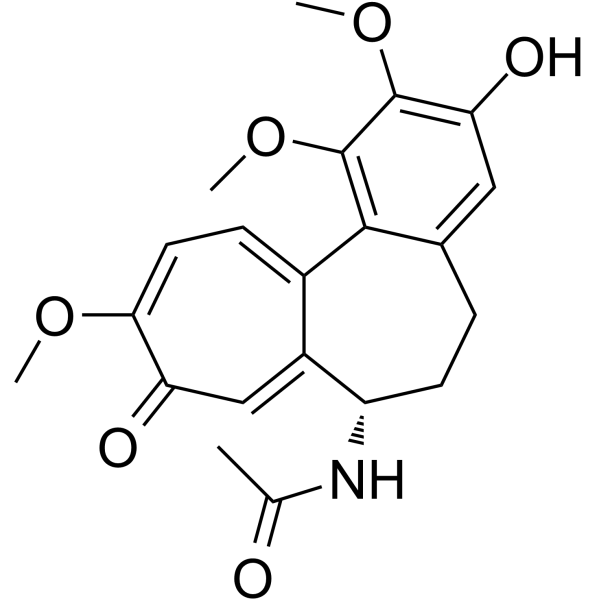
CC(=O)N[C@H]1CCC2=CC(=C(C(=C2C3=CC=C(C(=O)C=C13)OC)OC)OC)O
|
| InChi Key |
JRRUSQGIRBEMRN-HNNXBMFYSA-N
|
| InChi Code |
InChI=1S/C21H23NO6/c1-11(23)22-15-7-5-12-9-17(25)20(27-3)21(28-4)19(12)13-6-8-18(26-2)16(24)10-14(13)15/h6,8-10,15,25H,5,7H2,1-4H3,(H,22,23)/t15-/m0/s1
|
| 化学名 |
N-[(7S)-3-hydroxy-1,2,10-trimethoxy-9-oxo-6,7-dihydro-5H-benzo[a]heptalen-7-yl]acetamide
|
| 别名 |
3-Desmethylcolchicine; 7336-33-6; 3-Demethylcolchicine; 3-Demethyl Colchicine; (-)-3-demethylcolchicine; O3-Demethylcolchicine; 3-O-Demethylcolchicine; Desmethylcolchicine;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 本产品在运输和储存过程中需避光。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO: 100 mg/mL (259.46 mM)
|
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (6.49 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (6.49 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.5 mg/mL (6.49 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.5946 mL | 12.9732 mL | 25.9464 mL | |
| 5 mM | 0.5189 mL | 2.5946 mL | 5.1893 mL | |
| 10 mM | 0.2595 mL | 1.2973 mL | 2.5946 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。