| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
Antifungal; sterol biosynthesis; cytochrome P450 14α-demethylase
|
|---|---|
| 体外研究 (In Vitro) |
多种真菌,包括念珠菌属、贝氏毛孢子菌、新型念珠菌和烟曲霉,都对雷夫康唑的作用敏感。 MIC90 的范围是 0.025 至 0.39 mg/mL。雷维康唑的 MIC 范围为 0.05 至 0.39 mg/mL,对三种克柔念珠菌菌株表现出相对较高水平的活性。拉维康唑的 MIC 范围为 0.05 至 0.39 mg/mL,对须癣毛癣菌、红色毛癣菌、石膏毛癣菌和犬毛癣菌表现出良好的活性[1]。雷夫康唑对酵母菌的活性比氟康唑强约 40 倍,比伊曲康唑强两到四倍。大多数曲霉菌被雷夫康唑和伊曲康唑抑制,并且对一半的分离株具有杀灭活性。雷夫康唑和伊曲康唑对申克孢子丝菌和接合菌没有活性,但对大多数透明丝菌、皮肤癣菌和暗色真菌有活性,尽管不是杀灭性的[2]。
ER-30346是一种新型口服三唑类药物,对多种真菌具有广谱有效活性。ER-30346对白色念珠菌、假丝酵母菌、光假丝酵母菌的活性是伊曲康唑、氟康唑和两性霉素B的4 - 32倍,90%的被试菌株被抑制(mic90值为0.025 - 0.78微克/毫升)。ER-30346 (MIC90为12.5微克/ml)对热带假丝酵母的活性是伊曲康唑和氟康唑的2 ~ 8倍,比两性霉素B的活性低16倍,MIC90为0.78微克/ml,比氟康唑和两性霉素B的活性高4 ~ 8倍,与伊曲康唑对贝氏毛丝虫病的活性相当。ER-30346对新型隐球菌和烟曲霉的mic90分别为0.10微克/ml和0.39微克/ml。ER-30346的活性是伊曲康唑和两性霉素B的2 ~ 8倍,是氟康唑的32 ~ 256倍。ER-30346对皮肤真菌也表现出良好的活性,mic值在0.05 ~ 0.39微克/ml之间,与伊曲康唑、两性霉素B的活性相当或高2 ~ 16倍,与氟康唑的活性相当或高32倍。[1] |
| 体内研究 (In Vivo) |
当雷夫康唑以2至40mg/kg体重的剂量给药时,血浆中药物的最大浓度和浓度-时间曲线下面积均表现出良好的线性。与对照治疗相比,给予 2.5 mg/kg 雷康唑可显着延迟死亡率。此外,雷夫康唑对系统性隐球菌病具有显着的积极治疗作用[1]。与对照组肺部的 CFU 相比,雷夫康唑显着降低了肺部的 CFU。在大鼠口腔念珠菌病实验模型中,与对照组口腔拭子相比,雷夫康唑在减少口腔拭子中 CFU 数量方面比伊曲康唑更有效,与氟康唑同等有效。 [3]。
雷夫康唑/ER-30346是一种新型口服三唑类药物,对多种真菌具有广谱有效活性。本研究探讨口服ER-30346对烟曲霉、白色念珠菌和新型隐球菌实验性局部感染的治疗效果,并与伊曲康唑和氟康唑进行比较。在肺曲霉病、念珠菌病和隐球菌病的实验小鼠模型中,ER-30346与对照组相比,肺中CFU数量明显减少(P < 0.05)。ER-30346治疗肺曲霉病的效果与伊曲康唑相同或更有效。ER-30346对肺念珠菌病和隐球菌病的治疗效果优于伊曲康唑,与氟康唑效果相当。ER-30346对耐氟康唑白色念珠菌引起的肺念珠菌病也有效。在颅内隐球菌病小鼠中,ER-30346与对照组相比显著降低脑内CFU数(P < 0.05),其效果优于伊曲康唑,与氟康唑相同。在大鼠口腔念珠菌病实验模型中,ER-30346与对照组相比,显著降低了口腔拭子中CFU的数量(P < 0.05),其效果优于伊曲康唑,与氟康唑相同。因此,ER-30346在小鼠曲霉病、念珠菌病和隐球菌病模型中显示出疗效。需要进一步的研究来确定ER-30346用于治疗这些感染的潜力。[3] 通过小鼠全身感染来评估体内活性。ER-30346对全身念珠菌病和隐球菌病的疗效与氟康唑相当,比伊曲康唑更有效。在测试的药物中,ER-30346是对抗全体性曲霉病最有效的药物。我们研究了小鼠血浆中ER-30346的水平。ER-30346的血药最大浓度与浓度-时间曲线下面积在2 ~ 40mg /kg体重范围内呈良好的线性关系。[1] |
| 酶活实验 |
比较了BMS-207147(也称为ER-30346)与伊曲康唑和氟康唑对44种250株真菌的抑菌活性。mic采用国家临床实验室标准委员会(NCCLS)推荐的酵母菌肉汤稀释法测定,该方法对丝状真菌进行了改进。BMS-207147的抗酵母菌活性是伊曲康唑的2 - 4倍,是氟康唑的40倍。根据nccls推荐的伊曲康唑耐药MIC断点为>或= 1 μ g/ml,氟康唑对念珠菌的耐药MIC断点为>或= 64 μ g/ml,伊曲康唑和氟康唑对克鲁氏念珠菌和热带念珠菌均无活性。116株假丝酵母菌中,除9株(均为热带假丝酵母菌)外,其余菌株的BMS-207147 mic值均< 1微克/毫升。三唑类药物对半数念珠菌和所有新型隐球菌均有抑制作用。除BMS-207147和伊曲康唑对隐球菌有抑菌作用外,3种三唑对大多数酵母菌均有抑菌作用。BMS-207147和伊曲康唑对大部分曲霉有抑制作用,对半数菌株有杀灭作用。BMS-207147和伊曲康唑对大多数透明丝孢菌(镰刀菌和波氏假杆菌除外)、皮肤菌和赤霉病菌有活性,但对申克孢子丝菌和接合菌无活性。氟康唑对除石膏小孢子菌外的大多数丝状真菌无活性。因此,BMS-207147的光谱和效力表明它应该是临床开发的候选药物。
|
| 细胞实验 |
抗真菌药敏试验方法。[2]
所有分离株(马拉色菌除外)均采用NCCLS概述的参考肉汤大稀释法进行检测,并对其进行了改进,用于丝状真菌的抗真菌检测。BMS来自卫材公司,FLU来自辉瑞公司,ITR来自杨森制药,AMB来自百时美施贵宝公司。 FLU和ITR的解释性MIC断点来自ncls指南;这些断点可作为假丝酵母菌株的解释性指南。ncls推荐的流感断点如下:≤8 μg/ml,敏感;16 ~ 32 μg/ml,敏感剂量依赖性(S-DD);≥64 μg/ml耐药。对于ITR, nccls推荐的MIC断点为:≤0.13 μg/ml,敏感;0.25 ~ 0.5 μg/ml, S-DD;≥1 μg/ml耐药。在这一点上,没有为BMS建立解释性MIC断点。考虑到两种化合物在狗的血浆中达到相同的峰值水平,为了讨论本报告中的MIC结果,我们将使用ITR解释BMS的断点。至于AMB, NCCLS没有推荐可解释的MIC断点,尽管在动物模型中,AMB MIC为bb0.1 μg/ml的念珠菌分离株出现耐药性。因此,当采用NCCLS RPMI 1640方法时,本研究将AMB耐药定义为AMB mic≥2 μg/ml。 酵母菌按NCCLS指南进行肉汤稀释,丝状真菌按Espinel-Ingroff法和Kerkering法进行改良。琼脂稀释法用于毛马拉色菌已在前面描述。 根据NCCLS推荐的方法,用肉汤稀释法测定MIC终点。AMB mic被定义为抑制所有可见生长的最低药物浓度(即100%抑制)。FLU、ITR和BMS mic被定义为抑制生长对照管中80%生长的最低药物浓度(通过与生长对照的1:5稀释率进行比较确定),但毛马拉色菌除外,其100%生长抑制是终点。 Minimum fungicidal concentrations (MFCs)最低杀真菌浓度。[2] 最低杀真菌浓度(mfc)是通过从每管中取出0.1 ml的MIC肉汤大稀释系列中未见生长的培养基传代到无药SDA板上来测定的,如前所述。测定菌落计数,并根据每毫升菌落数减少的程度定义mfc,即MFC99表示每毫升最终接种量的菌落数减少99%,MFC95表示减少95%,MFC90表示减少90%。 |
| 动物实验 |
Mouse
To prepare ravuconazole, mix 10% DMSO with 0.5% CMC.For 48 hours, C. neoformans No. 3 is grown on an SDA plate at 30°C. Sterile saline is used to prepare the challenge organisms. The tail vein is the route of infection in mice (n = 5; p. 5). Oral administration of ravuconazole is initiated 1 hour after infection, twice a day for 5 days in a volume of 0.2 mL per dose. In 0.5% CMC, controls are given 10% DMSO. The dosages of ravuconazole are 8 and 32 mg/kg. Every day after the infection for 21 days, mortality is recorded. Determining the delay in mortality allows for the evaluation of drug efficacy. |
| 参考文献 |
|
| 其他信息 |
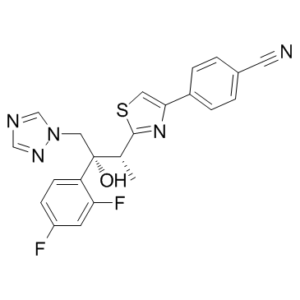
Ravuconazole is a member of the class of triazoles that is 1-butyl-1H-1,2,4-triazole in which the butyl group is substituted at positions 2, 2, and 3 by hydroxy, 2,4-difluorophenyl, and 4-(p-cyanophenyl)-1,3-thiazol-2-yl groups, respectively (the R,R stereoisomer). It exhibits antifungal activity by inhibition of 14alpha demethylase, an enzyme involved in sterol synthesis, resulting in lysis of the fungal cell wall and fungal cell death. (NCIO4) It has a role as an ergosterol biosynthesis inhibitor, an antifungal drug, an EC 1.14.14.154 (sterol 14alpha-demethylase) inhibitor and an antileishmanial agent. It is a member of triazoles, a member of fluorobenzenes, a tertiary alcohol, a member of 1,3-thiazoles and a nitrile.
Ravuconazole is a triazole with antifungal activity. Ravuconazole inhibits 14a demethylase, an enzyme involved in sterol synthesis, resulting in lysis of the fungal cell wall and fungal cell death. (NCI04) Drug Indication Investigated for use/treatment in fungal infections, aspergillosis, candidiasis, and onychomycosis. In this study, BMS and ITR were inhibitory at 1 μg/ml to all but one of the 16 strains of Aspergillus spp. Similarly, Hata et al. observed the consistent activity of BMS and ITR against Aspergillus spp. The antiaspergillus potencies of BMS and ITR are comparable. FLU was inactive against aspergilli. BMS and ITR were also fungicidal to 50 to 74% of the Aspergillus strains tested. The activities of BMS and ITR against other filamentous fungi are variable compared to FLU, which was inactive against most filamentous fungi. ITR and BMS were uniformly active against dermatophytes, while FLU was less active against Microsporum gypseum. Acremonium strictum, Paecilomyces variotii, and Penicillium sp. were susceptible to BMS and ITR. Though both ITR and BMS were active against most dematiaceous fungi, ITR appeared to be somewhat more active than BMS. BMS and ITR were less active against most strains of Pseudallescheria boydii, Sporothrix schenckii, and the zygomycetes, and both were generally inactive against Fusarium spp. Unlike Aspergillus spp., BMS and ITR were not fungicidal to the other filamentous fungi. In summary, BMS is a new triazole that is two- to fourfold more potent than ITR and up to 40-fold more active than FLU against many species of fungi. Its spectrum includes some yeast strains that are resistant to FLU. BMS is like ITR in that it is fungicidal to cryptococci and many strains of aspergilli. The in vitro profile of BMS warrants its development as a therapeutic agent in humans.[2] |
| 分子式 |
C22H17N5OF2S
|
|---|---|
| 分子量 |
437.46508
|
| 精确质量 |
437.112
|
| 元素分析 |
C, 60.40; H, 3.92; F, 8.69; N, 16.01; O, 3.66; S, 7.33
|
| CAS号 |
182760-06-1
|
| 相关CAS号 |
Ravuconazole-d4;1329499-27-5
|
| PubChem CID |
467825
|
| 外观&性状 |
Off-white to yellow solid powder
|
| 密度 |
1.4±0.1 g/cm3
|
| 沸点 |
674.9±65.0 °C at 760 mmHg
|
| 闪点 |
362.0±34.3 °C
|
| 蒸汽压 |
0.0±2.2 mmHg at 25°C
|
| 折射率 |
1.666
|
| LogP |
3.89
|
| tPSA |
115.86
|
| 氢键供体(HBD)数目 |
1
|
| 氢键受体(HBA)数目 |
8
|
| 可旋转键数目(RBC) |
6
|
| 重原子数目 |
31
|
| 分子复杂度/Complexity |
657
|
| 定义原子立体中心数目 |
2
|
| SMILES |
FC1=CC(F)=CC=C1[C@](CN2C=NC=N2)(O)[C@@H](C)C3=NC(C4=CC=C(C#N)C=C4)=CS3
|
| InChi Key |
OPAHEYNNJWPQPX-RCDICMHDSA-N
|
| InChi Code |
InChI=1S/C22H17F2N5OS/c1-14(21-28-20(10-31-21)16-4-2-15(9-25)3-5-16)22(30,11-29-13-26-12-27-29)18-7-6-17(23)8-19(18)24/h2-8,10,12-14,30H,11H2,1H3/t14-,22+/m0/s1
|
| 化学名 |
p-(2-((alphaR,betaR)-2,4-Difluoro-beta-hydroxy-alpha-methyl-beta-(1H-1,2,4-triazol-1-ylmethyl)phenethyl)-4-thiazolyl)benzonitrile
|
| 别名 |
BMS 207147; BMS207147; BMS-207147; 182760-06-1; Ravuconazole [INN]; Benzonitrile, 4-[2-[(1R,2R)-2-(2,4-difluorophenyl)-2-hydroxy-1-methyl-3-(1H-1,2,4-triazol-1-yl)propyl]-4-thiazolyl]-; ER-30346 ;ER 30346 ; ER30346.
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : ≥ 50 mg/mL (~114.29 mM)
|
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (5.71 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (5.71 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.5 mg/mL (5.71 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 配方 4 中的溶解度: 10% DMSO+40% PEG300+5% Tween-80+45% Saline: ≥ 2.5 mg/mL (5.71 mM) 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.2859 mL | 11.4294 mL | 22.8587 mL | |
| 5 mM | 0.4572 mL | 2.2859 mL | 4.5717 mL | |
| 10 mM | 0.2286 mL | 1.1429 mL | 2.2859 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。