| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| 1g |
|
||
| 2g |
|
||
| Other Sizes |
| 靶点 |
NF-κB; μ-opioid receptor
- Opioid μ-receptor (EC50 not specified, but activates the receptor in cell-based assays) [2] - NF-κB (inhibited via the IL-4/miR-324-5p/CUEDC2 axis, no specific IC50 reported) [1] - STAT3 (inhibited in glioma cells, no specific IC50 reported) [5] |
|---|---|
| 体外研究 (In Vitro) |
- 在人乳腺癌MDA-MB-231细胞中,青藤碱(Sinomenine)(10-100 μM)剂量依赖性抑制细胞侵袭和迁移(100 μM时抑制率达30-60%),通过抑制NF-κB激活实现,伴随miR-324-5p上调、CUEDC2下调及p-p65和MMP-9水平降低(Western blot检测)[1]
- 在转染阿片μ受体的HEK293细胞中,青藤碱(10-100 μM)增加[35S]GTPγS结合,表明激活μ受体,高浓度时 efficacy与吗啡相当[2] - 在人胶质瘤U87和U251细胞中,青藤碱(50-200 μM)抑制细胞活力(U87的IC50约100 μM),通过抑制STAT3磷酸化(Western blot)、减少cyclin D1表达实现;同时诱导活性氧(ROS)生成(DCFH-DA染色)并激活自噬(LC3-II/LC3-I比值升高及Beclin-1表达增加)[5][6] - 在神经病理性疼痛大鼠的原代小胶质细胞中,青藤碱(10-50 μM)减少LPS诱导的TNF-α和IL-1β分泌(ELISA检测),显示抗炎作用[3] 随着青藤碱浓度的增加,细胞活力逐渐降低。 0.25、0.5和1 mM青藤碱处理后MDA-MB-231细胞的迁移能力显着减弱。伤口愈合试验表明,0.25 和 0.5 mM 青藤碱显着抑制伤口愈合。当MDA-MB-231细胞用0.5 mM青藤碱处理时,愈合进度约为50%,但在用0.25 mM青藤碱处理的组和未处理的对照组中,愈合进度分别约为80%和接近95%。 NF-κB 抑制剂 (IκB) 抗体 IP 后的 IB 测定显示,青藤碱治疗以剂量依赖性方式抑制 NF-κB 与 IκB 的结合[1]。 |
| 体内研究 (In Vivo) |
- 在慢性压迫性损伤(CCI)诱导的神经病理性疼痛大鼠中,青藤碱(10-40 mg/kg,腹腔注射,每日1次,连续7天)剂量依赖性提高von Frey实验中的爪退缩阈值(PWT)和热板实验中的爪退缩潜伏期(PWL),40 mg/kg时效果最显著(PWT:12.5 ± 1.8 g vs 对照组3.2 ± 0.5 g)[4]
- 在完全弗氏佐剂(CFA)诱导的炎症痛小鼠中,青藤碱(20-80 mg/kg,灌胃)减轻热痛觉过敏,该效应可被阿片μ受体拮抗剂纳洛酮逆转,证实其镇痛作用依赖阿片通路[3] - 在荷U87胶质瘤异种移植的裸鼠中,盐酸青藤碱(50 mg/kg,腹腔注射,隔日1次,连续21天)减少肿瘤体积(356 ± 42 mm³ vs 对照组689 ± 57 mm³)和重量,伴随肿瘤组织中p-STAT3表达降低及LC3-II积累增加[6] 青藤碱 (ip) 在雄性大鼠的热板和甩尾试验中以 40 mg/kg 剂量产生镇痛作用,但在较低剂量(10 或 20 mg/kg)时则不产生镇痛作用。 10 至 40 mg/kg 的青藤碱不会产生任何可观察到的副作用,如镇静、过敏或运动障碍。 80 mg/kg 的青藤碱对大鼠有轻度镇静作用。在甩尾试验中,小鼠在腹腔注射 80 mg/kg 青藤碱 60 分钟后也观察到镇痛作用,但在较低剂量(20 或 40 mg/kg)时则没有。腹膜内注射 80 mg/kg 青藤碱不会对小鼠产生任何可观察到的副作用。腹腔注射或口服青藤碱 40 或 80 mg/kg 剂量依赖性地降低神经损伤小鼠的机械超敏反应。腹腔注射青藤碱 40 mg/kg,但不是较低剂量或媒介物,可显着减轻机械性和冷异常性疼痛长达 240 分钟,而不产生运动缺陷或镇静作用[3]。在 10 至 40 mg/kg 的剂量下,青藤碱剂量依赖性地增加缩爪阈值。在非慢性压迫性损伤(CCI)健康大鼠中,10至40 mg/kg剂量范围的青藤碱不会改变强迫游泳试验中的不动行为[4]。 |
| 酶活实验 |
- 阿片μ受体结合实验:转染人μ阿片受体的HEK293细胞膜与[3H]-二丙诺啡(0.5 nM)及青藤碱(10-9-10-4 M)在25°C孵育60分钟。用10 μM纳洛酮定义非特异性结合,通过过滤分离结合配体,测定放射性。青藤碱可置换[3H]-二丙诺啡,显示与μ受体的中等亲和力[2]
- NF-κB活性实验:MDA-MB-231细胞转染NF-κB-荧光素酶报告质粒后,经青藤碱(50 μM)和IL-4(10 ng/mL)处理,检测荧光素酶活性。青藤碱使IL-4诱导的荧光素酶活性降低58%,表明抑制NF-κB活性[1] |
| 细胞实验 |
- 乳腺癌侵袭实验:MDA-MB-231细胞接种于Matrigel包被的Transwell上室,含青藤碱(10-100 μM)的无血清培养基培养24小时。固定染色后计数侵袭细胞,100 μM时侵袭率降低62%[1]
- 胶质瘤自噬实验:U87细胞经青藤碱(50-200 μM)处理24小时,通过LC3免疫荧光染色观察自噬体;Western blot显示LC3-II/LC3-I比值(100 μM时达2.8倍)和Beclin-1表达增加,证实自噬激活[6] - 小胶质细胞细胞因子实验:大鼠原代小胶质细胞经青藤碱(10-50 μM)预处理1小时,再用LPS(1 μg/mL)刺激24小时。ELISA检测上清中TNF-α和IL-1β水平,50 μM时分泌量减少40-60%[3] 本研究使用 MDA-MB-231 人类三阴性乳腺癌细胞系和 4T1 小鼠乳腺癌细胞系。对于实验,细胞以 3.5×104/孔在 24 孔板中生长。在含有不同浓度青藤碱的培养基中孵育24或48小时后,根据制造商的说明使用Cell Counting Kit-8溶液检测细胞的增殖情况[1]。 |
| 动物实验 |
In this experiment, male Sprague-Dawley rats weighing between 250 and 300 g are employed. Different doses of Sinomenine (10 to 40 mg/kg) are given 1 day after surgery, and the paw withdrawal threshold is then measured every 30 minutes for 4 hours to determine the duration of action of the acute Sinomenine study. Three hours after the daily drug treatment in the study involving Sinomenine, a mechanical hyperalgesia test is conducted. In studies involving antagonists, antagonists were administered 10 min before 40 mg/kg Sinomenine administration[3].
- Neuropathic pain model (CCI): Male rats underwent sciatic nerve ligation. From day 7 post-surgery, sinomenine (10-40 mg/kg) was administered intraperitoneally once daily. PWT (von Frey filaments) and PWL (hot plate, 52°C) were measured on days 7, 10, 14 [4] - Glioma xenograft model: Nude mice were subcutaneously injected with U87 cells (1×10⁶). When tumors reached 100 mm³, sinomenine hydrochloride (50 mg/kg) or vehicle (saline) was injected intraperitoneally every other day. Tumor volume was measured twice weekly, and mice were euthanized on day 21 for tissue analysis [6] - Inflammatory pain model: Mice received CFA (20 μL, intraplantar) on day 0. Sinomenine (20-80 mg/kg) was administered orally on days 1-7. Thermal hyperalgesia was assessed using a radiant heat source, measuring paw withdrawal time [3] |
| 毒性/毒理 (Toxicokinetics/TK) |
5459308 mouse LD50 oral 580 mg/kg BEHAVIORAL: SOMNOLENCE (GENERAL DEPRESSED ACTIVITY); BEHAVIORAL: CONVULSIONS OR EFFECT ON SEIZURE THRESHOLD Yaoxue Xuebao. Acta Pharmaceutica Sinica. Pharmaceutical Journal., 10(673), 1963 [PMID:14097213]
5459308 mouse LD50 intraperitoneal 285 mg/kg BEHAVIORAL: CONVULSIONS OR EFFECT ON SEIZURE THRESHOLD; LUNGS, THORAX, OR RESPIRATION: RESPIRATORY DEPRESSION Yaoxue Xuebao. Acta Pharmaceutica Sinica. Pharmaceutical Journal., 8(177), 1960 |
| 参考文献 |
|
| 其他信息 |
Sinomenine is a morphinane alkaloid.
Sinomenine has been reported in Stephania cephalantha, Sinomenium acutum, and other organisms with data available. Sinomenine is an alkaloid isolated from the root of Sinomenium acutum with immunomodulatory and potential anti-angiogenic and activities. Although the mechanism of action remains to be fully elucidated, sinomenine appears to inhibit endothelial proliferation mediated through basic fibroblast growth factor (bFGF), which may contribute to its anti-angiogenic effect. In Chinese medicine, this agent has a long track-record in treating arthritis, which is accounted by its ability to inhibit proliferation of synovial fibroblasts and lymphocytes. In addition, sinomenine has been shown to suppress expressions of genes involved in inflammation and apoptosis, such as interleukin-6, a pleiotropic inflammatory cytokine and JAK3 (Janus kinase 3), Daxx (death-associated protein 6), plus HSP27 (heat shock 27kDa protein 1), respectively. - Sinomenine is an alkaloid isolated from the Chinese herb Sinomenium acutum, traditionally used for anti-inflammatory and analgesic effects [3][4] - Its mechanisms include μ-opioid receptor activation (analgesia), NF-κB inhibition (anti-invasion in breast cancer), STAT3 suppression, and ROS-mediated autophagy induction (glioma growth inhibition) [1][2][5][6] - The hydrochloride salt (sinomenine hydrochloride) shows improved water solubility and is used in in vivo studies for better bioavailability [6] |
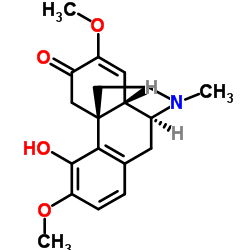
| 分子式 |
C19H23NO4
|
|---|---|
| 分子量 |
329.3902
|
| 精确质量 |
329.162
|
| 元素分析 |
C, 69.28; H, 7.04; N, 4.25; O, 19.43
|
| CAS号 |
115-53-7
|
| 相关CAS号 |
Sinomenine hydrochloride;6080-33-7
|
| PubChem CID |
5459308
|
| 外观&性状 |
White to off-white solid powder
|
| 密度 |
1.3±0.1 g/cm3
|
| 沸点 |
513.6±50.0 °C at 760 mmHg
|
| 熔点 |
180ºC
|
| 闪点 |
264.4±30.1 °C
|
| 蒸汽压 |
0.0±1.4 mmHg at 25°C
|
| 折射率 |
1.625
|
| LogP |
1.25
|
| tPSA |
59
|
| 氢键供体(HBD)数目 |
1
|
| 氢键受体(HBA)数目 |
5
|
| 可旋转键数目(RBC) |
2
|
| 重原子数目 |
24
|
| 分子复杂度/Complexity |
562
|
| 定义原子立体中心数目 |
3
|
| SMILES |
O(C([H])([H])[H])C1C(C([H])([H])[C@@]23C4C(=C(C([H])=C([H])C=4C([H])([H])[C@@]([H])([C@@]2([H])C=1[H])N(C([H])([H])[H])C([H])([H])C3([H])[H])OC([H])([H])[H])O[H])=O
|
| InChi Key |
INYYVPJSBIVGPH-QHRIQVFBSA-N
|
| InChi Code |
InChI=1S/C19H23NO4/c1-20-7-6-19-10-14(21)16(24-3)9-12(19)13(20)8-11-4-5-15(23-2)18(22)17(11)19/h4-5,9,12-13,22H,6-8,10H2,1-3H3/t12-,13+,19-/m1/s1
|
| 化学名 |
(1R,9S,10S)-3-hydroxy-4,12-dimethoxy-17-methyl-17-azatetracyclo[7.5.3.01,10.02,7]heptadeca-2(7),3,5,11-tetraen-13-one
|
| 别名 |
Sinomenine; Kukoline; Coculine; Sinomenine; 115-53-7; Kukoline; Cucoline; Coculine; Sabianine A; morphinan-6-one, 7,8-didehydro-4-hydroxy-3,7-dimethoxy-17-methyl-, (9alpha,13alpha,14alpha)-; 63LT81K70N; Cucoline
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 本产品在运输和储存过程中需避光。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO: ~65 mg/mL (~197.3 mM)
Ethanol: ~65 mg/mL (~197.3 mM) 1M HCl (aqueous): 25 mg/mL (76.0 mM) |
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (7.59 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (7.59 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.5 mg/mL (7.59 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 3.0359 mL | 15.1796 mL | 30.3591 mL | |
| 5 mM | 0.6072 mL | 3.0359 mL | 6.0718 mL | |
| 10 mM | 0.3036 mL | 1.5180 mL | 3.0359 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
| NCT Number | Recruitment | interventions | Conditions | Sponsor/Collaborators | Start Date | Phases |
| NCT05764304 | Not yet recruiting | Drug: Sinomenine Drug: Glucocorticoid |
Knee Osteoarthritis | Shanghai 6th People's Hospital | February 28, 2023 | Phase 3 |
| NCT00409071 | Completed | Drug: Cocculine® Drug: placebo |
Breast Cancer | Centre Leon Berard | September 2005 | Phase 3 |
|
|
|
|
|