| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| Other Sizes |
|
| 靶点 |
MOR ( EC50 = 97 nM )
|
||
|---|---|---|---|
| 体外研究 (In Vitro) |
体外活性:SR17018 是一种 µ-阿片受体 (MOR) 激动剂,与 GTPγS 结合,EC50 为 97 nM。 SR17018 在低于 10 μM 时对诱导 βarrestin2 募集至 MOR 没有明显影响。 SR17018 通过 G 蛋白或 βarrestin2 促进信号传导。激酶测定:为了确定 βarrestin2 招募到人 MOR 的情况,使用了商业酶片段互补测定(β-半乳糖苷酶)。 16-20 小时前,将 U2OS-βarrestin-hMOR PathHunter 细胞以每孔 5,000 个细胞的密度接种在 384 孔白壁测定微孔板 (Greiner Bio-One) 中的 Assay Complete Cell Placing 5 Reagent (DiscoveRx) 中。测量信号。在 37°C 下,用浓度逐渐增加的测试化合物处理细胞 90 分钟,并使用 PathHunter 检测试剂盒和 β-半乳糖苷酶底物测定 βarrestin2 的募集情况,以检测功能性 β-半乳糖苷。使用 SpectraMax M5e 酶标仪 (Molecular Devices) 测量由此产生的发光增加。 PathHunter U2OS OPRM1 βarrestin 细胞的平均载体为 446 ± 25 RLU,DAMGO 的平均载体倍数为 36 ± 1。 细胞测定:CHO-hMOR、-hDOR 和 -hKOR 细胞以每 4,000 个细胞的密度进行铺板。测定前 4 小时,将 384 孔、白壁、30 μl 体积微孔板 (Greiner Bio-One) 的孔置于含有 1% FBS 的 Opti-MEM 中。将细胞用 20 μM 毛喉素、25 μM 4-(3-丁氧基-4-甲氧基苯甲基)咪唑烷-2-酮 (Ro-20-1724) 和浓度不断增加的测试化合物在 25°C 下处理 30 分钟。然后使用 Cisbio (Cisbio-62AM6PEC) 的均质时间分辨荧光共振能量转移 (FRET) cAMP HiRange 测定法测定 cAMP 的抑制。使用 Envision Multilabel Reader (PerkinElmer) 在 620 和 665 nm 处测量荧光。 FRET 通过 665 nm / 620 nm 的比率计算。 CHO-hMOR 细胞的平均载体比率为 3134 ± 99,DAMGO 的平均载体倍数为 2.2 ± 0.04。 CHO-hDOR 细胞的平均载体比率为 2962 ± 181,SNC80 的平均载体倍数为 1.6 ± 0.04。 CHO-hKOR 细胞的平均载体比率为 2965 ± 153,U69,593 的平均载体倍数为 1.9 ± 0.12。
|
||
| 体内研究 (In Vivo) |
通过腹膜内给药测定 C57BL/6J 小鼠的药代动力学参数。通过标准离心技术产生血浆,产生约 10 μL 血浆并立即冷冻。为了收集大脑,通过颈脱位处死小鼠,分离大脑并在液氮中快速冷冻。使用LC(岛津)串联质谱仪(AB Sciex)使用多反应监测方法以正离子模式操作来测定药物水平(Brust等人,2016)。使用快速平衡透析 (RED) 装置 (ThermoFisher) 测定芬太尼和吗啡的血浆蛋白结合。对于 SR 化合物,制备血浆样品(0.5 mL,0.5 μM 测试化合物)并将 900 μL 转移至 2 mL 聚碳酸酯超速离心管中。使用 Beckman Coulter Optima Max 超速离心机(最大 130,000 RPM)将样品以 400,000 xg 离心两小时,TLA 120.2 转子保持在 25°C。离心后的样品分为三层。富含蛋白质的底层含有大部分白蛋白,并且很容易可视化。顶层不易辨别,但含有高浓度的脂蛋白。中间层(使用所述条件下表面以下 1-2 毫米)具有非常低的蛋白质浓度,可用于确定未结合药物的量。通过 LC-MS/MS 通过比较离心样品中层的化合物浓度与未进行离心的平行样品的浓度来确定未结合化合物的百分比。
|
||
| 酶活实验 |
利用商业酶片段互补测定(β-半乳糖苷酶)来确定 βarrestin2 招募到人 MOR 中。在测量信号之前,将 U2OS-βarrestin-hMOR PathHunter 细胞以每孔 5,000 个细胞的密度置于 384 孔白壁测定微孔板 (Greiner Bio-One) 中的 Assay Complete Cell Placing 5 Reagent (DiscoveRx) 中提前 16-20 小时。在 37°C 下用浓度递增的测试化合物处理细胞 90 分钟后,使用 PathHunter 检测试剂盒和 β-半乳糖苷酶底物评估 βarrestin2 募集情况,以检测功能性 β-半乳糖苷。使用 SpectraMax M5e 酶标仪(Molecular Devices)测量由此产生的发光增加。对于 PathHunter U2OS OPRM1 β 抑制蛋白细胞,平均载体为 446 ± 25 RLU,而 DAMGO 的平均载体倍数为 36 ± 1。
饱和和竞争放射性配体结合[1] 如前所述(Groer等人,2011;Schmid等人,2013),对CHO-hMOR、CHO-hDOR和CHO-hKOR细胞系进行了受体结合测定。将细胞在血清中饥饿30分钟,收集细胞,用特氟纶在玻璃上匀浆,在含有(50 mM Tris-HCl,pH 7.4,100 mM NaCl,1 mM EDTA)的膜缓冲液中制备膜丸,然后在4°C下以20000 x g离心30分钟。将膜重新悬浮在测定缓冲液(10 mM Tris-HCl,pH 7.4,100 mM NaCl)中。在25°C下,用适当的放射性配体(MOR,3H-DAMGO;KOR,3H-U69593;DOR,3H-二丙诺啡)在10μg膜上进行结合反应(200μl体积)2小时。对于竞争实验,每种放射性配体的浓度约为1 nM(0.96-1.10 nM 3H-DAMGO;1.06-1.19 nM 3H-U69593;0.92-0.98 nM ~3H-二丙诺啡)。在10μM DAMGO(MOR)、10μM U69593(KOR)或10μM纳洛酮(DOR)存在下测定非特异性结合。通过在Brandel细胞采集器上用GF/B玻璃纤维滤板过滤来终止反应,该滤板已与0.1%聚乙烯亚胺预孵育。在TopCount NXT闪烁计数器上用Microscint计数放射性。饱和结合分析和特异性结合的双曲线拟合用于确定CHO细胞系的放射性配体结合亲和力和受体数量(hMOR,3H-DAMGO为1.02±0.10 nM,1.58±0.11 pmol/mg;hDOR,0.70±0.11 nM[3H]-二丙诺啡和1.46±0.26 pmol/mg;hKOR,1.07±0.01 nM[3H]-U69593和0.71±0.12 pmol/mg])。 35S-GTPγS与膜结合[1] 如前所述(Schmid等人,2013),在从成年雄性C57BL/6J和MOR-KO小鼠分离的CHO hMOR和CHO mMOR细胞和脑干制备的膜中测定了35S-GTPγS结合。CHO-hMOR和CHO-mMOR细胞膜,如上所述用GTPγS结合膜缓冲液(10 mM Tris-HCl,pH 7.4,100 mM NaCl,1 mM EDTA)收集和制备。在25°C下,在悬浮在含有50μM鸟苷-5“-二磷酸(GDP)和0.1 nM 35S-GTPγS的测定缓冲液(50 mM Tris-Cl,pH 7.4,100 mM NaCl,5 mM MgCl2,1 mM EDTA)中的10μg膜上进行反应(200μl体积)1小时。通过GF/B滤板过滤终止反应,并如上所述计算放射性。对于分离自C57BL/6J和MOR-KO小鼠的脑干上的[35S]-GTPγS结合,用多电子组织撕裂机均质化组织,并如上所述制备膜。在收获前,将含有2.5μg蛋白质、1 mM二硫苏糖醇(DTT)、20μM GPD和0.1 nM 35S-GTPγS的结合反应在室温下孵育2小时。CHO hMOR膜的平均载体值为786±78cpm,DAMGO的平均折叠载体值为4.6±0.26。CHO mMOR细胞膜的平均载体值为694±28 cpm,DAMGO的平均折叠载体值为5.9±0.57。C57BL/6J脑干膜的平均载体为657±62 cpm,DAMGO的平均折叠载体为1.9±0.03。MOR-KO脑干膜的平均载体为1647±507cpm。 β受体阻滞2招募试验[1] 为了确定βarresti2对人MOR的募集,使用了商业酶片段互补分析(β-半乳糖苷酶)。在测量信号前16-20小时,将U2OS-βarrestin-hMOR PathHunter®细胞以每孔5000个细胞的密度铺在384孔、白壁的测定微孔板上的测定全细胞板5试剂中。在37°C下用浓度递增的测试化合物处理细胞90分钟,并使用带有β-半乳糖苷酶底物的PathHunter®检测试剂盒测定βarresti2的募集,以检测功能性β-半乳糖。使用SpectraMax M5e微孔板读数器测量由此产生的发光增加。PathHunter U2OS OPRM1βarresten细胞的平均载体为446±25 RLU,DAMGO的平均折叠载体为36±1。 为了确定βarresti2对mMOR的募集,使用了基于成像的检测方法(Zhou等人,2013)。在分析前16-20小时,将U2OS-βarrestein2-GFP-mOR细胞以每孔5000个细胞的密度铺在384孔、黑壁、透明底部光学成像微孔板(Brooks)的正常培养基中。细胞被血清饥饿1小时,然后在37°C下用越来越高浓度的测试化合物处理20分钟。用含4%多聚甲醛(PFA)的Hoechst核染色剂以1:1000的稀释度固定细胞。在CellInsight CX5高含量筛查平台上使用20X物镜测量βArrestin 2易位。使用Cellomics的斑点检测生物应用对Puncte(归一化为赫斯特染色)进行定量。载体处理的U2OS-βarrestiin2-GFP-mMOR细胞的平均泪点/赫斯特比为2.2±0.54,DAMGO的平均载体倍数为61±13。 为了确定化合物是否具有NOP活性,在U2OS-Ango-hOPRL1-bla细胞中测定了βarresti2对受体的募集。在测定前16-20小时,将U2OS-Ango-hOPRL1-bla细胞以每孔10000个细胞的密度铺在384孔、黑壁、透明底部的测定板上,置于32μl的测定介质(DMEM+10%透析FBS、0.1 mM NEAA、25 mM HEPES和1%笔/链球菌)中。在37°C下用浓度逐渐增加的试验化合物处理细胞5小时。根据制造商的方案,使用LiveBLAzer FRET B/G装载试剂盒和溶液D测定NOP活化。使用SpectraMax M5e微孔板阅读器测量FRET信号(激发409nm,发射460nm和530nm)。经460/530比值载体处理的U2OS-Ango-hOPRL1-bla细胞的平均值为0.31±0.03,伤害性感受肽的平均倍数载体为7.6±0.68。 |
||
| 细胞实验 |
cAMP accumumlation assay [1]
将 CHO-hMOR、-hDOR 和 -hKOR 细胞以每孔 4,000 个细胞的密度接种在 384 孔、白壁、30 μl 体积微孔板(Greiner Bio-One)中含有 1% FBS 的 Opti-MEM 中。 ) 测定前四小时。将 20 μM 毛喉素、25 μM 4-(3-丁氧基-4-甲氧基苯甲基)咪唑烷-2-酮 (Ro-20-1724) 和浓度逐渐升高的测试化合物应用于细胞,在 25°C 下持续 30 分钟。接下来,我们使用Cisbio的均质时间分辨荧光共振能量转移(FRET)cAMP HiRange测定(Cisbio-62AM6PEC)来测量cAMP的抑制作用。使用 PerkinElmer Envision Multilabel Reader 测量 620 和 665 nm 处的荧光。 FRET 的计算公式为 665 nm / 620 nm。对于 CHO-hMOR 细胞,平均媒介物比率为 3134 ± 99,而对于 DAMGO,平均媒介物倍数为 2.2 ± 0.04。对于 CHO-hDOR 细胞,平均载体比率为 2962 ± 181,对于 SNC80,平均载体倍数为 1.6 ± 0.04。对于 CHO-hKOR 细胞,平均媒介物比率为 2965 ± 153,对于 U69,593,平均媒介物倍数为 1.9 ± 0.12。 |
||
| 动物实验 |
|
||
| 参考文献 | |||
| 其他信息 |
Biased agonism has been proposed as a means to separate desirable and adverse drug responses downstream of G protein-coupled receptor (GPCR) targets. Herein, we describe structural features of a series of mu-opioid-receptor (MOR)-selective agonists that preferentially activate receptors to couple to G proteins or to recruit βarrestin proteins. By comparing relative bias for MOR-mediated signaling in each pathway, we demonstrate a strong correlation between the respiratory suppression/antinociception therapeutic window in a series of compounds spanning a wide range of signaling bias. We find that βarrestin-biased compounds, such as fentanyl, are more likely to induce respiratory suppression at weak analgesic doses, while G protein signaling bias broadens the therapeutic window, allowing for antinociception in the absence of respiratory suppression.[1]
With these limitations in mind, this study still remains the first of its kind to systematically assess a chemical series of agonists for bias across multiple signaling assays and to also perform thorough analyses of behavioral responses in a dose dependent manner. The demonstration of a correlation between the bias observed to the width of the therapeutic window is highly encouraging for using these signaling assays to predict favorable outcomes in the mouse models used here. Moreover, we have demonstrated that key regions of the chemical scaffold can be mindfully modified to direct signaling between the different assays in cell culture and that this recapitulates as differences in potencies in vivo. Finally, this study introduces a new series of G protein signaling biased MOR agonists that have the highest degree of separation between respiratory suppression and antinociception in rodent models reported to date. Our hope is that this work may aid the pharmaceutical development of safer alternatives to current opioid therapeutics.[1] |
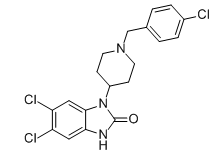
| 分子式 |
C₁₉H₁₈CL₃N₃O
|
|
|---|---|---|
| 分子量 |
410.72
|
|
| 精确质量 |
409.05
|
|
| 元素分析 |
C, 55.56; H, 4.42; Cl, 25.89; N, 10.23; O, 3.90
|
|
| CAS号 |
2134602-45-0
|
|
| 相关CAS号 |
|
|
| PubChem CID |
130431397
|
|
| 外观&性状 |
White to off-white solid powder
|
|
| LogP |
4.7
|
|
| tPSA |
35.6
|
|
| 氢键供体(HBD)数目 |
1
|
|
| 氢键受体(HBA)数目 |
2
|
|
| 可旋转键数目(RBC) |
3
|
|
| 重原子数目 |
26
|
|
| 分子复杂度/Complexity |
506
|
|
| 定义原子立体中心数目 |
0
|
|
| InChi Key |
LAGUDYUGRSQDKS-UHFFFAOYSA-N
|
|
| InChi Code |
InChI=1S/C19H18Cl3N3O/c20-13-3-1-12(2-4-13)11-24-7-5-14(6-8-24)25-18-10-16(22)15(21)9-17(18)23-19(25)26/h1-4,9-10,14H,5-8,11H2,(H,23,26)
|
|
| 化学名 |
5,6-dichloro-3-[1-[(4-chlorophenyl)methyl]piperidin-4-yl]-1H-benzimidazol-2-one
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 1.25 mg/mL (3.04 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 12.5 mg/mL澄清的DMSO储备液加入到400 μL PEG300中,混匀;再向上述溶液中加入50 μL Tween-80,混匀;然后加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 1.25 mg/mL (3.04 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 12.5 mg/mL 澄清 DMSO 储备液加入到 900 μL 玉米油中并混合均匀。 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.4347 mL | 12.1737 mL | 24.3475 mL | |
| 5 mM | 0.4869 mL | 2.4347 mL | 4.8695 mL | |
| 10 mM | 0.2435 mL | 1.2174 mL | 2.4347 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
Functional Effects of MOR Agonists at the Human DOR, KOR, and NOP. |
|---|
SR Compounds Are Potent Activators of GTPγS Binding but Have Differential βARRESTIN2 Signaling Profiles at the Human MOR. |
GTPγS Binding at Mouse MOR Expressed in CHO Cells and Mouse Brainstem Compared to βArrestin2 Recruitment to Mouse MOR. |
SR Agonists Cross the Blood Brain Barrier and Are Present in Plasma 6 hr after Injection. |
|---|
Agonists That Displayed G Protein-Signaling Bias in the Cell-Based Assays Promote Antincocicpetion with Less Respiratory Suppression. |
Dose Response for the Fentanyl, Morphine, and the SR Compounds in the Antinociception and Respiratory Assays and Efficacy in Female Mice. |