| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| Other Sizes |
| 靶点 |
Cationic fluorescent dye
|
|---|---|
| 体外研究 (In Vitro) |
TMRE 实验操作流程
1. TMRE 溶液配制 1.1 母液配制 将 1mg TMRE 溶解于 DMSO 溶剂中,配制成 5mM 浓度的储存液。 1.2 工作液配制 使用无血清细胞培养基或 PBS 缓冲液稀释母液,配制 1-20 μM 浓度范围的工作液。 注意事项:工作液浓度需根据具体实验需求进行调整。 2. 细胞染色步骤 2.1 悬浮细胞处理(6孔板培养) a. 细胞处理:1000g 4℃离心 3-5 分钟,去除上清液。用 PBS 洗涤两次,每次 5 分钟。调整细胞密度至 1×10⁶/mL。 b. 染色:加入 1mL 工作液,室温孵育 5-30 分钟。 c. 离心:400g 4℃离心 3-4 分钟,去除上清液。 d. 洗涤:PBS 洗涤两次,每次 5 分钟。 e. 检测准备:用无血清培养基或 PBS 重悬细胞,进行荧光显微镜或流式细胞仪观察。 2.2 贴壁细胞处理 a. 细胞培养:在无菌盖玻片上培养贴壁细胞。 b. 预处理:取出盖玻片,吸除多余培养基。 c. 染色:加入 100μL 工作液,轻轻摇晃确保完全覆盖细胞,室温孵育 30-60 分钟。 d. 洗涤:用培养基洗涤两次,每次 5 分钟。 e. 检测:直接进行荧光显微镜观察或流式细胞仪检测。 特殊说明:流式细胞仪检测时,需先将细胞重悬后再进行染色处理。 |
| 酶活实验 |
共聚焦显微镜和三维重建
[2]
为了研究线粒体运动,使用了线粒体特异性荧光染料四甲基罗丹明乙酯(TMRE)。TMRE是一种亲脂性、细胞渗透性、阳离子、无毒的荧光染料,可特异性染色活线粒体。TMRE是线粒体根据膜电位的比例特异性积累的。通过在室温下将镜片浸泡在含有5μg/ml TMRE的10 ml无血清M199中15分钟,整个镜片都装有TMRE。然后,如前所述,将透镜安装在玻璃底板上的1%琼脂糖中。用装有倒置Axiovert 200M显微镜和40x水浸C-Apochromat物镜(NA 1.2)的蔡司510(配置Meta 18)共聚焦激光扫描显微镜获取晶状体上皮和浅皮层纤维细胞的时间序列和z堆叠。488nm氩激光器和505长通发射滤光片的组合用于可视化TMRE荧光。随后的图像恢复和分析(如线粒体长度和运动速率)使用商业LSM510 VisArt和Physiology软件包(3.2版;Carl Zeiss股份有限公司,耶拿,德国)进行。使用软件的测量功能测量线粒体从最可见结构的一端到另一端的代表性长度。通过观察时间序列第一个X、Y通道中运动线粒体的初始位置(零位),以及通过测量微米(μm)长度在时间序列中观察到的最终运动,来确定运动速率(以μm/sec表示)。 |
| 细胞实验 |
结果[2]
晶状体上皮细胞和皮质浅层纤维细胞之间线粒体的形态和分布非常不同。在上皮细胞中,可以看到高达10μm密集的核周线粒体,类似于相互连接的网络(图1A)。这些致密的线粒体似乎充满了晶状体上皮细胞的整个体积(图2)。在浅层皮层中,线粒体密度较低(图1B),更细长(高达65μm),明显分离,并且经常分支(图3)。 在上皮细胞中观察到TMRE的动态多向运动,在皮质浅层纤维细胞中看到双向运动。在上皮中,TMRE荧光的运动高达5μm/min(图4),而在浅层皮层中,观察到的运动高至18.5μm/min(见图5)。用电子传递链电位的解偶联剂CCCP处理后,晶状体上皮(图6)和浅层皮层(图7)的TMRE荧光运动被消除。 讨论[2] 脊椎动物晶状体是一种细胞结构,由两种以不同空间模式组织的细胞组成;覆盖前表面的上皮单层和构成晶状体主体的纤维细胞。晶状体中的细胞分裂仅限于上皮细胞。该单层可分为三个隔室,与晶状体解剖和细胞分裂率有关。晶状体前缝合区域上方的中央上皮细胞通常很少或没有有丝分裂。位于中间的上皮细胞经历有限的有丝分裂,而晶状体赤道处的上皮细胞显示出最快的有丝分化速率。这些赤道上皮细胞在整个生命过程中产生终末分化的纤维细胞,导致组织体积稳步增加。 在不同类型的细胞中观察到线粒体的形态和分布高度可变。在生长中的细胞中,线粒体经常被发现是一种极其动态的结构,管状部分分裂成两半,分支并融合形成一个复杂的网络。在分化的细胞中,如心肌或肾小管,线粒体通常位于特定的细胞质区域,而不是随机分布[17]。在这项研究中,晶状体上皮的三维重建表明线粒体可能形成一个类似于其他哺乳动物细胞的复杂网络(图2)。与晶状体上皮相比,表层皮质纤维细胞的线粒体密度较低,明显分离,且经常分支(图3和图5)。尽管两种细胞类型之间存在这种差异,但不同物种(包括鱼类和哺乳动物)的晶状体在形态或分布上没有明显差异。线粒体在终末分化的浅表皮质纤维细胞中的随机分布(图1B、图3和图5)也与其他分化细胞(如心肌或肾小管)中更为局部的分布形成鲜明对比。 使用共聚焦激光扫描显微镜对用线粒体特异性染料四甲基罗丹明乙酯(TMRE)染色的切除的牛晶状体进行观察,本研究首次显示了TMRE在晶状体上皮细胞和浅表皮层中的动态运动。 线粒体的一般观察可以追溯到十九世纪中叶。观察到的结构通常被称为颗粒,1898年,德国微生物学家卡尔·本达从希腊语的线粒体“线”和khondrion“小颗粒”中创造了“线粒体”这个名字。在活细胞中,线粒体是动态结构,不断移动和改变其大小和形状。文献中报道的线粒体动力学的早期观察之一可以追溯到1915年,当时Lewis和Lewis使用培养的胚胎鸡细胞和光学显微镜报告了活细胞中线粒体的运动。这些观察结果支持了线粒体与细菌有关的说法,预示着线粒体起源于在真核细胞细胞质中共生建立的原核细胞的内共生理论得到了广泛接受。线粒体分布和运动机制的早期线索来自对细胞骨架的研究。显微镜分析显示线粒体与某些细胞骨架成分共定位。特别是,许多研究记录了线粒体与微管在不同细胞类型中的共定位,包括哺乳动物神经元、培养的成纤维细胞和原生动物卡氏棘阿米巴。观察到线粒体在用分解微管网络的试剂处理的培养哺乳动物细胞中重新分布,这进一步支持了微管的参与。此外,编码微管蛋白(微管的构建块)的基因中的某些条件突变对微管的破坏导致粟酒酵母线粒体分布异常,这提供了遗传证据,表明微管在该生物体中定位线粒体。鉴定微管上细胞器运动的分子基础的一个关键进展是发现了基于微管的运动蛋白、驱动蛋白和细胞质动力蛋白。这些蛋白质似乎能结合微管,并将化学能(ATP)转化为机械功,为线粒体沿微管的极化运动提供动力。这两种蛋白质都可以结合和运输囊泡、细胞器或其他蛋白质形式的“货物”,线粒体似乎是最受欢迎的货物之一。特别是,驱动蛋白超家族的几个不同成员优先定位于动物细胞中的线粒体。最近对大鼠晶状体的一项研究表明,在伸长的纤维细胞中存在一种基于微管的运动系统,该系统同时含有驱动蛋白和动力蛋白。该系统的存在归因于在伴随次生纤维细胞伸长的细胞生长增加期间,重要的膜蛋白和细胞器被运输到靶区域。大量微管有规律地排列成平行于纤维细胞长轴的束,这一形态学观察与表层皮质纤维细胞中线粒体的分布相似(图1B),可能代表了导致观察到的细胞器快速运动的机制。 观察到的TMRE荧光运动的动态可能代表了实际的线粒体运动,表明晶状体上皮和浅层皮层中线粒体的动态状态。这种活性不仅存在于上皮细胞中,也存在于浅层皮层中,这表明浅层皮层纤维细胞在晶状体代谢中的作用比以前怀疑的要积极得多。或者,观察到的TMRE在线粒体网络中的运动可能代表内膜电位分布的变化,可能允许能量从ATP需求低的区域传递到ATP需求高的区域。 总之,本报告描述了关于晶状体线粒体动态特性的新观察结果。进一步的研究将探讨线粒体动力学与基于微管的运动系统之间的关系。此外,CCCP对线粒体动力学的影响表明,这种方法可能有助于评估晶状体的完整性。 目的:最近对脊椎动物晶状体线粒体的共聚焦激光扫描显微镜研究表明,晶状体上皮细胞和表层皮质细胞线粒体的分布和形态存在显著差异。本研究使用共聚焦显微镜对线粒体特异性染料四甲基罗丹明乙酯(TMRE)在整个活牛晶状体上皮和浅层皮层中的运动进行成像。 方法:在室温下用5微克/毫升的TMRE加载培养的牛晶状体15分钟。使用488 nm氩激光激发和505 nm长通发射滤光片设置,用蔡司510(配置META 18)共聚焦激光扫描显微镜采集TMRE荧光10至15分钟。电子传输链势的解偶联剂羰基氰间氯苯腙(CCCP,32.5微m)用于证明TMRE的荧光特异性。 结果:在活牛晶状体的上皮细胞中观察到TMRE的多向动态运动,在表层皮质纤维细胞中也观察到双向动态运动。在上皮中,TMRE荧光的移动高达5微米/分钟,而在浅层皮层中,观察到的移动高至18.5微米/分钟。用解偶联剂CCCP处理后,TMRE的荧光移动被消除。 结论:观察到的TMRE荧光运动的动态可能代表了实际的线粒体运动,表明晶状体上皮和浅层皮层线粒体的动态状态。这种活性不仅存在于上皮细胞中,也存在于浅层皮层中,这表明浅层皮层纤维细胞在晶状体代谢中的作用比以前怀疑的要积极得多。或者,观察到的TMRE在线粒体网络中的运动可能代表内膜电位分布的变化,可能允许能量从ATP需求低的区域传递到ATP需求高的区域[2]。 |
| 动物实验 |
Eye dissection and treatment [2]
Bovine eyes, obtained from a local abattoir, were dissected, and the lenses were excised within 1-5 h post-mortem under sterile conditions, as described previously. Briefly, the lenses were placed in a three part chamber made from glass, silicon rubber, and a metal base and immersed in 21 ml of culture medium consisting of Medium 199 with Earle's salts, 100 mg/l L-glutamine, 3% dyalized fetal bovine serum, 2.2 g/l sodium bicarbonate, 5.96 g/l HEPES, and 1% antibiotics (100 units/ml penicillin and 0.1 mg/ml streptomycin). The cultured lenses were incubated at 37 °C and 4% CO2 for 48 h prior to experimental use and lenses that were damaged during dissection were excluded from the study. To demonstrate the fluorescence specificity of TMRE, the uncoupler of the electron transport chain potential, carbonyl cyanide m-chlorophenylhydrazone (CCCP), was used. Lenses were transferred for treatment into glass vials containing 32.5 μM CCCP in 10 ml serum free M199 and incubated for 30 min. The lenses were then rinsed three times with physiological saline and culture medium. |
| 参考文献 |
|
| 其他信息 |
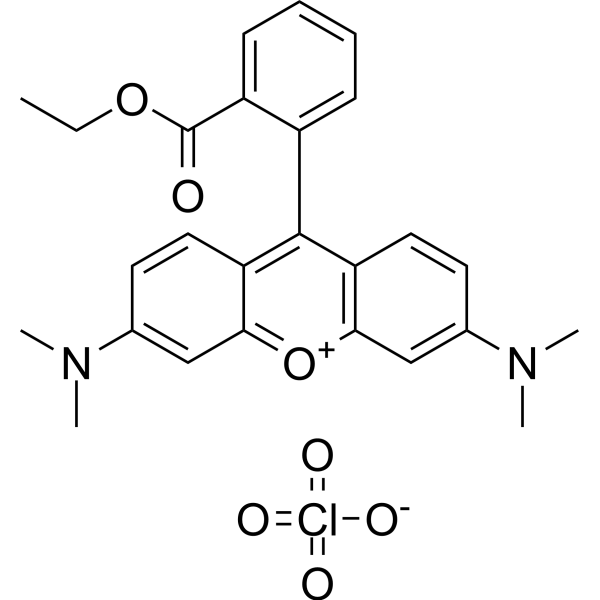
Tetramethylrhodamine ethyl ester perchlorate is an organic perchlorate salt that has tetramethylrhodamine ethyl ester(1+) as the cation. It is used as a cell-permeant, cationic, red-orange fluorescent dye that is readily sequestered by active mitochondria. It has a role as a fluorochrome and a reagent. It is a xanthene dye and an organic perchlorate salt. It contains a tetramethylrhodamine ethyl ester(1+).
Adenosine triphosphate (ATP) is the main source of energy for metabolism. Mitochondria provide the majority of this ATP by a process known as oxidative phosphorylation. This process involves active transfer of positively charged protons across the mitochondrial inner membrane resulting in a net internal negative charge, known as the mitochondrial transmembrane potential (ΔΨm). The proton gradient is then used by ATP synthase to produce ATP by fusing adenosine diphosphate and free phosphate. The net negative charge across a healthy mitochondrion is maintained at approximately -180 mV, which can be detected by staining cells with positively charged dyes such as tetramethylrhodamine ethyl ester (TMRE). TMRE emits a red fluorescence that can be detected by flow cytometry or fluorescence microscopy and the level of TMRE fluorescence in stained cells can be used to determine whether mitochondria in a cell have high or low ΔΨm. Cytochrome c is essential for producing ΔΨm because it promotes the pumping the protons into the mitochondrial intermembrane space as it shuttles electrons from Complex III to Complex IV along the electron transport chain. Cytochrome c is released from the mitochondrial intermembrane space into the cytosol during apoptosis. This impairs its ability to shuttle electrons between Complex III and Complex IV and results in rapid dissipation of ΔΨm. Loss of ΔΨm is therefore closely associated with cytochrome c release during apoptosis and is often used as a surrogate marker for cytochrome c release in cells.[1] Purpose: Recent confocal laser scanning microscopy studies of the mitochondria of vertebrate lenses show a striking difference in the distribution and morphology of the mitochondria of lens epithelial and superficial cortical cells. This study, using confocal microscopy, was undertaken to image the movement of the mitochondria specific dye tetramethylrhodamine ethyl ester (TMRE) in the epithelium and superficial cortex of whole live bovine lens. Methods: Cultured bovine lenses were loaded with 5 microg/ml TMRE for 15 min at room temperature. TMRE fluorescence was acquired with a Zeiss 510 (configuration META 18) confocal laser scanning microscope for 10 to 15 min using 488 nm Argon laser excitation and 505 nm long pass emission filter settings. The uncoupler of the electron transport chain potential, carbonyl cyanide m-chlorophenylhydrazone (CCCP, 32.5 microM), was used to demonstrate the fluorescent specificity of TMRE. Results: Multidirectional dynamic movement of TMRE was observed in epithelial cells and bidirectional dynamic movement was seen in the superficial cortical fiber cells of live bovine lenses. In the epithelium, the movement of TMRE fluorescence was up to 5 microm/min whereas in the superficial cortex the observed movement was up to 18.5 microm/min. The movement of TMRE fluorescence was abolished with treatment with the uncoupler, CCCP. Conclusions: The observed dynamics of TMRE fluorescence movement may represent actual mitochondrial movement, indicating the dynamic state of the mitochondria in both lens epithelium and superficial cortex. That this activity is found not only in the epithelium but also in the superficial cortex indicates that the superficial cortical fiber cells play a much more active role in lens metabolism than previously suspected. Alternatively, the observed movement of TMRE across a mitochondrial network could represent change in the distribution of potential across the inner membrane, presumably allowing energy transmission across the cell from regions of low to regions of high ATP demand [2]. |
| 分子式 |
C26H27CLN2O7
|
|---|---|
| 分子量 |
514.9548
|
| 精确质量 |
514.15
|
| CAS号 |
115532-52-0
|
| PubChem CID |
2762682
|
| 外观&性状 |
Brown to black solid powder
|
| LogP |
6.057
|
| tPSA |
120.19
|
| 氢键供体(HBD)数目 |
0
|
| 氢键受体(HBA)数目 |
8
|
| 可旋转键数目(RBC) |
5
|
| 重原子数目 |
36
|
| 分子复杂度/Complexity |
884
|
| 定义原子立体中心数目 |
0
|
| InChi Key |
NBAOBNBFGNQAEJ-UHFFFAOYSA-M
|
| InChi Code |
InChI=1S/C26H27N2O3.ClHO4/c1-6-30-26(29)20-10-8-7-9-19(20)25-21-13-11-17(27(2)3)15-23(21)31-24-16-18(28(4)5)12-14-22(24)25;2-1(3,4)5/h7-16H,6H2,1-5H3;(H,2,3,4,5)/q+1;/p-1
|
| 化学名 |
[6-(dimethylamino)-9-(2-ethoxycarbonylphenyl)xanthen-3-ylidene]-dimethylazanium;perchlorate
|
| 别名 |
115532-52-0; Tetramethylrhodamine ethyl ester perchlorate; tetramethylrhodamine ethyl ester; TMRE perchlorate; Xanthylium, 3,6-bis(dimethylamino)-9-[2-(ethoxycarbonyl)phenyl]-, perchlorate (1:1); CHEBI:78720; DTXSID70376365; Xanthylium, 3,6-bis(dimethylamino)-9-(2-(ethoxycarbonyl)phenyl)-, perchlorate (1:1); DTXCID30327393;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 请将本产品存放在密封且受保护的环境中(例如氮气保护),避免吸湿/受潮和光照。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : ~27.78 mg/mL (~53.95 mM)
|
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.08 mg/mL (4.04 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 20.8 mg/mL澄清DMSO储备液加入400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.08 mg/mL (4.04 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 20.8 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.9419 mL | 9.7097 mL | 19.4194 mL | |
| 5 mM | 0.3884 mL | 1.9419 mL | 3.8839 mL | |
| 10 mM | 0.1942 mL | 0.9710 mL | 1.9419 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。