| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| Other Sizes |
|
| 靶点 |
|
|
|---|---|---|
| 体外研究 (In Vitro) |
以剂量依赖性方式降低去饱和指数是 A939572 的强体内活性之一[1]。 SCD1 酶活性被一种名为 A939572 的微小化学物质选择性抑制。第 5 天,A939572 显示 Caki1、A498、Caki2 和 ACHN 增殖的统计学显着剂量依赖性降低(IC50 分别为 65 nM、50 nM、65 nM 和 6 nM)。与 DMSO+BSA 对照相比,A939572 (SCDi) 处理的 Caki1 和 A498 细胞中所有五种内质网应激相关基因表达水平均显着升高。通过添加 OA-BSA 可以防止这种增强的表达。
优化从检查苯氧环上的取代开始。对于邻位取代的类似物,IC50从H(4a,370 nM)和F(4b,98 nM)稳步下降到更大的卤素基团,如Cl和Br(4c/A939572和4d,<4 nM)。与哒嗪系列观察到的SAR趋势一致,苯氧基环上亲脂性增加,特别是邻位亲脂性,与抑制活性的提高相关。可以观察到,引入2-甲基导致抑制剂(4e,17 nM)的效力提高了20倍以上。相对亲水性更强的甲氧基类似物(4f,81 nM)的影响不太明显。如化合物4g(20 nM)所示,间位取代也具有良好的耐受性,尽管不如邻位取代的类似物4c/A939572(<4 nM)最佳。为了探索任何额外的亲脂性相互作用,我们在4c的基础上在4、5或6位引入了氟化物。如表1所示,2,4-二取代的类似物4j能够保持4c观察到的大部分效力,而2,6-二取代则放弃了2-单取代产生的所有增益(4h,330 nM vs 4a,370 nM)。发现在5位同时存在F是有益的,因为2,5-萘醌4i在人SCD1中表现出约两倍的效力提高(4i,hSCD1 IC50=18 nM vs 4c,hSCT1 IC50=37 nM)。[1] 基于与化合物4c/A939572相关的令人鼓舞的结果,我们接下来研究了用杂环部分取代酰胺基团以进一步提高SCD1抑制活性。这种修饰产生了几个IC50保留良好的类似物(4l,8 nM;4m,10 nM),尽管它们与4c/A939572相比没有效力优势。芳基3位上存在官能团似乎对具有高效力很重要,因为未取代的类似物显示出显著的活性损失(4k,0.6μM)。酰胺衍生物的微调表明,只有伯酰胺或少量仲酰胺如乙酰胺是有利的,IC50与4c相当。大体积组对活性有害,因为4q在10μM时没有抑制作用。 由于SCD1活性取决于细胞色素b5和细胞色素b5-还原酶,我们建立了一种选择性测定法,以排除被鉴定为SCD1抑制剂的化合物实际上可能抑制辅酶的可能性。当浓度超过10μM时,抑制作用的缺乏支持了我们基于尿素的化学型对SCD的直接抑制,以化合物4c/A939572为代表。 接下来,我们研究了强效抑制剂的选择性。通常可以实现对激酶的优异选择性。4c/A939572也在3H-Dofetilide结合试验中进行了测试,未显示出明显的hERG通道阻断活性(IC50>100μM)[1]。 |
|
| 体内研究 (In Vivo) |
在携带 A498 ccRCC 异种移植物的无胸腺裸鼠 (nu/nu) 中,单独或组合使用 A939572(30 mg/kg,口服)和 Tem 治疗 4 周后测量肿瘤体积 (mm3)。 A939572 和 Tem 单一疗法观察到类似的生长反应;研究结束时,肿瘤体积减少了 20-30%(与安慰剂对照相比);然而,直到治疗的最后一周,数据才达到统计学显着性。当研究结束时,联合治疗组的肿瘤体积减少了 60% 以上(与安慰剂对照组相比),并且在治疗大约一周后观察到显着减少 [2]。
在一项为期5天的ob/ob小鼠疗效研究中,对SCD1抑制剂4b和4c/A939572进行了评估。以16:0/16:1n7或18:0/18:1n9的比率计算的去饱和指数用作活性的体内生物标志物。检查的脂质类别包括胆固醇酯、二酰基甘油、游离脂肪酸、游离胆固醇、总磷脂和三酰基甘油。4b(30mpk-bid)和4c/A939572(10mpk-bid)持续将所有这些脂质类别的去饱和指数降低到瘦水平,甚至更低。图2显示了SCD1抑制剂4b和4c治疗的去饱和指数(18:0/18:1n9)降低效果。在ob/ob小鼠中也观察到甘油三酯去饱和指数降低4c的剂量依赖性(数据未显示)。这些观察结果表明,体外活性与体内去饱和指数之间存在明显的相关性[1]。 |
|
| 酶活实验 |
SCD1体外酶法测定。[1]
通过测量3H(9,10)硬脂酰辅酶A底物去饱和产生的氚水来测定SCD1活性。该检测的一个版本使用ob/ob小鼠肝微粒体作为SCD1酶的来源。另一种使用与人cyt b5/cyt b5R串联表达的重组人SCD1作为SCD1酶的来源。 SCD1活性测定在50℃的96孔板中进行L适用于高通量筛选的总测定反应体积。通常为50L反应体积:5L在10%DMSO和10M硬脂酰辅酶A,0.24M 3H(9,10)硬脂酰辅酶A在35L测定缓冲液(250 mM蔗糖、10 mM Tris pH 7.5、5mM MgCl2、1 mM DTT、罗氏完全EDTA蛋白酶抑制剂混合物、2 mM NADH和50 mM NaF)。然后加入蛋白质浓度在10-20之间的人或小鼠微粒体来引发反应g蛋白质,取决于特定微粒体制剂的比活性。 在30分钟的反应时间后,通过加入终止溶液终止反应,通常为30分钟L 4N HCl。设定的反应体积,通常为65L、 然后从每个孔转移到Millipore多筛板中的50mg甲醇预润湿的Norit A炭中。将板摇动1分钟,静置5分钟,以吸附硬脂酰辅酶A和油酰辅酶A。通过离心将3H-H2O与吸附有木炭的硬脂酰辅酶a和油酰辅酶a分离到收集板中。移除充满木炭的多屏幕板,并向每个孔中加入闪烁液。通常在Microbeta-TriLux放射性计数器中计算放射性。在背景减除后,SCD1活性相对于没有抑制剂的对照反应表示。使用非线性回归分析确定剂量反应曲线拟合和IC50值。 输血和萤光素酶检测[2] 使用Lipofectamine2000用p5xATF6-GL3-UPR荧光素酶报告基因和pRL-CMV肾荧光素酶质粒瞬时转染Caki1和A498细胞。根据制造商的方案,使用Promega的双荧光素酶检测试剂盒在48小时后收获细胞(DMSO vs.A939572NT vs.shSCD780),并使用Veritas光度计测量荧光素酶活性;报告为相对发光。 RNA分离和定量PCR[2] 如前所述进行RNA分离、cDNA制备和QPCR。TaqMan®FAM™染料标记探针,包括POLR2A(Hs00172187_m1-normalization control)、SCD1(Hs01682761_m1)、HSPA5(Hs99999174_m1)、CEBPβ(CEBPB Hs00270923_s1)、GADD45A(Hs0.0169255_m1),DDIT3(Hs01090850_m1);HERPUD1(Hs01124269_m1)和ATF6(Hs00232586_m1)。倍数变化值比较:使用ΔΔCt法比较正常与肿瘤、NT与靶慢病毒、DMSO与A939572处理的样本。 |
|
| 细胞实验 |
将细胞(0.5 或 1×105/孔)一式三份接种在 24 孔板中。使用库尔特粒子计数器对细胞进行计数。将油酸-白蛋白以 5μMol 添加到培养基中。 A939572 库存是在 DMSO 中制备的。进行替西罗莫司给药。软琼脂培养物是通过在 1.5% Seaplaque®GTG® 琼脂糖中以 1:1 的比例稀释 2 倍生长培养基来制备的,在 60mm 培养皿中每板 500 个细胞。 3 周后用吉姆萨 (Giemsa) 对集落进行染色并计数[2]。
|
|
| 动物实验 |
In Vivo Analysis [2]
A498 cells were subcutaneously implanted in athymic nu/nu mice at 1×106 cells/mouse in 50%Matrigel. Tumors reached ~50 mm3 prior to 4wk treatment. A939572 was re-suspended in strawberry flavored Kool-Aid® in sterilized H2O (0.2g/mL) vehicle at 30mg/kg in a 50μl dose. Mice were orally fed by using a syringe to administer the 50μl dose twice daily/mouse. This modified method was found to be effective and less stressful on the mice. Temsirolimus was solubilized in 30% ethanol/saline and administered via intraperitoneal injection at 10mg/kg in a 50μl dose once every 72hrs/mouse. Tumor volumes were calculated using the formula 0.5236(L*W*H) and body weight were measured every 3 days. |
|
| 药代性质 (ADME/PK) |
In general, this series of SCD1 inhibitors features favorable pharmacokinetic profiles in rodents, characterized by modest volume of distribution and high oral bioavailability in mice (4c/A939572, CLp = 0.4 L/h/kg; Vss = 0.4 L/kg; F = 92%).
|
|
| 参考文献 | ||
| 其他信息 |
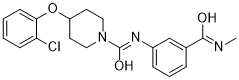
A series of structurally novel stearoyl-CoA desaturase1 (SCD1) inhibitors has been identified via molecular scaffold manipulation. Preliminary structure-activity relationship (SAR) studies led to the discovery of potent, and orally bioavailable piperidine-aryl urea-based SCD1 inhibitors. 4-(2-Chlorophenoxy)-N-[3-(methyl carbamoyl)phenyl]piperidine-1-carboxamide 4c exhibited robust in vivo activity with dose-dependent desaturation index lowering effects. [1]
Purpose: We set out to identify Stearoyl-CoA desaturase 1 (SCD1) as a novel molecular target in clear cell renal cell carcinoma (ccRCC) and examine its role in tumor cell growth and viability in vitro and in vivo independently as well as in combination with current U.S. Food and Drug Administration (FDA)-approved regimens. Experimental design: Patient normal and ccRCC tissue samples and cell lines were examined for SCD1 expression. Genetic knockdown models and targeted inhibition of SCD1 through use of a small molecule inhibitor, A939572, were analyzed for growth, apoptosis, and alterations in gene expression using gene array analysis. Therapeutic models of synergy were evaluated utilizing pharmacologic inhibition of SCD1 with the tyrosine kinase inhibitors (TKI) sunitinib and pazopanib, and the mTOR inhibitor temsirolimus. Results: Our studies identify increased SCD1 expression in all stages of ccRCC. Both genetic knockdown and pharmacologic inhibition of SCD1 decreased tumor cell proliferation and induced apoptosis in vitro and in vivo. Upon gene array, quantitative real-time PCR, and protein analysis of A939572-treated or SCD1 lentiviral knockdown samples, induction of endoplasmic reticulum stress response signaling was observed, providing mechanistic insight for SCD1 activity in ccRCC. Furthermore, combinatorial application of A939572 with temsirolimus synergistically inhibited tumor growth in vitro and in vivo. Conclusions: Increased SCD1 expression supports ccRCC viability and therefore we propose it as a novel molecular target for therapy either independently or in combination with an mTOR inhibitor for patients whose disease cannot be remedied with surgical intervention, such as in cases of advanced or metastatic disease. [2] |
| 分子式 |
C20H22CLN3O3
|
|---|---|
| 分子量 |
387.8600
|
| 精确质量 |
387.135
|
| 元素分析 |
C, 61.93; H, 5.72; Cl, 9.14; N, 10.83; O, 12.37
|
| CAS号 |
1032229-33-6
|
| PubChem CID |
24905400
|
| 外观&性状 |
White to off-white solid powder
|
| 密度 |
1.302 g/cm3
|
| 沸点 |
633.5ºC at 760 mmHg
|
| 闪点 |
336.9ºC
|
| LogP |
4.176
|
| tPSA |
70.67
|
| 氢键供体(HBD)数目 |
2
|
| 氢键受体(HBA)数目 |
3
|
| 可旋转键数目(RBC) |
4
|
| 重原子数目 |
27
|
| 分子复杂度/Complexity |
511
|
| 定义原子立体中心数目 |
0
|
| SMILES |
ClC1=C([H])C([H])=C([H])C([H])=C1OC1([H])C([H])([H])C([H])([H])N(C(N([H])C2=C([H])C([H])=C([H])C(C(N([H])C([H])([H])[H])=O)=C2[H])=O)C([H])([H])C1([H])[H]
|
| InChi Key |
DPYTYQFYDLYWHZ-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C20H22ClN3O3/c1-22-19(25)14-5-4-6-15(13-14)23-20(26)24-11-9-16(10-12-24)27-18-8-3-2-7-17(18)21/h2-8,13,16H,9-12H2,1H3,(H,22,25)(H,23,26)
|
| 化学名 |
4-(2-chlorophenoxy)-N-[3-(methylcarbamoyl)phenyl]piperidine-1-carboxamide
|
| 别名 |
A939572; A-939572; 1032229-33-6; A939,572; 4-(2-chlorophenoxy)-N-[3-(methylcarbamoyl)phenyl]piperidine-1-carboxamide; 4-(2-chlorophenoxy)-N-(3-(methylcarbamoyl)phenyl)piperidine-1-carboxamide; 4-(2-CHLOROPHENOXY)-N-[3-[(METHYLAMINO)CARBONYL]PHENYL]-1-PIPERIDINECARBOXAMIDE; 1-Piperidinecarboxamide,4-(2-chlorophenoxy)-N-[3-[(methylamino)carbonyl]phenyl]-; CHEMBL469169; A 939,572; A 939572; SCD1 Inhibitor; Stearoyl-CoA Desaturase 1 Inhibitor;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : ~100 mg/mL (~257.82 mM)
H2O : < 0.1 mg/mL |
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (6.45 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (6.45 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.5 mg/mL (6.45 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.5782 mL | 12.8912 mL | 25.7825 mL | |
| 5 mM | 0.5157 mL | 2.5782 mL | 5.1565 mL | |
| 10 mM | 0.2578 mL | 1.2891 mL | 2.5782 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
|
|
|