| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
| 靶点 |
SIRT2 (IC50 of 3.5 μM); SIRT1/3 (IC50s = 30 and 91 μM)
|
||
|---|---|---|---|
| 体外研究 (In Vitro) |
AGK2 以剂量依赖性方式强烈抑制细胞生长。此外,AGK2 以剂量依赖性方式强烈抑制细胞生长,但在低浓度下不会引起细胞毒性。用 AGK2 (5 μM) 处理 12 天后,细胞在软琼脂中形成集落的能力显着下降,达到对照细胞的 46%。根据蛋白质印迹分析,AGK2 治疗后观察到 CDK4 或 CDK6 和细胞周期蛋白 D1 水平呈剂量依赖性降低。此外,p53 蛋白表达受到 AGK2 的抑制[2]。当 10 μM AGK2 应用于小胶质细胞 BV2 细胞时,PAR 信号显着增加。当小胶质细胞 BV2 细胞用 10 μM AGK2 处理时,细胞内 ATP 显着减少,细胞晚期凋亡和坏死显着升高 [3]。
已经证明,Sirt1和Sirt2抑制剂EX527和AGK2通过抑制Cdk6和/或Cdk4的表达来抑制细胞生长并导致G1期阻滞。琼脂集落形成试验表明,EX527和AGK2降低了软琼脂中的集落形成。此外,EX527和AGK2预处理抑制了HSF1和HSP27的表达,并诱导了HSF1泛素化。在划痕试验中,Sirt1过表达增加了HSF1的表达和/或稳定性,并诱导了细胞迁移。总体而言,这些结果表明EX527和AGK2通过抑制HSF1蛋白的稳定性来抑制细胞生长和迁移。[2] Sirtuin 2(SIRT2)是一种Sirtuin家族蛋白,是一种微管蛋白脱乙酰酶。最近的研究表明,SIRT2在程序性坏死中起着关键作用,SIRT2抑制剂AGK2可以降低帕金森病细胞模型和心肌缺血再灌注动物模型中的细胞死亡。然而,关于SIRT2在小胶质细胞存活和功能中的作用的信息很少,而小胶质细胞在多种神经系统疾病中起着至关重要的作用。我们目前的研究发现,10μM的AGK2(一种广泛使用的AGK2浓度)可以诱导晚期凋亡和坏死,以及小胶质细胞BV2细胞内ATP水平的降低。我们的研究还表明,AGK2诱导的细胞死亡和AGK2引发的ATP下降都是由聚ADP核糖聚合酶(PARP)激活介导的。总的来说,我们的研究提供了第一个证据,表明SIRT2在小胶质细胞的基础存活中起着重要作用,以及SIRT2对细胞内ATP水平影响的机制。[3] Sirt1/2抑制剂EX527和AGK2对细胞增殖的细胞毒性作用[2] 为了研究Sirt1/2抑制剂EX527和AGK2对HeLa细胞生长的影响,我们进行了MTT分析。将细胞暴露于浓度逐渐升高的烟酰胺(NAM)、EX527和AGK2中24小时,并监测细胞存活率(图1)。EX527和AGK2以剂量依赖的方式显著抑制细胞增殖。浓度为50和100μM的EX527在24小时时分别导致68%和54%的细胞生长抑制(图1B)。同样,AGK2也以剂量依赖的方式显著抑制细胞生长,在低剂量下(≥1μM;图1C)不诱导细胞毒性。然而,在NAM处理24小时后,这些细胞的细胞增殖没有明显下降(存活率>93%;图1A)。 EX527和AGK2诱导HeLa细胞G1期细胞周期阻滞[2] 假设EX527或AGK2诱导细胞周期调控的改变。我们使用流式细胞术分析了EX527或AGK2对细胞周期进程的影响。如图2A-C所示,EX527和AGK2诱导细胞周期阻滞在G1期。Western blot分析显示,EX527或AGK2处理后CDK4或CDK6和细胞周期蛋白D1的水平呈剂量依赖性降低。此外,EX527和AGK2抑制了p53蛋白的表达(图2D)。这些结果表明,EX527和AGK2对G1细胞周期进程的影响与抑制细胞生长有关。 为了确定EX527和AGK2是否诱导HeLa细胞死亡,我们使用Annexin V-FITC/PI双染色法通过流式细胞术定量凋亡。如图2E-H所示,孵育24小时后,EX527处理后活细胞没有显著减少;93%的对照细胞存活,而EX527处理的细胞中只有3.3%发生细胞死亡。同样,在AGK2处理后,没有明显观察到凋亡细胞(图2G)。与这一观察结果一致,与对照组相比,用EX527或AGK2处理的细胞中半胱氨酸天冬氨酸蛋白酶-3和PARP没有被切割(图2H)。此外,关键的自噬蛋白LC3B和beclin-1在用EX527或AGK2处理后没有被激活(图2I)。 EX527和AGK2抑制HSF1/HPS27通路[2] 先前的一项研究表明,Sirt1在热应激条件下使HSF1脱乙酰基并激活热休克蛋白(HSPs)(21)。我们研究了EX527和AGK2对Sirt1和Sirt2的抑制可能是HSF1失活的原因。因此,我们对经EX527或AGK2处理的细胞进行热休克(42°C下1小时),并分析内源性Sirt1、Sirt2和HSF1以及Hsp27和Hsp70等热休克蛋白的表达。EX527或AGK2处理降低了非应激或热应激条件下HSF1和HSP27的表达(图3A和B),这表明Sirt1和Sirt2是调节HSF1通路所必需的。此外,EX527和AGK2也降低了热休克后HSF1的磷酸化。然而,在热休克条件下,NAM降低了HSF1表达/磷酸化和HSP27表达(图3C)。 为了确定EX527和AGK2是否影响HeLa细胞中HSF1的转录,使用针对HSF1基因的特异性寡核苷酸进行了RT-PCR。如图3D所示,EX527或AGK2没有改变HSF1 mRNA水平。 为了验证Sirt1调节HSF1的意义,将细胞转染有或没有Sirt1,暴露于42°C热休克1小时,在37°C下恢复24小时,并分析HSF1表达。正如预期的那样,热休克诱导了HSP27的表达,并随着恢复时间的推移而增加。重要的是,在相同的时间点,我们观察到,与热休克处理的细胞相比,过表达Sirt1的细胞显示出HSF1表达的增加(图3E)。 Sirt1/Sirt2抑制与HSF1泛素化增加有关[2] 为了确定Sirt1的HSF1脱乙酰化是否参与HSF1泛素化/稳定化,我们检查了EX527和AGK2处理后HSF1的乙酰化和泛素化状态。HeLa细胞用或不用EX527和AGK2处理,并暴露于42°C的热休克1小时。然后,用抗HSF1抗体对样品进行免疫沉淀,并分析HSF1乙酰化。在未处理的细胞中检测到乙酰化HSF1,但在暴露于热休克应激条件的细胞中有所减少。然而,在热休克之前,EX527或AGK2处理的细胞中诱导了乙酰化HSF1水平(图4A)。此外,EX527和AGK2诱导HSF1泛素化(图4B)。 EX527和AGK2抑制细胞迁移[2] 为了研究Sirt1/HSF1是否调节细胞运动,我们用EX527和AGK2处理HeLa细胞36小时,并进行伤口愈合实验。与对照或热休克处理的细胞相比,EX527-或AGK2处理的细胞显示出迁移能力降低(图5A)。 |
||
| 体内研究 (In Vivo) |
与载体对照相比,AGK2 显着降低血液中的死亡率和细胞因子水平(TNF-α:298.3±24.6 vs 26.8±2.8 pg/mL,p=0.0034;IL-6:633.4±82.8 vs 232.6±133.0 pg/mL, p=0.0344)和腹膜液(IL-6:704.8±67.7 vs 391.4±98.5 pg/mL,p=0.033)。此外,AGK2 抑制培养的脾细胞中 IL-6 和 TNF-α 的生成(IL-6:73.1±4.2 vs 49.6±3.0 pg/mL;p=0.0051;TNF-α:68.1 ±6.4 vs 23.9±2.8 pg/mL)毫升,p=0.0009)[4]。
AGK2与溶媒对照组相比,显著降低了死亡率,降低了血液(TNF-α:298.3±24.6 vs 26.8±2.8 pg/ml,p=0.0034;IL-6:633.4±82.8 vs 232.6±133.0 pg/ml,p=0.0344)和腹膜液(IL-6:704.8±67.7 vs 391.4±98.5 pg/ml,p=0.033)中的细胞因子水平。此外,AGK2抑制了培养脾细胞中TNF-α和IL-6的产生(TNF-α:68.1±6.4 vs 23.9±2.8 pg/ml,p=0.0009;IL-6:73.1±4.2 vs 49.6±3.0 pg/ml;p=0.0051)。TEG数据显示,接受CLP的小鼠表现出纤维蛋白形成和纤维蛋白交联时间延长、凝块形成减慢、血小板功能降低和凝块刚性降低。AGK2治疗与纤维蛋白交联和凝块形成时间的显著改善有关,对凝块起始参数或血小板功能没有显著影响。此外,AGK2显著减轻了骨髓萎缩(58.3±6.5%对30.0±8.2%,p=0.0262)。[4] AGK2显著提高CLP诱导的败血症休克小鼠模型的存活率[4] C57BL/6J小鼠在二甲亚砜(DMSO)或单独DMSO中腹腔注射AGK2(82 mg/kg),2小时后接受CLP。单独使用DMSO载体组的所有小鼠在不到3天内死亡,而用AGK2治疗的大多数(55.6%)小鼠在CLP后的240小时内存活(55.6%对0%存活,p<0.0001;图1)。 AGK2降低血液和腹腔中的细胞因子水平[4] CLP后采集血液样本和腹膜液。ELISA法测定TNF-α和IL-6水平。正常情况下,血液和腹膜液中未检测到TNF-α和IL-6。CLP诱导的败血症显著增加了循环和腹膜液中的细胞因子水平。与DMSO载体相比,用AGK2治疗的小鼠显著降低了循环中的细胞因子水平(TNF-α:298.3±24.6 vs 26.8±2.8 pg/ml,p=0.0034;IL-6:633.4±82.8 vs 232.6±133.0 pg/ml,p=0.0344;图2、3)和腹膜液中的细胞素水平(IL-6:704.8±67.7 vs 391.4±98.5 pg/ml,p=0.033;图3)。 AGK2降低培养的脾细胞上清液中的细胞因子水平[4] 使用ELISA,在有或没有AGK2的情况下,用LPS处理6小时的培养小鼠原代脾细胞上清液中检测TNF-α和IL-6的水平。假组正常原代脾细胞(未经任何治疗)作为对照,并显示出预期的低浓度TNF-α和IL-6。LPS刺激细胞上清液中TNF-α和IL-6的增加。AGK2治疗显著降低了LPS诱导的TNF-α和IL-6的产生(TNF-α:23.9±2.8 vs 68.1±6.4 pg/ml,p=0.0009;IL-6:49.6±3.0 vs 73.1±4.2 pg/ml;p=0.0051;图4)。 AGK2治疗对感染性休克模型血栓弹力图参数的影响[4] CLP后48小时采集全血样本,并进行TEG®5000处理。Thrombelastograph®止血分析仪系统用于分析。如图(5)所示,与假手术动物相比,DMSO处理的小鼠表现出延长的K、较慢的角和降低的MA(图5A)。然而,用AGK2选择性抑制SIRT2显著改善了K(17.0±3.5 vs 6.2±1.0 min,p=0.0392)和角度(10.3±2.5 vs 32.3±3.8度,p=0.0012;图5B),但对血栓起始参数(SP:8.1±1.1 vs 7.0±0.9 min;R:11.5±2.2 vs 8.8±1.0 min)和MA(28.7±6.0 vs 47.5±4.3 mm,p=0.0514;图5C)没有显著影响。 AGK2可减少败血症休克模型中的骨髓萎缩[4] CLP后48小时收集股骨和胫骨的骨样本,进行处理并用h&E染色。假手术组骨髓细胞组成和组织学正常。DMSO载体组CLP后48小时,骨髓细胞与静脉的比例增加,骨髓细胞耗竭,静脉扩张(0±0 vs 58.3±6.5%)AGK2治疗显著减轻了骨髓耗竭(图6A,放大40倍)和萎缩(图6B)(58.3±6.5%对30.0±8.2%,p=0.0262)。 |
||
| 酶活实验 |
基于FACS的Annexin V/7-AAD染色分析[3]
根据制造商的方案,使用ApoScreen Annexin V试剂盒进行FACS测定,以测量凋亡和坏死的程度。简而言之,用0.1%胰蛋白酶消化BV2细胞,并将其重新悬浮在冷结合缓冲液(10 mM HEPES,pH 7.4,140 mM NaCl,2.5 mM CaCl2,0.1%BSA)中,浓度在1×106至1×107个细胞/ml之间。将10μl标记的膜联蛋白V加入100μl细胞悬浮液中。在冰上孵育15分钟后,将380μl结合缓冲液和10μl 7-AAD溶液加入细胞悬浮液中。通过BD流式细胞仪(FACSAriaII)评估染色细胞的数量。 细胞外和细胞内乳酸脱氢酶(LDH)测定[3] 如前所述,进行细胞外LDH测定以确定细胞死亡。简而言之,将100μl细胞外培养基与150μl含有1.5 mM NADH和7.5 mM丙酮酸钠的磷酸钾缓冲液(500 mM,pH 7.5)混合。随后在90秒内监测样品A340nm的变化。 如前所述,还进行了细胞内LDH测定以确定细胞存活率。简而言之,细胞在含有0.04%Triton X-100、2 mM HEPES、0.2 mM二硫苏糖醇、0.01%牛血清白蛋白和0.1%酚红(pH 7.5)的裂解缓冲液中裂解20分钟。将50微升细胞裂解物与含有1.5 mM NADH和7.5 mM丙酮酸钠的150μl磷酸钾缓冲液(500 mM,pH 7.5)混合。随后,在90秒内监测样品A340nm的变化。通过将样品裂解物的LDH活性归一化为对照裂解物的乳酸脱氢酶活性来计算细胞存活率。 聚(ADP-核糖)(标准杆数)的免疫染色[3] 将细胞培养物在4%多聚甲醛中固定30分钟,然后在PBS中洗涤一次,然后在RT下用0.1%Triton-X100(在PBS稀释)处理细胞20分钟。在RT下将细胞在10%山羊血清中孵育1小时,然后在4°C下与含1%山羊血清的PBS中的小鼠抗PAR抗体(1:200稀释)孵育过夜。用PBS洗涤三次后,将细胞与含有1%山羊血清的Alexa Fluor 488山羊抗小鼠二抗在室温下以1:300稀释1小时。用DAPI对细胞进行反染色后,在Leica共聚焦荧光显微镜下拍摄细胞培养物的荧光图像。 ATP测定[3] 使用罗氏ATP生物发光检测试剂盒(HS II)测定ATP水平。简而言之,用细胞裂解试剂裂解细胞,将50μl裂解物与150μl萤光素酶试剂混合。随后,使用平板阅读器检测样品的发光。BCA测定用于确定样品的蛋白质浓度。使用ATP标准计算样品的ATP浓度,并根据样品的蛋白质进行归一化。 |
||
| 细胞实验 |
细胞增殖试验[2]
使用3-(4,5-二甲基噻唑基-2)-2,5-二苯基溴化四唑(MTT)法评估细胞增殖。将细胞以1×104个细胞/孔的密度接种在96孔板中。第二天,用PBS洗涤细胞两次,并向孔中加入500μg/ml MTT。在37°C下孵育4小时后,去除MTT溶液。向每个孔中加入0.01M甘氨酸和DMSO的混合物。用Benchmark微孔板读数器在540nm处测量吸光度。 免疫沉淀[2] 将总细胞提取物与抗HSF1在NP-40裂解缓冲液(0.5%NP-40、0.5%Triton X-100、150 mM NaCl、50 mM Tris-HCl pH 7.4、1 mM EDTA、50 mM NaF、1 mM B-甘油磷酸、1 mM原钒酸钠、0.5μg/ml亮肽、1μg/ml胃蛋白酶抑制剂、0.2 mM PMSF)中孵育。将提取物混合物在4°C下旋转培养过夜,然后加入20μl A/G蛋白珠在4°C下培养3小时。用相同的缓冲液洗涤珠粒三次,并悬浮在2X SDS样品缓冲液中。样品在SDS-聚丙烯酰胺凝胶中溶解,用所示的特异性抗体进行蛋白质印迹分析。 蛋白质印迹分析[2] 将细胞裂解物(50μg)置于裂解缓冲液(50 mM Tris-HCl,pH 7.5,150 mM NaCl,1%NP-40,0.5%脱氧胆酸钠,0.1%SDS和含有1μg/ml抑肽酶和亮肽的蛋白酶抑制剂混合物)中,并通过12%SDS-PAGE分离。按照标准程序将溶解的蛋白质转移到硝化纤维膜(英国Amersham Pharmacia Biotech)上。将膜在5%脱脂奶粉中封闭3小时,并在室温(RT)下与一抗一起孵育3小时。用特异性过氧化物酶偶联的二抗孵育1小时后,使用增强化学发光检测试剂盒检测印迹带。 伤口划痕试验[2] 让细胞在培养皿中生长过夜,使用移液管尖端在单层中产生约3mm宽的划痕。用PBS洗涤两次后,用或不用Sirt1/Sirt2抑制剂处理细胞,并在12或36小时后捕获图像。使用奥林巴斯IX2-SLP倒置显微镜以×100的放大倍数在每个孔的5个随机显微镜场中对细胞进行成像。 膜联蛋白V-FITC/PI双重染色[2] 收获细胞,在4°C下用70%乙醇固定1小时,用于细胞周期分析。用冷PBS洗涤后,将细胞与无DNase的RNase和碘化丙啶(PI)在37°C下孵育30分钟。通过在含有饱和浓度Annexin V-FITC和PI的结合缓冲液(10 mM HEPES、140 mM NaCl、2.5 mM CaCl2,pH 7.4)中在室温下孵育细胞15分钟,进行Annexin V-FITC/PI的特异性结合。孵育后,将细胞制成颗粒,并在FACScan分析仪中进行分析。 流式细胞术和细胞周期分析[2] 通过流式细胞术分析细胞周期分布。简而言之,收获1×106个细胞,用PBS洗涤,然后在4°C下用70%酒精固定30分钟。在冷PBS中洗涤三次后,将细胞重新悬浮在含有50μl 1mg/ml PI和1单位无DNase RNase的1ml PBS溶液中,在37°C下保持30分钟。然后通过FACS分析样品的DNA含量。 软琼脂集落形成试验[2] 简而言之,将细胞(8×103个细胞/孔)暴露于1 ml含有10%FBS的0.3%基础培养基Eagle琼脂中不同浓度的EX527或AGK2中。将培养物在5%CO2培养箱中在37°C下保持10-15天,并使用Olympus IX2-SLP倒置显微镜对细胞集落进行评分。 |
||
| 动物实验 |
|
||
| 参考文献 |
|
||
| 其他信息 |
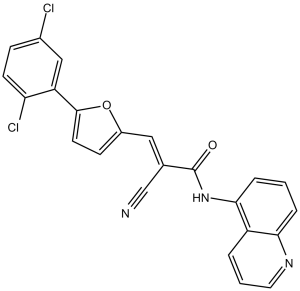
2-cyano-3-[5-(2,5-dichlorophenyl)-2-furanyl]-N-(5-quinolinyl)-2-propenamide is a member of quinolines.
A series of 114 SIRT inhibitor candidates was assembled using 'click chemistry', by reacting two alkynes bearing 2-anilinobenzamide pharmacophore with 57 azide building blocks in the presence of Cu(I) catalyst. Screening identified two SIRT2-selective inhibitors, which were more SIRT2-selective than AGK2, a known SIRT2 inhibitor. These findings will be useful for further development of SIRT2-selective inhibitors.[1] As described above, our findings suggest that the expression/activation of HSF1/HSP27 depend at least in part on the Sirt1/Sirt2 pathway. This finding prompted us to investigate whether the Sirt1/2-regulated HSF1/HSP27 pathway may affect motility such as migration. We demonstrated that the inhibition of Sirt1/2 by EX527 or AGK2 decreased cell motility in a scratch assay. Our data indicate that Sirt1 and HSF1/HSP27 play an important role in cell migration, as specifically demonstrated by the findings that overexpression of Sirt1 and HSF1 increased cell migration, whereas downregulation of HSP27 by siRNA decreased Sirt1- and HSF1-induced cell migration. The direct causal association between the HSF1/HSP27 pathway and Sirt1/2 was apparent by the finding that modulation of Sirt1/2 activity by EX527 and AGK2 strongly affected HSF1 expression/activation and modulated cell migration. The molecular basis for the activity of HSF1/HSP27 in affecting cell motility and in modulating the response to Sirt1 and Sirt2 still needs to be clarified. It should also be considered that, although Sirt1 is involved in HSF1 deacetylation, additional deacetylation sites by Sirt2 on HSF1 activation are present, which could be differentially regulated by Sirt1 and Sirt2 and may modulate other cellular functions in these cells. In conclusion, the inhibition of Sirt1/2 by EX527 or AGK2 inhibited cell growth and colony formation. Our study is the first to demonstrate that blocking Sirt1 and Sirt2 can induce HSF1 ubiquitination and degradation in vitro, suggesting that Sirt1/2 is involved in the activation of heat shock response signaling pathways. Furthermore, we observed a consistent reduction in cell migration after EX527 and AGK2 treatment. Our results suggest that Sirt1 and Sirt2 regulate cell migration via HSF1/Hsp27-mediated signaling. [2] Our study has shown that AGK2 can induce a decrease in the intracellular ATP levels of the microglia, which is consistent with our previous finding that both pharmacological and genetic inhibition of SIRT2 can lead to a decrease in the intracellular ATP levels of PC12 cells. Collectively, these findings have suggested a key role of SIRT2 in cellular energy metabolism. Our current study has suggested that PARP mediates the AGK2-induced decrease in ATP levels, thus suggesting a mechanism accounting for the significant effects of SIRT2 on cellular energy metabolism. Future studies are warranted to further investigate the roles of SIRT2 in microglial survival under both resting and activated conditions of the cells. It is also warranted to determine if the detrimental effects of AGK2 on basal microglial survival produce beneficial or detrimental effects on tissue injury in such diseases as PD and brain ischemia.[3] Background: Seven isoforms of histone deacetylase Class III have been reported - Sirtuin (SIRT) 1-7. We recently demonstrated that EX-527, an inhibitor of SIRT1, reduces mortality in a mouse model of lethal-cecal-ligationand- puncture (CLP)-induced septic shock. Our present study was aimed at determining whether selective inhibition of SIRT2, with AGK2, would decrease animal death and attenuate the inflammatory response in a septic model. Methods: Experiment I: C57BL/6J mice were intraperitoneally given either AGK2 (82 mg/kg) in dimethyl sulfoxide (DMSO) or DMSO alone, and 2 h later subjected to CLP. Survival was monitored for 240 hours. Experiment II: mice treated the same way as Experiment I, were grouped into (i) DMSO vehicle, and (ii) AGK2, with sham mice (operating but without any treatment) serving as controls. Peritoneal fluid and peripheral blood were examined at 24 and 48 hours for cytokine production. Samples of blood at 48 h were also allocated to assess coagulability using Thrombelastography (TEG). Morphological changes of bone marrow were evaluated from long bones (femurs and tibias) with hematoxylin and eosin (H&E) staining. Bone marrow atrophy was quantified by a blinded pathologist. Experiment III: cytokines in supernatant of the cultured normal primary splenocytes were measured after the cells were stimulated by lipopolysaccharide and treated with or without AGK2 (10 µM) for 6 hours. Results: AGK2 significantly reduced mortality and decreased levels of cytokines in blood (TNF-α: 298.3±24.6 vs 26.8±2.8 pg/ml, p=0.0034; IL-6: 633.4±82.8 vs 232.6±133.0 pg/ml, p=0.0344) and peritoneal fluid (IL-6: 704.8±67.7 vs 391.4±98.5 pg/ml, p=0.033) compared to vehicle control. Also, AGK2 suppressed the TNF-α and IL-6 production in the cultured splenocytes (TNF-α: 68.1±6.4 vs 23.9±2.8 pg/ml, p=0.0009; IL-6: 73.1±4.2 vs 49.6±3.0 pg/ml; p=0.0051). The TEG data showed that the mice subjected to CLP displayed prolonged fibrin formation and fibrin cross-linkage time, slower clot formation, decreased platelet function, and clot rigidity. AGK2 treatment was associated with dramatic improvements in fibrin cross-linkage and clot formation times, without a significant impact on the clot initiation parameters or platelet function. Additionally, AGK2 significantly attenuated the bone marrow atrophy (58.3±6.5 vs 30.0±8.2%, p=0.0262). Conclusion: Selective inhibition of SIRT2 significantly improves survival, and attenuates sepsis-associated "cytokine storm", coagulopathy, and bone marrow atrophy in a mouse model of lethal septic shock.[4] |
| 分子式 |
C23H13CL2N3O2
|
|
|---|---|---|
| 分子量 |
434.27
|
|
| 精确质量 |
433.038
|
|
| 元素分析 |
C, 63.61; H, 3.02; Cl, 16.33; N, 9.68; O, 7.37
|
|
| CAS号 |
304896-28-4
|
|
| 相关CAS号 |
|
|
| PubChem CID |
2130404
|
|
| 外观&性状 |
Light yellow to green yellow solid powder
|
|
| 密度 |
1.4±0.1 g/cm3
|
|
| 沸点 |
675.1±55.0 °C at 760 mmHg
|
|
| 闪点 |
362.1±31.5 °C
|
|
| 蒸汽压 |
0.0±2.1 mmHg at 25°C
|
|
| 折射率 |
1.718
|
|
| LogP |
5.39
|
|
| tPSA |
78.92
|
|
| 氢键供体(HBD)数目 |
1
|
|
| 氢键受体(HBA)数目 |
4
|
|
| 可旋转键数目(RBC) |
4
|
|
| 重原子数目 |
30
|
|
| 分子复杂度/Complexity |
706
|
|
| 定义原子立体中心数目 |
0
|
|
| SMILES |
C1=CC2=C(C=CC=N2)C(=C1)NC(=O)/C(=C/C3=CC=C(O3)C4=C(C=CC(=C4)Cl)Cl)/C#N
|
|
| InChi Key |
SVENPFFEMUOOGK-SDNWHVSQSA-N
|
|
| InChi Code |
InChI=1S/C23H13Cl2N3O2/c24-15-6-8-19(25)18(12-15)22-9-7-16(30-22)11-14(13-26)23(29)28-21-5-1-4-20-17(21)3-2-10-27-20/h1-12H,(H,28,29)/b14-11+
|
|
| 化学名 |
2-Cyano-3-[5-(2,5-dichlorophenyl)-2-furanyl]-N-5-quinolinyl-2-propenamide
|
|
| 别名 |
AGK-2; AGK-2; AGK2; 304896-28-4; UNII-DDF0L8606A; DDF0L8606A; 2-Propenamide, 2-cyano-3-(5-(2,5-dichlorophenyl)-2-furanyl)-N-5-quinolinyl-; MFCD01909444; AGK-2.
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 0.5 mg/mL (1.15 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 5.0 mg/mL澄清DMSO储备液加入400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 0.5 mg/mL (1.15 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 5.0 mg/mL 澄清 DMSO 储备液加入 900 μL 20% SBE-β-CD 生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 0.5 mg/mL (1.15 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 配方 4 中的溶解度: 8% DMSO+30% PEG 300+ddH2O:~1.5 mg/mL 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.3027 mL | 11.5136 mL | 23.0271 mL | |
| 5 mM | 0.4605 mL | 2.3027 mL | 4.6054 mL | |
| 10 mM | 0.2303 mL | 1.1514 mL | 2.3027 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
 |
|---|