| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg | |||
| Other Sizes |
| 靶点 |
GSK-3α (IC50 = 0.9 nM); GSK-3β (IC50 = 5 nM); CDK5/p25 (IC50 = 356 nM); Haspin (IC50 = 366 nM); CDK5/p35 (IC50 = 387 nM); DYRK2 (IC50 = 491 nM); CDK2/cyclin A (IC50 = 810 nM); CDK1/cyclin B (IC50 = 1246 nM); PIM3 (IC50 = 1269 nM); TLK2 (IC50 = 1381 nM); PKD2 (IC50 = 2462 nM); CDK2/cyclin E (IC50 = 3310 nM); Aurora-A (IC50 = 4966 nM)
Glycogen Synthase Kinase 3 (GSK3), including GSK3α and GSK3β isoforms. For GSK3β, the IC₅₀ value was ~10 nM; for GSK3α, the IC₅₀ value was ~20 nM. No inhibitory activity against other kinases (e.g., CDK2, ERK1, JNK2) was detected at concentrations up to 1 μM [2] |
|---|---|
| 体外研究 (In Vitro) |
AZD2858 是一种选择性 GSK-3 抑制剂,IC50 为 68 nM,抑制 S396 位点的 tau 磷酸化,激活 Wnt 信号通路。 AZD2858 处理(1 μM,12 小时)后,原代分离的人成骨细胞样细胞中 -β-连环蛋白水平增加了 3 倍。 [1] 在体外,AZD2858 刺激 hADSC 对成骨细胞和成骨矿化的承诺,同时在人和大鼠间充质干细胞中引起 -β-连环蛋白稳定。 [2]
1. 在诱导成骨的原代大鼠骨髓间充质干细胞(BMSCs)中,用AZD2858(10 nM、30 nM、100 nM,处理14天)呈剂量依赖性提高碱性磷酸酶(ALP)活性:100 nM浓度下,ALP活性较成骨诱导对照组高约2.8倍(通过对硝基苯磷酸酯比色法检测)。该药物还在100 nM浓度下使骨钙素(OCN,成熟成骨细胞标志物)的分泌量提高约3.2倍(ELISA检测),并通过qPCR增强成骨基因(Runx2、ALP、OCN)的表达:100 nM浓度下,Runx2 mRNA表达高约2.5倍,ALP mRNA高约3.0倍,OCN mRNA高约2.7倍 [2] 2. 在软骨诱导培养基中培养的原代大鼠软骨细胞中,AZD2858(10 nM-100 nM,处理7天)呈剂量依赖性抑制软骨分化:100 nM浓度下,Ⅱ型胶原(软骨细胞标志物)的表达通过Western blot检测降低约60%,阿尔新蓝染色显示阳性软骨细胞簇数量减少约55% [2] |
| 体内研究 (In Vivo) |
治疗两周后,与对照组相比,大鼠口服 AZD2858 治疗导致小梁骨量呈剂量依赖性增加,其中最大效果发生在每天一次 20 mg/kg 的剂量(总 BMC:对照组的 172%) 。皮质位点表现出微小但值得注意的影响(总 BMC:对照的 111%)。[1]每天对大鼠进行 AZD285 治疗(30 μmol/kg),持续长达 3 周,结果显示矿物质密度(第 2 周时增加 28%,第 3 周时增加 38%)和矿物质含量(第 2 周时增加 81%,第 3 周时增加 93%) 3周时)在老茧中。 AZD285 治疗使骨折愈合更快,骨痂没有明显的软骨内成分。 [3]在 28 天的暴露期内,暴露于 AZD2858 的大鼠表现出骨转换的血清生物标志物的时间依赖性变化和骨量的增加。 7 天后,AZD2858 增加大鼠骨形成生物标志物 P1NP 并降低骨吸收生物标志物 TRAcP-5b,表明骨合成代谢增加和骨吸收减少。 [2]
1. 在雄性SD大鼠(250-300 g)胫骨横断骨折模型(髓内针固定)中,口服AZD2858(30 mg/kg,每日1次,连续21天)可加速骨折愈合。Micro-CT分析显示,骨折骨痂的骨体积/总体积(BV/TV)较溶剂组高约2.3倍,骨痂骨密度(BMD)高约1.8倍。组织学染色(H&E、Masson三色染色)显示,AZD2858处理组无软骨内成骨(而溶剂组骨痂中可见明显软骨组织) [2] 2. 对骨折胫骨的生物力学测试(第21天)显示,与溶剂组相比,AZD2858处理组的极限载荷提高约45%,刚度提高约38%,表明愈合骨骼的机械强度增强 [2] 3. 骨折骨痂组织的免疫组化染色(第14天)显示,AZD2858处理组骨钙素阳性成骨细胞数量较溶剂组多约2.6倍,Ⅱ型胶原阳性软骨细胞数量减少约70%,证实其在体内可增强成骨作用并抑制软骨形成 [2] |
| 酶活实验 |
使用表达 4 重复 Tau 的 NIH-3T3 细胞评估 AZD2858 的体外功能活性。在 6 孔板中,细胞在含有 2 mM L-glut 和 10% HiFCS 的 DMEM 培养基中生长后,以 6 105 个细胞/孔的密度铺板。在每个实验中,AZD2858 的浓度为 1、10、100、500、1000、2000 和 10,000 nM,一式三份。在细胞裂解前,使用 100 L 体积的含有 0.5% NP-40、10 mM Tris、pH 7.2、150 mM NaCl 和 2 mM EDTA 的冰冷裂解缓冲液处理细胞 4 小时。将鸡尾酒蛋白酶抑制剂、50 mM NaF、0.2 mM NaVO4 以及其他磷酸酶和蛋白酶抑制剂添加到悬浮液中以产生反应。将溶液在 80°C 速冻至少一小时后,在冰上解冻,使用离心澄清裂解物,然后根据行业标准进行蛋白质印迹。封闭后,将印迹暴露于一抗 Phospho-Ser396-tau (1:1000) 过夜,洗涤,然后与二抗(驴抗兔,1:5000)一起孵育。使用辣根过氧化物酶联二抗(羊抗小鼠,1:10000)和一抗 Tau5 (1:200) 进行重新探测。使用光密度分析对所有印迹进行定量并使用 ECL 蛋白质印迹检测试剂和柯达 X 射线胶片显色后,计算 S396 tau 与总 tau (tau5) 的比率。
1. GSK3β激酶活性检测:将5 ng重组人GSK3β与50 μM合成肽底物(序列:YRRAAVPPSPSLSRHSSPHQpSEDEEE)在含20 mM Tris-HCl(pH 7.5)、10 mM氯化镁(MgCl₂)、1 mM二硫苏糖醇(DTT)和10 μM [γ-³³P]-ATP的反应缓冲液中孵育。加入AZD2858(1 nM-100 nM)后,混合物在30°C孵育60分钟。取20 μL反应液点样于磷酸纤维素纸上终止反应,用1%磷酸洗涤3次以去除未掺入的[γ-³³P]-ATP。通过液体闪烁计数测定放射性,根据剂量-反应曲线(抑制率vs.对数浓度)计算GSK3β的IC₅₀ [2] 2. GSK3α激酶活性检测:实验流程与GSK3β检测一致,仅替换为5 ng重组人GSK3α。使用相同浓度范围的AZD2858和数据分析方法确定GSK3α的IC₅₀ [2] 3. 激酶选择性检测:对于其他激酶(CDK2、ERK1、JNK2),将5-10 ng重组酶与其各自的肽底物、[γ-³³P]-ATP和AZD2858(0.1 nM-1 μM)在激酶特异性反应缓冲液中孵育。按上述方法测定放射性,未检测到该药物对这些激酶的抑制活性 [2] |
| 细胞实验 |
大鼠 MSC(在妊娠后不到 8 周从 Sprague Dawley 大鼠骨髓中分离)和人脂肪干细胞 (HADSC) 在含有 5% FBS 和 2 mM GlutaMax 作为基础培养基的 DMEM 中培养。在用 AZD2858(0.3 nM 至 20 mM)处理之前,将细胞接种在含有基础培养基(3-5000 个细胞/孔)的 96 孔板中 18 小时。 -24小时后评估连环蛋白稳定性。
1. 大鼠BMSC成骨实验:从大鼠股骨中分离原代BMSCs,以2×10⁴个细胞/孔的密度接种于24孔板,在成骨培养基(DMEM+10%胎牛血清+50 μg/mL抗坏血酸+10 mM β-甘油磷酸钠)中培养。加入AZD2858(10 nM-100 nM),每3天更换一次培养基。第14天,裂解细胞检测ALP活性(以对硝基苯磷酸酯为底物,在405 nm处测定吸光度);收集上清液进行OCN ELISA检测。第7天提取总RNA,合成cDNA,通过qPCR检测Runx2、ALP、OCN的基因表达(以GAPDH为内参基因) [2] 2. 大鼠软骨细胞软骨分化实验:从2周龄大鼠关节软骨中分离原代软骨细胞,以5×10⁵个细胞/孔的密度接种于6孔板,在软骨诱导培养基(DMEM+10%胎牛血清+10 ng/mL TGF-β1)中培养。加入AZD2858(10 nM-100 nM),每2天更换一次培养基。第7天,固定细胞进行阿尔新蓝染色(计数软骨细胞簇)或裂解细胞进行Western blot分析(一抗为抗Ⅱ型胶原抗体,以β-肌动蛋白为上样对照) [2] |
| 动物实验 |
Each rat is dosed orally with vehicle or AZD2858 using a plastic gavage tube. The dosage is 10 mL/kg. Deionized water that has been pH-adjusted to 3.50.1 makes up the vehicle. pH 3.50.1 is adjusted for formulations. The doses are 0, 0.2, 2, or 20 mg/kg administered either twice daily (TD), once daily (OD), every other day (O/2D), or every fourth day (O/4D) for a total of 14 days. The protocol yields 13 groups with an average of 8 animals each (104 animals total). Each animal receives a subcutaneous injection of a bicarbonate buffered calcein solution (8 mg/kg, 1 mL/kg)[1] at 7 days following the study's start and once more 2 days before the planned terminal necropsy.
1. Rat tibial fracture model: Male Sprague-Dawley rats (250-300 g) were anesthetized, and a transverse fracture was created in the right tibia using a bone saw, followed by intramedullary pin fixation. Rats were randomly divided into 2 groups (n=10/group): vehicle (0.5% methylcellulose, oral gavage) and AZD2858 (30 mg/kg, suspended in 0.5% methylcellulose, oral gavage). Dosing was performed once daily for 21 days. On days 7, 14, and 21, 3 rats per group were euthanized: the fractured tibias were harvested for Micro-CT analysis (to measure BV/TV and BMD), histological staining (H&E, Masson’s trichrome, immunohistochemistry for OCN and type II collagen), and biomechanical testing (three-point bending test to measure ultimate load and stiffness) [2] |
| 药代性质 (ADME/PK) |
1. In male Sprague-Dawley rats, oral administration of AZD2858 (30 mg/kg) showed an oral bioavailability of ~40%. The peak plasma concentration (Cₘₐₓ) was ~250 ng/mL, achieved at ~1 hour (Tₘₐₓ) post-dosing. The elimination half-life (t₁/₂) was ~3.2 hours. Tissue distribution analysis (1 hour post-dosing) showed that the drug accumulated in the bone (femur, ~180 ng/g) and liver (~320 ng/g), with lower concentrations in the kidney (~80 ng/g) and muscle (~60 ng/g) [2]
|
| 毒性/毒理 (Toxicokinetics/TK) |
1. In the 21-day rat fracture study (30 mg/kg, oral), AZD2858 caused no significant changes in body weight (weekly measurement: drug group gained ~15% vs. ~14% in vehicle group) or serum markers of liver (ALT, AST) and kidney function (creatinine, urea nitrogen) compared to the vehicle group [2]
2. Histopathological examination of major organs (liver, kidney, spleen, heart) from AZD2858-treated rats (day 21) showed no abnormal lesions (e.g., inflammation, necrosis) vs. vehicle [2] 3. Plasma protein binding of AZD2858 was ~90% in rat plasma (measured via equilibrium dialysis) [2] |
| 参考文献 |
|
| 其他信息 |
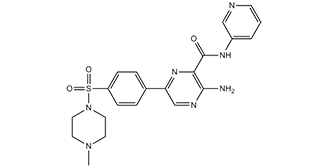
AZD2858 is a member of the class of pyrazines that is pyrazine substituted by (pyridin-3-yl)aminocarbonyl, amino, and 4-(4-methylpiperazine-1-sulfonyl)phenyl groups at positions 2, 3 and 6, respectively. It is a potent inhibitor of GSK3alpha and GSK3beta (IC50 values of 0.9 and 4.9 nM, respectively) and increases bone mass (via Wnt activation) in rats. It has a role as an EC 2.7.11.26 (tau-protein kinase) inhibitor, an antineoplastic agent, a bone density conservation agent and a Wnt signalling activator. It is a member of pyrazines, a secondary carboxamide, a member of pyridines, a N-methylpiperazine, a sulfonamide and an aromatic amine.
1. AZD2858 exerts its osteogenic effects by inhibiting GSK3, which stabilizes β-catenin and activates the Wnt/β-catenin signaling pathway. This activation promotes the differentiation of mesenchymal stem cells into osteoblasts and suppresses their differentiation into chondrocytes, leading to "direct" bone formation without endochondral ossification during fracture healing [2] 2. The ability of AZD2858 to accelerate fracture healing and increase bone mass (without cartilage intermediate) suggests potential therapeutic applications in conditions requiring rapid bone repair (e.g., traumatic fractures) and osteoporosis [2] 3. AZD2858 is an orally active GSK3 inhibitor, which offers advantages over injectable bone-forming agents (e.g., parathyroid hormone) in terms of patient compliance [2] |
| 分子式 |
C21H23N7O3S
|
|---|---|
| 分子量 |
453.5174
|
| 精确质量 |
453.158
|
| 元素分析 |
C, 55.62; H, 5.11; N, 21.62; O, 10.58; S, 7.07
|
| CAS号 |
486424-20-8
|
| 相关CAS号 |
2108876-05-5 (HCl);486424-21-9 (xHCl);486424-20-8;
|
| PubChem CID |
10138980
|
| 外观&性状 |
Green to khaki solid powder
|
| 密度 |
1.4±0.1 g/cm3
|
| 折射率 |
1.663
|
| LogP |
2.97
|
| tPSA |
146.28
|
| 氢键供体(HBD)数目 |
2
|
| 氢键受体(HBA)数目 |
9
|
| 可旋转键数目(RBC) |
5
|
| 重原子数目 |
32
|
| 分子复杂度/Complexity |
730
|
| 定义原子立体中心数目 |
0
|
| SMILES |
S(C1C([H])=C([H])C(C2=C([H])N=C(C(C(N([H])C3=C([H])N=C([H])C([H])=C3[H])=O)=N2)N([H])[H])=C([H])C=1[H])(N1C([H])([H])C([H])([H])N(C([H])([H])[H])C([H])([H])C1([H])[H])(=O)=O
|
| InChi Key |
FHCSBLWRGCOVPT-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C21H23N7O3S/c1-27-9-11-28(12-10-27)32(30,31)17-6-4-15(5-7-17)18-14-24-20(22)19(26-18)21(29)25-16-3-2-8-23-13-16/h2-8,13-14H,9-12H2,1H3,(H2,22,24)(H,25,29)
|
| 化学名 |
3-amino-6-[4-[(4-methyl-1-piperazinyl)sulfonyl]phenyl]-N-3-pyridinyl-2-pyrazinecarboxamid
|
| 别名 |
AZD-2858; AZD2858; AZD 2858
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO: ~7 mg/mL (15.43 mM)
Water: <1 mg/mL Ethanol: <1 mg/mL |
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: 1.25 mg/mL (2.76 mM) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 悬浮液;超声助溶。
例如,若需制备1 mL的工作液,可将100 μL 12.5 mg/mL澄清的DMSO储备液加入到400 μL PEG300中,混匀;再向上述溶液中加入50 μL Tween-80,混匀;然后加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 1.25 mg/mL (2.76 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 12.5 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: 30% PEG400+0.5% Tween80+5% propylene glycol: 30 mg/mL 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.2050 mL | 11.0249 mL | 22.0497 mL | |
| 5 mM | 0.4410 mL | 2.2050 mL | 4.4099 mL | |
| 10 mM | 0.2205 mL | 1.1025 mL | 2.2050 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
Expression of TAZ and Osterix, markers of commitment to osteoblastogenesis in human ADSC. Toxicol Appl Pharmacol. 2013 Oct 15;272(2):399-407 |
Time course of serum bone turnover biomarkers and femur histopathology changes with AZD2858 dosed orally for 3, 7, 14, 21 or 28 days |