| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| Other Sizes |
|
| 靶点 |
Ca2+ chelator; hERG channel
|
||
|---|---|---|---|
| 体外研究 (In Vitro) |
通过螯合细胞内 Ca2+,BAPTA-AM上调降低的心脏钠电流 (INa) 密度并抑制神经元 Ca2+ 激活的 K+ 通道电流[1]。在小鼠皮质培养物中,脂氧合酶介导的自由基会导致迟发性坏死,这是由细胞内钙螯合剂 BAPTA-AM (BAPTA/AM) 诱导的。 BAPTA-AM 保护神经元免受缺血损伤,防止自由基介导的毒性并促进非神经元细胞死亡,同时对神经元细胞也有积极作用。此外,有人提出,BAPTA-AM 在较晚的时间而不是较早的时间引起 I-IL-60 肿瘤细胞中细胞内钙的增加。 24 或 48 小时后,乳酸脱氢酶 (LDH) 释放到沐浴介质中的量增加,表明在接受 10 μM BAPTA-AM处理的混合皮质细胞培养物 (DIV 13-16) 中存在中度 (45-70%) 神经元损伤。暴露于 3–10 μM BAPTA–AM 48 小时会导致皮质培养物中剂量依赖性神经元损伤[2]。
BAPTA-AM是一种众所周知的膜渗透性钙螯合剂。本研究发现,BAPTA-AM能够快速且可逆地抑制HEK 293细胞中稳定表达的人乙醚a-go-related基因(hERG或Kv11.1.1)K(+)电流、人Kv1.3和人Kv1.5通道电流,且其作用与Ca(2+)螯合无关。外部应用的BAPTA-AM以浓度依赖的方式抑制hERG通道(IC(50):1.3微摩)。hERG通道的阻断依赖于通道的开放,而强直性阻断最小。应用3微摩 BAPTA-AM后,hERG通道的稳态激活V(0.5)负移8.5 mV(从对照的-3.7+/-2.8到-12.2+/-3.1 mV,P<0.01),而失活V(0.5。此外,BAPTA-AM以浓度依赖的方式抑制hKv1.3和hKv1.5通道(IC(50):分别为1.45和1.23微摩),这两种通道的阻断也取决于通道的开放。此外,EGTA-AM被发现是hERG、hKv1.3、hKv1.5通道的开放通道阻断剂,尽管其疗效弱于BAPTA-AM。这些结果表明,膜渗透性Ca(2+)螯合剂BAPTA-AM(也称为EGTA-AM)对hERG、hM1.3和hKv1.5渠道具有开放通道阻断作用。[1] 1.已知神经退行性疾病期间钙稳态的破坏会引发神经元细胞的凋亡或坏死死亡。最近,作者报道了NMDA受体拮抗剂对细胞内钙的限制诱导了皮质培养物的凋亡。为了评估进一步限制细胞内游离钙是否会诱导细胞凋亡或坏死,我们研究了小鼠皮质培养物中渗透性游离钙螯合剂BAPTA-AM的神经毒性特征。2.将混合(胶质细胞和神经元)皮质培养物(DIV 13-16)暴露于3-10 microMBAPTA-AM(胶质细胞无毒浓度)24-48小时,导致神经元延迟坏死死亡。坏死结果包括用BAPTA/AM治疗24小时后线粒体和内质网(ER)肿胀和丢失,神经元膜破裂。同时,我们在相同培养物的神经元亚群中观察到一些TUNEL阳性细胞。3.BAPTA/AM(10微摩)引起的神经毒性通过添加0.5微摩的环己酰亚胺(一种蛋白质合成抑制剂)、10微摩的放线菌素D(一种RNA转录抑制剂)、高细胞外钾浓度(总15 mM KCl)、100微摩的t-ACPD(一个代谢激动剂)、100微摩的α-生育酚(一种自由基清除剂)、100%的去铁胺(一种铁离子螯合剂)、10%的L-NAME(一种一氧化氮合酶(NOS)抑制剂)、50%的DNQX(一种非NMDA受体阻断剂)和3-30%的esculetin(一种脂肪氧化酶抑制剂)而显著减弱。然而,0.3-3mM ASA(一种环氧化酶抑制剂)、100ng/ml神经生长因子(NGF)、10μM MK-801(一种NMDA受体拮抗剂)、20μM zVAD-fmk(胱天蛋白酶抑制剂)和50U/ml过氧化氢酶未能抑制损伤。4.然而,NGF和过氧化氢酶阻断了BAPTA/AM在年轻神经元细胞(DIV 6)中诱导的神经毒性。BAPTA/AM(10微摩)不会改变神经胶质细胞上诱导型一氧化氮合酶(iNOS)的表达。5.这些结果表明,BAPTA-AM诱导的神经元死亡特征主要表现为由脂氧合酶依赖性自由基介导的延迟坏死[2]。 |
||
| 体内研究 (In Vivo) |
BAPTA-AM 消除 UDCA 和 TUDCA 诱导的 Ca2+ 水平或 Ca2+ 依赖性 PKC-α 磷酸化的增加,并中和 UDCA 和 TUDCA 对 BDL 大鼠迷走神经切断术诱导的胆管树损伤的细胞保护作用。
|
||
| 酶活实验 |
BAPTA-AM是一种众所周知的膜渗透性Ca2+螯合剂。本研究发现,BAPTA-AM可快速、可逆地抑制HEK 293细胞中稳定表达的人醚a-go-go相关基因(hERG或Kv11.1) K+电流、人Kv1.3和人Kv1.5通道电流,且其作用与Ca2+螯合作用无关。外用BAPTA-AM以浓度依赖性的方式抑制hERG通道(IC50: 1.3 μM)。hERG通道的阻断依赖于通道的开放,补药阻断最小。3 μM BAPTA-AM可使hERG通道稳态激活V0.5负移8.5 mV(由对照组的−3.7±2.8 mV负移至−12.2±3.1 mV, P < 0.01),灭活V0.5负移6.1 mV(由对照组的−37.9±2.0 mV负移至−44.0±1.6 mV, P < 0.05)。S6突变体Y652A和孔螺旋突变体S631A显著减弱BAPTA-AM在10 μM下的阻断作用,导致野生型hERG通道的深度阻断。此外,BAPTA-AM对hKv1.3和hKv1.5通道的抑制呈浓度依赖性(IC50分别为1.45 μM和1.23 μM),对这两类通道的阻断也依赖于通道的开放程度。EGTA-AM是hERG、hKv1.3、hKv1.5通道的开放通道阻滞剂,但其作用弱于BAPTA-AM。这些结果表明,膜渗透性Ca2+螯合剂BAPTA-AM(也称为EGTA-AM)对hERG、hKv1.3和hKv1.5通道具有开放通道阻断作用。[1]
|
||
| 细胞实验 |
细胞死亡评估[2]
如前所述(Koh和Choi,1987),通过测量在BAPTA-AM(或BAPTA/AM)治疗后24或48小时从受损细胞释放到浴介质中的乳酸脱氢酶(LDH)来定量评估神经元损伤。我们通过用神经元特异性烯醇化酶抗体和台盼蓝染色来证实形态学发现。 胶质细胞的蛋白质印迹分析[2] 使用从每个样品中提取的蛋白质进行蛋白质印迹。细胞在4°C下用1%Triton X-l 00、50 mM Tris、150 mM NaCl(pH 7.4)裂解20分钟。用细胞刮刀去除裂解的细胞,并在4°C下以120000g的浓度离心10分钟。去除上清液,通过Bradford(1970)的方法测定蛋白质浓度。用电泳样品缓冲液稀释上清液,使蛋白质浓度为3&PI,并在100°C下加热5分钟。在变性条件下,使用不连续程序在十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)中对样品进行电泳(Laemmli,1970)。电泳后,在4°C和30 V下,将蛋白质在转移缓冲液中电转移到PROTRAN@硝化纤维转移膜上过夜。转移的蛋白质在室温下用TBS中的5%BSA(50 mh4 Tris/HCl,20 nM NaCl,pH 7.4,含5%牛血清白蛋白)封闭2小时。通过在4°C的潮湿室中用第一抗体(用TBS稀释的兔抗iNOS,1:1000)孵育膜过夜来检测诱导性NOS。在TBS中洗涤后,将膜与山羊抗兔IgG-过氧化物酶偶联物(在TBS 1:3000中稀释)在室温下孵育3小时。使用0.1%TBS中的1%3,3'-二氨基联苯胺HCl实现可视化。 1. 已知在神经退行性疾病期间钙稳态的破坏可引发神经元细胞凋亡或坏死死亡。最近,作者报道了NMDA受体拮抗剂对细胞内钙的限制可诱导皮层细胞凋亡。为了评估进一步限制细胞内游离钙是否会诱导细胞凋亡或坏死,我们在小鼠皮质培养物中检测了BAPTA-AM(一种渗透性游离钙螯合剂)的神经毒性特征。2. 将混合(胶质细胞和神经元)皮层培养物(DIV 13-16)暴露于3-10微摩BAPTA-AM(胶质细胞无毒浓度)中24-48小时,导致延迟和坏死的神经元死亡。在BAPTA/AM治疗24小时后,坏死表现为线粒体和内质网(ER)肿胀和丢失,神经元膜破裂。同时,我们在相同培养的神经元亚群中观察到一些tunel阳性细胞。3. 添加0.5 μ m环己亚胺(一种蛋白质合成抑制剂)、10 μ m放线菌素D(一种RNA转录抑制剂)、高细胞外钾浓度(总15 μ m KCl)、100 μ m t-ACPD(一种代谢激动剂)、100 μ m α -生育酚(一种自由基清除剂)、100 μ m去铁胺(一种铁离子螯合剂)、100 μ m L-NAME(一种一氧化氮合酶(NOS)抑制剂)、50微摩DNQX(一种非nmda受体阻断剂)和3-30微摩esculetin(一种脂氧合酶抑制剂)。然而,0.3-3 mM ASA(环氧化酶抑制剂)、100 ng/ml神经生长因子(NGF)、10 microM MK-801 (NMDA受体拮抗剂)、20 microM zVAD-fmk (caspase抑制剂)和50 U/ml过氧化氢酶均不能抑制损伤。4. 然而,NGF和过氧化氢酶阻断了BAPTA/AM对年轻神经细胞的神经毒性(DIV 6)。BAPTA/AM(10微米)对胶质细胞上诱导型一氧化氮合酶(iNOS)的表达没有影响。5. 这些结果表明,BAPTA/AM诱导的神经元死亡特征主要表现为脂氧化酶依赖性自由基介导的延迟坏死。[2] |
||
| 动物实验 |
|
||
| 参考文献 |
|
||
| 其他信息 |
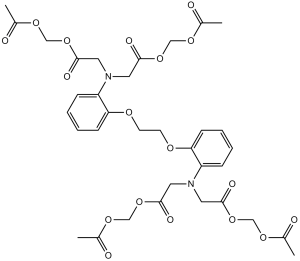
2-[N-[2-(acetyloxymethoxy)-2-oxoethyl]-2-[2-[2-[bis[2-(acetyloxymethoxy)-2-oxoethyl]amino]phenoxy]ethoxy]anilino]acetic acid acetyloxymethyl ester is an alpha-amino acid ester.
Previous studies reported that hERG, Kv1.3 and Kv1.5 channels could be regulated by PKC, and BAPTA-AM was reported to inhibit PKC. The present observation was involved in the study upon effect of PKC on these channels. However, possible effects of PKC could be excluded in the present observation because no effect was observed for these channels when BAPTA-AM was included in pipette solution. Collectively, our results support the notion that BAPTA-AM directly blocks hERG, Kv1.3 and Kv1.5 channels stably expressed in HEK 293 cells. In addition, EGTA-AM showed a blocking property similar to that of BAPTA-AM in hERG, Kv1.3 and Kv1.5 channels, although its efficacy is weaker than that of BAPTA-AM. In summary, the membrane permeable Ca2+ chelator BAPTA-AM (also EGTA-AM), in addition to the inhibition of hKv1.3 and hKv1.5 channels, directly blocks hERG channels. These effects are not related to intracellular chelation.[1] |
| 分子式 |
C34H40N2O18
|
|
|---|---|---|
| 分子量 |
764.68
|
|
| 精确质量 |
764.227
|
|
| 元素分析 |
C, 53.40; H, 5.27; N, 3.66; O, 37.66
|
|
| CAS号 |
126150-97-8
|
|
| 相关CAS号 |
|
|
| PubChem CID |
2293
|
|
| 外观&性状 |
White to off-white solid powder
|
|
| 密度 |
1.4±0.1 g/cm3
|
|
| 沸点 |
796.1±60.0 °C at 760 mmHg
|
|
| 熔点 |
86-90°C
|
|
| 闪点 |
435.3±32.9 °C
|
|
| 蒸汽压 |
0.0±2.8 mmHg at 25°C
|
|
| 折射率 |
1.551
|
|
| LogP |
2.28
|
|
| tPSA |
235.34
|
|
| 氢键供体(HBD)数目 |
0
|
|
| 氢键受体(HBA)数目 |
20
|
|
| 可旋转键数目(RBC) |
31
|
|
| 重原子数目 |
54
|
|
| 分子复杂度/Complexity |
1100
|
|
| 定义原子立体中心数目 |
0
|
|
| SMILES |
CC(=O)OCOC(=O)CN(CC(=O)OCOC(=O)C)C1=CC=CC=C1OCCOC2=CC=CC=C2N(CC(=O)OCOC(=O)C)CC(=O)OCOC(=O)C
|
|
| InChi Key |
YJIYWYAMZFVECX-UHFFFAOYSA-N
|
|
| InChi Code |
InChI=1S/C34H40N2O18/c1-23(37)47-19-51-31(41)15-35(16-32(42)52-20-48-24(2)38)27-9-5-7-11-29(27)45-13-14-46-30-12-8-6-10-28(30)36(17-33(43)53-21-49-25(3)39)18-34(44)54-22-50-26(4)40/h5-12H,13-22H2,1-4H3
|
|
| 化学名 |
Acetyloxymethyl 2-[N-[2-(acetyloxymethoxy)-2-oxoethyl]-2-[2-[2-[bis[2-(acetyloxymethoxy)-2-oxoethyl]amino]phenoxy]ethoxy]anilino]acetate
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (3.27 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: 2.5 mg/mL (3.27 mM) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 悬浊液; 超声助溶。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.5 mg/mL (3.27 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.3077 mL | 6.5387 mL | 13.0774 mL | |
| 5 mM | 0.2615 mL | 1.3077 mL | 2.6155 mL | |
| 10 mM | 0.1308 mL | 0.6539 mL | 1.3077 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
|
|
|