| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| 1g |
|
||
| Other Sizes |
|
| 靶点 |
Papain (IC50 = 9 nM)
|
|---|---|
| 体外研究 (In Vitro) |
体外活性:E-64快速抑制半胱氨酸蛋白酶组织蛋白酶B、H和L以及木瓜蛋白酶的活性,而对丝氨酸蛋白酶或金属蛋白酶没有影响。 E-64作为半胱氨酸蛋白酶的特异性抑制剂,在体外有效阻断卵巢癌细胞的侵袭。此外,E-64 还在体外表现出针对兰氏贾第鞭毛虫排泄的抗寄生虫活性。 E-64改善了牛体细胞核移植胚胎的着床前发育,这表明了E-64的另一个重要意义。激酶测定:使用 Z-Arg-Arg-4mβNA 作为底物并稍加修改来测定组织蛋白酶 B 活性。将粗提取物在含有 1 mM EDTA 和 5 mM DTT 的 50 mM 乙酸钠缓冲液(pH 5.0)中于 37°C 预孵育 5 分钟。添加底物(最终浓度,100 μM)以使最终测定体积为 1 mL。将反应混合物在 37°C 下孵育 30 分钟。通过添加等体积的含有 Fast Garnet GBC 盐 (1 mg/mL)、10 mM pHMB 和 50 mM EDTA(pH 6.0)的终止试剂来终止反应。用正丁醇萃取产物β-萘胺(β-NA)。完全层分离后,测量正丁醇层的吸光度,并使用 520 nm 处 31.5 M/cm/秒的 β-萘胺溶液摩尔消光系数计算活性。 1个酶活力单位定义为37℃下每分钟释放1μmol βNA的酶量。通过绘制不同浓度的 E-64 和组织蛋白酶 B 活性抑制百分比之间的图表来计算半数最大抑制浓度 (IC50)。这里,IC50表示将寄生组织蛋白酶B活性抑制一半所需的E-64浓度。细胞检测:E-64以剂量依赖性方式抑制H-59侵袭,在10μg/ml浓度时最大抑制率为97%,且无毒。用涂有 7.5 μg/过滤器 IV 型胶原蛋白的过滤器测量的细胞迁移仅减少了 25%,这表明在没有基底膜屏障的情况下,半胱氨酸蛋白酶在细胞迁移中发挥较小的作用。另一方面,即使浓度高达 100 μg/ml,E-64 处理也不会显着影响 M-27 侵袭。
|
| 体内研究 (In Vivo) |
E-64可显着减少M5076荷瘤小鼠的自发转移数量,但对实验性转移的形成没有影响。 E-64 还对感染小鼠中的贾第鞭毛虫排泄表现出抗寄生虫活性。
半胱氨酸组织蛋白酶是在肾脏和其他组织中表达的溶酶体酶,参与细胞蛋白质的成熟和分解。它们已被证明与许多心血管和肾脏疾病的进展密切相关。本研究的目的是确定半胱氨酸组织蛋白酶在盐敏感性高血压和相关肾损伤发展中的作用。在我们的实验中,Dahl盐敏感(SS)大鼠被喂食8%高盐NaCl饮食,并静脉注射不可逆半胱氨酸组织蛋白酶抑制剂E-64(1mg/天)或载体(对照组)。对照组和E-64输注组都出现了明显的高血压和肾损伤,两组之间的平均动脉压和高血压相关蛋白尿没有差异。接下来,我们使用共聚焦钙成像测试了对照组和输注组足突细胞中的基础钙水平。两组之间的基础钙没有差异,表明组织蛋白酶抑制缺乏保护性或加重性影响。通过蛋白质印迹法测试E-64的疗效。我们的发现与之前报道的E-64诱导组织蛋白酶B和L丰度增加的结果一致。我们得出结论,E-64对半胱氨酸组织蛋白酶的抑制对血压发展和肾脏损伤没有任何影响,至少在SS高血压模型的研究条件下是这样[4]。 然而,在蛋白酶抑制剂E-64存在的情况下接受抗丝氨酸蛋白酶抑制剂B13单克隆抗体的动物中,这种转变被消除了(图3,A和B),在所使用的实验条件下保持了其阻断活性(补充图S3)。这些变化在胰腺和PLN中观察到,但在远处淋巴器官(如腹股沟淋巴结)中没有观察到。总之,这些数据表明,蛋白酶活性对于抗丝氨酸蛋白酶抗体导致向表达低水平CD4和CD19的细胞转变很重要。 抗丝氨酸蛋白酶抑制剂B13单克隆抗体的作用可能并不完全反映天然抗丝氨酸蛋白酶制剂B13自身抗体水平升高的作用。为了解决这个问题,我们将NOD小鼠与不同水平的抗丝氨酸蛋白酶抑制剂B13自身抗体进行了比较。我们发现,与内源性抗丝氨酸蛋白酶抑制剂B13自身抗体水平较低的动物(SBAlow)相比,内源性抗丝氨酸酶抑制剂B13抗体水平较高的幼年动物(SBAhigh)的胰岛相关CD4high细胞群显著减少。然而,在接受蛋白酶抑制剂E-64的SBAhigh小鼠中,胰岛相关CD4high细胞的数量没有减少(图4)。这一观察表明,天然的抗丝氨酸蛋白酶抑制剂自身抗体在体内调节蛋白酶的方式与抗丝氨酸蛋白酶蛋白酶抑制剂B13单克隆抗体相似[3]。 |
| 酶活实验 |
Z-Arg-Arg-4mβNA 经过一些修改,用作测量组织蛋白酶 B 活性的底物。50 mM 乙酸钠缓冲液,pH 5.0,含有 1 mM EDTA 和 5 mM DTT,与粗提物在 37°C 下反应 5 分钟。通过添加底物(最终浓度,100 μM)将测定体积增加至 1 mL。将反应混合物在 37°C 下孵育三十分钟。添加等体积的含有 50 mM EDTA、pH 6.0 和 10 mM pHMB、Fast Garnet GBC 盐 (1 mg/mL) 的终止试剂以终止反应。萃取过程中使用正丁醇产生产物β-萘胺(β-NA)。各层完全分离后,测量正丁醇层的吸光度,并使用 β-萘胺溶液的摩尔消光系数计算活性,该系数在 520 nm 处为 31.5 M/cm 每秒。酶的活性以 37°C 下每分钟释放 1 μmol βNA 为单位进行测量。绘制不同 E-64 浓度和组织蛋白酶 B 活性抑制百分比之间的图表,得出半数最大抑制浓度或 IC50。这里,IC50 表示将寄生组织蛋白酶 B 活性降低一半所需的 E-64 浓度[2]。
|
| 细胞实验 |
E-64对H-59入侵表现出剂量依赖性抑制作用,在无毒浓度10μg/ml时达到97%的最大抑制率。当使用涂有 7.5 μg/滤膜 IV 型胶原蛋白的滤膜测量细胞迁移时,减少幅度仅为 25%,表明在没有基底膜屏障的情况下,半胱氨酸蛋白酶对细胞迁移的影响相对不显着。然而,即使浓度高达 100 μg/ml,E-64 处理也不会显着改变 M-27 侵袭。
蠕虫接触E-64[2] 相等的数字(n = 10) 在37°C和5%CO2的条件下,将成年雌性S.cervi在含有不同浓度E-64(终浓度为10μM、20μM和40μM)的20ml KRB维持培养基中孵育8小时。在维持培养基中孵化的蠕虫仅作为对照。8小时后,回收蠕虫,用PBS彻底洗涤,均质化并测定各种酶活性。 对寄生虫运动的影响[2] 通过目视检查寄生虫的运动能力。在含有E-64的培养基中孵育的寄生虫被目视评估至8小时,并根据其运动能力得分为阳性或阴性(+/-)。8小时后,通过将蠕虫保持在新鲜培养基(不含E-64)中1小时来记录运动的恢复。寄生虫运动评分为-,无运动;+,最不活跃;++,不太活跃;+++,中度活跃;++++,高度活跃。为了检查E-64对微丝蚴(mf)的影响,纵向解剖成年雌性寄生虫,将释放的mf收集在KRB维持培养基中,并在40×(Motic B1系列)显微镜下观察。 对寄生虫存活率的影响[2] 根据Mosmann等人1988年的方法进行MTT法测定寄生虫存活率,并稍作修改。将处理过的蠕虫在37°C下在含有1.0 ml 0.5 mg/ml MTT[3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑]的磷酸盐缓冲盐水(PBS)中孵育2小时。然后将蠕虫转移到含有200μl二甲基亚砜(DMSO)的新鲜eppendorf中,以溶解甲赞晶体。1小时后,在不干扰深蓝色甲赞晶体的情况下小心去除培养基。在波长为540nm的微孔板读数器(BioRad)上测定所得甲赞溶液的光密度。通过绘制治疗8小时后E-64浓度与成年寄生虫存活率之间的图表,计算出E-64的半最大有效浓度(EC50)。这里,EC50是指在指定的孵育时间后,观察到50%的最大效果或50%的寄生虫存活率降低的抑制剂浓度。 组织蛋白酶B半胱氨酸蛋白酶的检测[2] 组织蛋白酶Β活性通过Barrett(1977)的比色法测定,使用Z-Arg-Arg-4mβNA作为底物,稍作修改。将粗提取物在含有1 mM EDTA和5 mM DTT的50 mM醋酸钠缓冲液(pH 5.0)中在37°C下预孵育5分钟。加入底物(终浓度,100μM),使最终测定体积为1.0 ml。将反应混合物在37°C下孵育30分钟。通过加入等体积的含有Fast Garnet GBC盐(1 mg/ml)、10 mM pHMB和50 mM EDTA(pH 6.0)的终止试剂终止反应。产物β-萘乙胺(β-NA)用正丁醇提取。完全分层后,在正丁醇层中测量吸光度,并使用β-萘乙胺溶液在520 nm下的摩尔消光系数31.5 M−1cm−1秒−1计算活性。一个单位的酶活性被定义为在37°C下每分钟释放1μmolβNA的酶量。通过绘制不同浓度的E-64与组织蛋白酶B活性抑制百分比之间的图来计算半最大抑制浓度(IC50)。这里,IC50表示将寄生组织蛋白酶B活性抑制一半所需的E-64浓度。 E-64对谷胱甘肽的体外作用[2] 为了观察E-64对GSH的影响,在添加DTNB之前,将10μM GSH与不同浓度的E-64(5、10、20、40μM)在37°C下孵育20分钟。以一组没有E-64的作为对照。此外,加入1.88 ml 0.1 M磷酸钾缓冲液(pH 8.0)和0.02 ml 4%DTNB,使反应体积达到2 ml,并在室温下孵育15分钟以显色。在412nm处记录显色的吸光度。 |
| 动物实验 |
Mice: The effects of treatment with anti-serpin B13 monoclonal antibody (mAb) are investigated in NOD/LtJ and BDC2.5 T cell receptor (TCR) transgenic mice. 100 μg of anti-serpin B13 mAb is injected intravenously four times over a ten-day period into four-week-old female NOD/LtJ mice. Furthermore, during the same time frame, a few animals receive intraperitoneal injections of the protease inhibitor E64 at a daily dose of 10 mg/kg for a few days. Diluent, a sterile PBS solution containing 10% DMSO, is administered to control mice along with control IgG. Before being used, the solutions containing DMSO or E64 are quickly made. When the mice are killed 24 hours after the last injection, cells from their pancreatic islets and lymphoid organs are subjected to FACS analysis.
Rats: Male Dahl Salt Sensitive rats (SS/JrHsdMcwi) aged seven weeks are utilized. In summary, the left femoral artery and vein of eight-week-old anesthetized SS rats are catheterized. The arterial line is connected to a heparinized saline infusion pump that is in line with a blood pressure transducer, and the venous line is connected to a saline infusion pump. Both catheters are fixed and exteriorized from the back of the neck. Animals can move 360 degrees thanks to a tether-swivel system. Rats that were conscious and able to move around were prepared to receive a chronic venous infusion and have their arterial blood pressure measured. Four days are needed to establish a stable baseline blood pressure before introducing E-64 (1 mg/day; 280 mM stock in DMSO) or the vehicle (DMSO in saline) control at the same time to the venous catheter in both groups. The daily MAP is computed by taking an average of the MAP measurements made every minute during the first three hours of the rat sleep cycle. Treatment of NOD/LtJ Mice with Anti-serpin B13 mAb and Protease Inhibitor [3] Four-week-old female NOD/LtJ mice were injected intravenously four times over a period of 10 days with anti-serpin B13 mAb (100 μg/injection). In addition, during the same period, some animals were also injected intraperitoneally with the protease inhibitor E-64 at 10 mg/kg/day for several days. Control mice were treated with diluent (a sterilized PBS solution containing 10% dimethyl sulfoxide) and control IgG. The solutions containing E-64 or dimethyl sulfoxide were prepared immediately before use. Twenty-four hours after the last injection, the mice were killed, and cells from their lymphoid organs and pancreatic islets were subjected to FACS analysis. Chronic instrumentation for venous infusion and blood pressure measurement [4] Chronic instrumentation of rats for venous infusion and blood pressure measurements was done as described previously. Briefly, 8‐week old anesthetized SS rats had their left femoral artery and vein catheterized. Both catheters were fixed and exteriorized from the back of the neck and the arterial line was connected to a heparinized saline infusion pump that was in line with a blood pressure transducer, and the venous line was connected to a saline infusion pump. Animals were allowed 360° movement using a tether‐swivel system. This preparation allowed chronic venous infusion and arterial blood pressure measurement in conscious, freely moving rats. A stable baseline blood pressure was obtained for 4 days prior to switching both groups to an 8.0% NaCl diet and the simultaneous addition of N‐[N‐(L‐3‐trans‐carboxyox‐irane‐2‐carbonyl)‐L‐leucyl]‐agmatine (E-64, 1 mg/day; 280 mmol/L stock in DMSO) or the vehicle (DMSO in saline) control to the venous catheter. Daily MAP was calculated by averaging MAP taken every min over the beginning 3 h period of the rat sleep cycle. |
| 参考文献 |
|
| 其他信息 |
E64 is an epoxy monocarboxylic acid, a dicarboxylic acid monoamide, a member of guanidines and a L-leucine derivative. It has a role as a protease inhibitor, an antimalarial and an antiparasitic agent. It is a tautomer of an E64 zwitterion.
Background: Current available antifilarial drug strategies only eliminate the larval stages of filarial parasites. Therefore, there is an urgent need of drugs which are macrofilaricidals. Identification of molecular targets crucial for survival of parasite is a prerequisite for drug designing. Cathepsin B, a cysteine protease family member is known to play crucial role in the normal growth, digestion of nutrients, exsheathment of the helminth parasites. Therefore, we targeted this enzyme in the filarial parasite using its specific inhibitor, E-64. Methods and findings: We have exposed the parasites to E-64 and observed their motility and viability at various time intervals. It caused marked decrease in the motility and viability of the parasites ultimately leading to their death after 8 hours. It is well known that E-64 protects the cell from apoptosis, however, it causes apoptotic effect in carcinoma cell lines. To understand the mechanism of action of E-64 on parasite survival, we have measured levels of different apoptotic markers in the treated parasites. E-64 significantly reduced the level of ced-9 and activity of tyrosine phosphatases, cytochrome c oxidase. It also activated ced-3, homolog of mammalian caspase 3 suggesting initiation of an apoptotic like event in the filarial parasites. Different antioxidant enzymes were also evaluated to further explore the mechanism behind the death of the parasites. There was marked decrease in the level of GSH and activity of Glutathione reductase and glutathione-s-transferase leading to increased generation of reactive oxygen species. This led to the induced oxidation of fatty acids and protein which might alter the mitochondrial membrane permeability. Conclusion: This study suggests that inhibition of cathepsin B by E-64 generates oxidative stress followed by mitochondrial mediated apoptotic like event in filarial parasites leading to their death. Hence, suggesting filarial cathepsin B as a potential chemotherapeutic target for lymphatic filariasis. [2] This paper focuses on the inhibitory mechanism of E-64 and its derivatives (epoxysuccinyl-based inhibitors) with some cysteine proteases, based on the binding modes observed in the x-ray crystal structures of their enzyme-inhibitor complexes. E-64 is a potent irreversible inhibitor against general cysteine proteases, and its binding modes with papain, actinidin, cathepsin L, and cathepsin K have been reviewed at the atomic level. E-64 interacts with the Sn subsites of cysteine proteases. Although the Sn-Pn (n = 1-3) interactions of the inhibitor with the main chains of the active site residues are similar in respective complexes, the significant difference is observed in the side-chain interactions of S2-P2 and S3-P3 pairs because of different residues constituting the respective subsites. E-64-c and CA074 are representative derivatives developed from E-64 as a clinical usable and a cathepsin B-specific inhibitors, respectively. In contrast with similar binding/inhibitory modes of E-64-c and E-64 for cysteine proteases, the inhibitory mechanism of cathepsin B-specific CA074 results from the binding to the Sn' subsite.[1] |
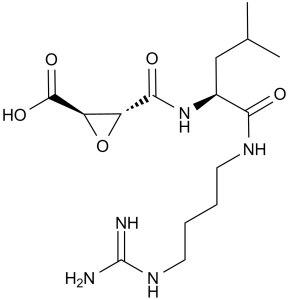
| 分子式 |
C15H27N5O5
|
|
|---|---|---|
| 分子量 |
357.41
|
|
| 精确质量 |
357.201
|
|
| 元素分析 |
C, 50.41; H, 7.61; N, 19.60; O, 22.38
|
|
| CAS号 |
66701-25-5
|
|
| 相关CAS号 |
|
|
| PubChem CID |
123985
|
|
| 外观&性状 |
White to off-white solid powder
|
|
| 密度 |
1.4±0.1 g/cm3
|
|
| 熔点 |
182ºC
|
|
| 折射率 |
1.618
|
|
| LogP |
-1.46
|
|
| tPSA |
169.93
|
|
| 氢键供体(HBD)数目 |
5
|
|
| 氢键受体(HBA)数目 |
6
|
|
| 可旋转键数目(RBC) |
11
|
|
| 重原子数目 |
25
|
|
| 分子复杂度/Complexity |
518
|
|
| 定义原子立体中心数目 |
3
|
|
| SMILES |
O=C([C@H]1O[C@@H]1C(N[C@H](C(NCCCCNC(N)=N)=O)CC(C)C)=O)O
|
|
| InChi Key |
LTLYEAJONXGNFG-DCAQKATOSA-N
|
|
| InChi Code |
InChI=1S/C15H27N5O5/c1-8(2)7-9(20-13(22)10-11(25-10)14(23)24)12(21)18-5-3-4-6-19-15(16)17/h8-11H,3-7H2,1-2H3,(H,18,21)(H,20,22)(H,23,24)(H4,16,17,19)/t9-,10-,11-/m0/s1
|
|
| 化学名 |
(2S,3S)-3-[[(2S)-1-[4-(diaminomethylideneamino)butylamino]-4-methyl-1-oxopentan-2-yl]carbamoyl]oxirane-2-carboxylic acid
|
|
| 别名 |
E 64; E64; Proteinase inhibitor E 64; (2S,3S)-3-(((S)-1-((4-Guanidinobutyl)amino)-4-methyl-1-oxopentan-2-yl)carbamoyl)oxirane-2-carboxylic acid; CHEMBL374508; E 64; CHEBI:30270; E64; E-64
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (6.99 mM) (饱和度未知) in 10% DMSO + 90% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
*生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.08 mg/mL (5.82 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 20.8 mg/mL澄清的DMSO储备液加入到400 μL PEG300中,混匀;再向上述溶液中加入50 μL Tween-80,混匀;然后加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.08 mg/mL (5.82 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 配方 4 中的溶解度: ≥ 2.08 mg/mL (5.82 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,您可以将 100 μL 20.8 mg/mL 澄清 DMSO 储备液添加到 900 μL 玉米油中并混合均匀。 配方 5 中的溶解度: 50 mg/mL (139.90 mM) in PBS (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液; 超声助溶. 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.7979 mL | 13.9895 mL | 27.9791 mL | |
| 5 mM | 0.5596 mL | 2.7979 mL | 5.5958 mL | |
| 10 mM | 0.2798 mL | 1.3990 mL | 2.7979 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。