| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| Other Sizes |
| 靶点 |
GBF1
Golgicide A (GCA) specifically targets Golgi-specific brefeldin A-resistance guanine nucleotide exchange factor 1 (GBF1), a key regulator of Arf1 (ADP-ribosylation factor 1) activation in Golgi vesicle trafficking. The IC₅₀ for inhibiting GBF1-mediated Arf1 GDP-GTP exchange activity is 200 nM [1,3] |
|---|---|
| 体外研究 (In Vitro) |
体外活性:Golgicide A 抑制志贺毒素对蛋白质合成的影响,IC50 为 3.3 μM。 Golgicide A 会导致 GBF1 介导的 Arf1 激活减少,阻止可溶性蛋白和膜锚定蛋白的分泌,然后损害逆行毒素转运。 Golgicide A 降低 FLRP1 细胞和 J6/JFH1 细胞中的 HCV RNA 水平。此外,Golgicide A 会导致 NS5A 重新分布以及 J6/JFH1 细胞中感染性病毒颗粒的积累。细胞测定:Golgicide A 抑制志贺毒素对 Vero 细胞中蛋白质合成的影响,IC50 为 3.3 μM。免疫荧光实验表明,Golgicide A 导致内侧高尔基体标记 Giantin 和顺式高尔基体标记 GM130 完全分散,并导致 COPI 从高尔基体快速重新分配。此外,Golgicide A 会导致 GBF1 介导的 Arf1 激活减少,损害逆行毒素转运并阻止可溶性蛋白和膜锚定蛋白的分泌。 Golgicide A 降低 HCV RNA 水平并导致 NS5A 在 FLRP1 细胞和 J6/JFH1 细胞中重新分布。此外,Golgicide A 会导致感染性病毒颗粒在 J6/JFH1 细胞中积聚。
高尔基体结构与功能破坏:1 μM GCA处理HeLa细胞1小时,导致高尔基体碎片化(通过高尔基体标志物GM130的免疫荧光染色观察),>90%的细胞呈现分散的GM130信号,而对照组为完整的高尔基体堆叠。同时,蛋白分泌(通过碱性磷酸酶分泌测定)减少70% [1,3] - 病毒复制抑制(黄病毒科):GCA在Huh7细胞中抑制登革病毒(DENV)血清型2复制,EC₅₀为350 nM(空斑减少实验,处理48小时)。1 μM浓度时,病毒RNA水平(qRT-PCR)降低90%,病毒包膜蛋白表达(Western blot)减少85% [2] - 对黄热病毒(YFV)和西尼罗河病毒(WNV)的抑制:在Vero细胞中,GCA的空斑减少实验EC₅₀分别为280 nM(YFV)和320 nM(WNV)。1 μM GCA处理72小时后,YFV感染滴度降低5 log₁₀ PFU/mL,WNV滴度降低4.5 log₁₀ PFU/mL [4] - 选择性细胞毒性:GCA对Huh7和Vero细胞的细胞毒性较低,MTT实验(72小时处理)显示CC₅₀分别为12 μM和15 μM,治疗指数(CC₅₀/EC₅₀)约为34(DENV)和43(YFV) [2,4] |
| 体内研究 (In Vivo) |
不适用
登革病毒感染小鼠模型疗效:AG129小鼠(IFN-α/β和IFN-γ受体缺陷)腹腔注射1×10⁴ PFU DENV-2。感染后1小时开始用GCA(50 mg/kg,腹腔注射,每日2次)治疗,结果:(1)第14天存活率为60%(溶剂对照组为10%);(2)第3天血清和第5天肝脏中的病毒载量(qRT-PCR)降低10倍;(3)肝脏病理改善(坏死和炎症减轻) [2] |
| 酶活实验 |
GBF1介导的Arf1 GDP-GTP交换实验(文献[1,3]):
1. 蛋白制备:从大肠杆菌中纯化重组人源GBF1(1-1397残基)和Arf1。Arf1通过与1 mM GDP、20 mM EDTA和50 mM Tris-HCl(pH 7.5)在30°C孵育30分钟加载GDP,然后用40 mM MgCl₂稳定 [1,3] 2. 反应体系:200 μL反应混合液含50 mM Tris-HCl(pH 7.5)、1 mM DTT、1 mM MgCl₂、50 nM GBF1、1 μM GDP加载的Arf1和0.5 μM [³⁵S]GTPγS。加入系列浓度GCA(10 nM–10 μM),以DMSO为溶剂对照 [1,3] 3. 动力学测定:混合液在30°C孵育,分别于0、5、10、20和30分钟取出20 μL样品。样品通过硝酸纤维素膜过滤,用缓冲液(50 mM Tris-HCl pH 7.5、25 mM MgCl₂)洗涤,结合的[³⁵S]GTPγS通过液体闪烁计数定量 [1,3] 4. 数据分析:计算GTPγS结合速率,从抑制效率与GCA浓度的剂量-反应曲线确定IC₅₀(200 nM) [1,3] |
| 细胞实验 |
Golgicide A 抑制志贺毒素对 Vero 细胞中蛋白质合成的影响,IC50 为 3.3 μM。免疫荧光实验表明,Golgicide A 会导致内侧高尔基体标记 Giantin 和顺式高尔基体标记 GM130 完全分散,并导致 COPI 从高尔基体快速重新分配。此外,Golgicide A 会导致 GBF1 介导的 Arf1 激活减少,损害逆行毒素转运并阻止可溶性蛋白和膜锚定蛋白的分泌。 Golgicide A 降低 HCV RNA 水平并导致 NS5A 在 FLRP1 细胞和 J6/JFH1 细胞中重新分布。此外,Golgicide A 会导致感染性病毒颗粒在 J6/JFH1 细胞中积聚。
免疫荧光分析高尔基体结构(文献[1,3]): 1. 细胞接种与处理:HeLa细胞接种于6孔板中的盖玻片(5×10⁴个/孔),过夜培养。用1 μM GCA处理1小时,0.1% DMSO作为对照 [1,3] 2. 固定与染色:细胞用4%多聚甲醛(PFA)室温固定15分钟,0.1% Triton X-100透化5分钟,3% BSA/PBS封闭30分钟。抗GM130(高尔基体标志物)一抗4°C孵育过夜,Alexa Fluor标记二抗室温孵育1小时。DAPI染色细胞核 [1,3] 3. 成像与定量:共聚焦显微镜采集荧光图像。高尔基体完整性分为“完整”(致密核周结构)或“碎片化”(分散点状)。每个样品计数至少100个细胞,计算高尔基体碎片化细胞的百分比 [1,3] - 病毒空斑减少实验(文献[2,4]): 1. 细胞与病毒制备:Huh7(用于DENV)或Vero(用于YFV/WNV)细胞接种于6孔板(2×10⁵个/孔),培养至80%汇合度。病毒储备液稀释至100–200 PFU/孔 [2,4] 2. 药物处理与感染:感染前1小时向细胞中加入GCA(系列浓度:10 nM–10 μM)。细胞与病毒在37°C孵育1小时,然后覆盖含相同GCA浓度的0.8%甲基纤维素培养基 [2,4] 3. 空斑染色与计数:48–72小时后(依病毒而定),细胞用4% PFA固定,0.1%结晶紫染色。计数空斑,EC₅₀定义为较对照组减少50%空斑数的浓度 [2,4] - 病毒蛋白Western blot(文献[2]): 1. 细胞处理与裂解:Huh7细胞感染DENV-2(MOI=1)后,用1 μM GCA处理24小时。细胞用含蛋白酶抑制剂的RIPA缓冲液裂解,裂解物12,000 × g离心15分钟 [2] 2. 检测:30 μg总蛋白经SDS-PAGE分离,转移至PVDF膜,用抗DENV包膜蛋白抗体和抗β-actin抗体(内参)检测。ECL显影并定量,显示包膜蛋白水平减少85% [2] |
| 动物实验 |
N/A N/A
DENV-infected AG129 mouse model (Literature [2]): 1. Animal selection and grouping: 6- to 8-week-old AG129 mice (n=10/group) were randomized into vehicle control and GCA treatment groups [2] 2. Infection and treatment: Mice were intraperitoneally injected with 1×10⁴ PFU DENV-2. GCA was dissolved in 10% DMSO + 90% corn oil to 10 mg/mL. The treatment group received 50 mg/kg GCA via intraperitoneal injection at 1 hour post-infection, then twice daily for 7 days; the control group received the same volume of vehicle [2] 3. Monitoring and sampling: Mice were monitored daily for survival and weight. On days 3 and 5, subsets of mice (n=3/group) were euthanized, and serum and liver tissues were collected for viral load quantification by qRT-PCR. Liver sections were stained with H&E for pathological analysis [2] |
| 毒性/毒理 (Toxicokinetics/TK) |
In vitro cytotoxicity: GCA showed CC₅₀ values of 12 μM (Huh7 cells) and 15 μM (Vero cells) in MTT assays (72-hour treatment), with no significant cytotoxicity at concentrations ≤1 μM (viability >90%) [2,4]
- In vivo acute toxicity: AG129 mice treated with 50 mg/kg GCA (intraperitoneal, twice daily for 7 days) showed no significant weight loss (<5% vs. baseline) and no gross pathological changes in major organs (liver, kidney, spleen) [2] - No data on plasma protein binding, LD₅₀, or drug-drug interactions of GCA was described in Literatures [1,2,3,4] |
| 参考文献 | |
| 其他信息 |
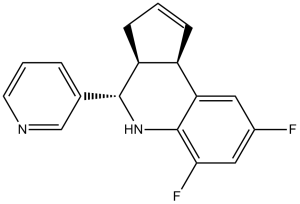
Golgicide A is a diastereoisomeric mixture comprising racemic cis- and racemic trans-goglioside A in a 10:1 ratio. It is a potent and rapidly reversible GBF1 (Golgi-specific brefeldin A-resistance guanine nucleotide exchange factor 1) inhibitor. The (3aS,4R,9bR) isomer is the most active (see Bioorg. Med. Chem. Lett., 2012, 22, 5177-5181). It has a role as a cis-Golgi ArfGEF GBF inhibitor. It contains a cis-golgicide A and a trans-golgicide A.
Mechanism of action: GCA binds to GBF1, inhibiting its guanine nucleotide exchange activity toward Arf1. This blocks Arf1 activation, disrupting COPI-mediated vesicle trafficking and causing Golgi fragmentation. For viruses (e.g., flaviviruses) that rely on Golgi machinery for replication and virion assembly, this leads to impaired viral maturation and release [1,2,3,4] - Selectivity over other Arf GEFs: GCA is selective for GBF1, with no significant inhibition of other Arf guanine nucleotide exchange factors (e.g., BIG1, BIG2) at concentrations up to 10 μM, as shown by in vitro exchange assays [1,3] - Research application: GCA is a valuable tool for studying Golgi dynamics, Arf1-mediated vesicle trafficking, and virus-Golgi interactions, particularly in understanding the role of host Golgi machinery in viral replication [1,2,3,4] |
| 分子式 |
C17H14F2N2
|
|
|---|---|---|
| 分子量 |
284.310
|
|
| 精确质量 |
284.113
|
|
| 元素分析 |
C, 71.82; H, 4.96; F, 13.36; N, 9.85
|
|
| CAS号 |
1139889-93-2
|
|
| 相关CAS号 |
Golgicide A-2;1394285-50-7;Golgicide A-1;1394285-49-4;(Rac)-Golgicide A;1005036-73-6
|
|
| PubChem CID |
25113626
|
|
| 外观&性状 |
White to off-white solid powder
|
|
| LogP |
4.324
|
|
| tPSA |
24.92
|
|
| 氢键供体(HBD)数目 |
1
|
|
| 氢键受体(HBA)数目 |
4
|
|
| 可旋转键数目(RBC) |
1
|
|
| 重原子数目 |
21
|
|
| 分子复杂度/Complexity |
414
|
|
| 定义原子立体中心数目 |
2
|
|
| SMILES |
C1C=CC2C1C(NC3=C2C=C(C=C3F)F)C4=CN=CC=C4
|
|
| InChi Key |
NJZHEQOUHLZCOX-FTLRAWMYSA-N
|
|
| InChi Code |
InChI=1S/C17H14F2N2/c18-11-7-14-12-4-1-5-13(12)16(10-3-2-6-20-9-10)21-17(14)15(19)8-11/h1-4,6-9,12-13,16,21H,5H2/t12-,13+,16?/m0/s1
|
|
| 化学名 |
(3aR,9bS)-6,8-difluoro-4-(pyridin-3-yl)-3a,4,5,9b-tetrahydro-3H-cyclopenta[c]quinoline
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : 57~100 mg/mL ( 200.49~351.74 mM )
Ethanol : 4 mg/mL |
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (8.79 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (8.79 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL 澄清 DMSO 储备液添加到 900 μL 玉米油中并混合均匀。 配方 3 中的溶解度: 10% DMSO+90% (20% SBE-β-CD in Saline): ≥ 2.5 mg/mL (8.79 mM) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 3.5173 mL | 17.5864 mL | 35.1729 mL | |
| 5 mM | 0.7035 mL | 3.5173 mL | 7.0346 mL | |
| 10 mM | 0.3517 mL | 1.7586 mL | 3.5173 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
| NCT Number | Recruitment | interventions | Conditions | Sponsor/Collaborators | Start Date | Phases |
| NCT06244069 | Not yet recruiting | Diagnostic Test: Temporal arterial biopsy Diagnostic Test: Whole exome sequencing |
Giant Cell Arteritis Temporal Arteritis |
ASST Fatebenefratelli Sacco | March 2024 | |
| NCT06271018 | Not yet recruiting | Giant Cell Arteritis Aortitis |
GMIOFrance | April 1, 2024 | ||
| NCT05749094 | Not yet recruiting | Diagnostic Test: Optic nerve ultrasound | Giant Cell Arteritis Anterior Ischemic Optic Neuropathy |
Hopital du Sacre-Coeur de Montreal | March 2024 | |
| NCT03725202 | Active, not recruiting | Drug: Upadacitinib Drug: Corticosteroid (CS) |
Giant Cell Arteritis (GCA) | AbbVie | January 24, 2019 | Phase 3 |