| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| Other Sizes |
|
| 靶点 |
I-CBP112 targets the bromodomains of CBP/p300 (histone acetyltransferases); cellular IC50 for displacing isolated CBP bromodomain is 600 ± 50 nM (NanoBRET assay) [2]
I-CBP112 shows in vitro IC50 for CBP bromodomain-H3K56ac peptide interaction (AlphaScreen assay) [2] I-CBP112 has no significant binding to BRD4(1)/BRD4(2) bromodomains (ITC assay) [2] |
|---|---|
| 体外研究 (In Vitro) |
I-CBP112 显着增强组蛋白 H3K18 和 H3K23 位点 p300 的乙酰化。 H3K18ac 被 I-CBP112 刺激约三倍,并且这些相同位点也经历了 CBP 和 H4K5 乙酰化的增加。 I-CBP112 的 EC50 小于 2 μM,可激活 p300 和 CBP 介导的 H3K18 乙酰化 [1]。 I-CBP112 治疗人和鼠白血病细胞系显着减少集落形成并诱导细胞分化,且似乎无害。 BioMAP 原代细胞组在暴露于 I-CBP112 后对细胞因子和标记蛋白的产生表现出不同的反应 [2]。
1. I-CBP112可将p300/CBP介导的核小体乙酰化水平提升至多3倍,而CBP30无此作用;该激活效应仅针对核小体底物,对分离的组蛋白H3底物无作用,其激活p300介导核小体乙酰化的EC50通过标准结合等温线拟合得出(重复实验,平均值±极差) [1] 2. I-CBP112(40 μM)改变p300催化核小体乙酰化的时间进程,乙酰化初始5分钟的线性阶段与对照组差异显著(p = 0.005);同时改变p300介导核小体乙酰化的浓度依赖性,拟合曲线与对照组差异极显著(p < 0.0001) [1] 3. I-CBP112对分离的p300 HAT结构域介导的核小体乙酰化无影响(单因素方差分析,p = 0.8535,n=3);CBP30可中和I-CBP112对p300/CBP的激活作用 [1] 4. 质谱和Western blot实验证实,I-CBP112特异性促进核小体中组蛋白H3第18位赖氨酸(H3K18)的乙酰化(p < 0.001),该位点是p300/CBP在体内的经典乙酰化位点;Western blot进一步验证,在含p300/CBP和核小体的体外反应体系中,I-CBP112可剂量依赖性提升H3K18乙酰化水平 [1] 5. I-CBP112在与抗增殖效应匹配的浓度范围内,可增强LNCaP(前列腺癌细胞)和KG1a(急性白血病细胞)中H3K18的乙酰化水平;其抑制LNCaP细胞增殖([³H]胸苷掺入法,72 h)的IC50为5.5 ± 1.1 μM(希尔斜率=1.3 ± 0.1,n=3),抑制KG1a细胞增殖的IC50为9.1 ± 1.2 μM(希尔斜率=0.82 ± 0.09,n=4) [1] 6. I-CBP112剂量依赖性抑制人/小鼠白血病细胞系(MLL-CBP永生化小鼠骨髓细胞、KASUMI-1、SEM、MOLM13人急性髓系白血病细胞系、原发性AML患者原代母细胞)的集落形成能力,诱导细胞分化,且无显著细胞毒性(WST1实验) [2] 7. I-CBP112在体外剂量依赖性降低MLL-AF9⁺急性髓系白血病(AML)细胞的白血病起始潜能(极限稀释分析ELDA:干细胞频率从1/2.3降至1/13,p<0.00001);同时改变KASUMI-1细胞的细胞周期分布(G1期变化,双因素方差分析,p<0.01,p<0.001,p<0.0001) [2] 8. I-CBP112与BET抑制剂JQ1、阿霉素在KASUMI-1、SEM、MOLM13细胞中存在协同细胞毒效应(联合指数CI<1);对健康供体CD34⁺细胞的集落形成能力影响极小 [2] 9. I-CBP112选择性调控白血病细胞中基因的转录水平,q-RTPCR验证了受调控基因的表达变化(所选基因的表达具有时间依赖性,3次生物学重复) [2] |
| 体内研究 (In Vivo) |
在体外和体内环境中,I-CBP112 均以剂量依赖性方式显着降低 mLL-AF9+ AML 细胞引发白血病的能力。 I-CBP112 与既定标准疗法(阿霉素)和新的治疗方法(BET 抑制)的协同作用为白血病和可能的其他癌症的联合治疗开辟了新途径 [2]。
1. I-CBP112(5µM体外处理3天)显著降低MLL-AF9⁺ AML细胞在同基因次级小鼠受体中的白血病起始潜能;Kaplan-Meier分析显示,注射I-CBP112处理后白血病细胞的小鼠生存期显著延长(每只小鼠注射50,000/10,000/5,000/500个细胞,对数秩检验,n=4/5每组) [2] |
| 酶活实验 |
1. 等温滴定量热法(ITC)实验:测定I-CBP112与CBP溴结构域、p300溴结构域、BRD4(1)和BRD4(2)溴结构域的结合亲和力;记录原始滴定热和归一化结合热,采用非线性最小二乘法拟合生成结合等温线并计算拟合参数,证实其与BRD4溴结构域无交叉反应 [2]
2. AlphaScreen实验:通过检测I-CBP112与乙酰化组蛋白肽竞争结合CBP溴结构域的能力,测定其抑制CBP溴结构域-H3K56ac肽相互作用的体外IC50 [2] 3. 乙酰转移酶活性实验(p300/CBP):反应体系包含p300/CBP酶、核小体/组蛋白H3底物、[¹⁴C]乙酰辅酶A及不同浓度的I-CBP112;获取乙酰化产物的放射自显影图像并定量乙酰化水平(平均值±极差/标准误);分析乙酰化的时间进程和浓度依赖性,采用标准结合等温线/玻尔兹曼方程拟合曲线 [1] 4. SPOT实验:评估CBP溴结构域与乙酰化组蛋白肽库(包括单/多乙酰化肽)的结合能力,筛选后续ITC实验的肽底物;以非乙酰化肽作为对照 [2] |
| 细胞实验 |
1. Western blot实验(体外及细胞水平):体外实验中,制备含p300/CBP、核小体、乙酰辅酶A和不同浓度I-CBP112的反应体系,通过Western blot检测H3K18乙酰化水平(定量结果为平均值±拟合标准误,n=3);细胞水平实验中,LNCaP/KG1a细胞经I-CBP112处理4 h/6 h后,检测总H3和H3K18ac水平,计算相对于无配体组的倍数变化(平均值±极差,n=2) [1]
2. 细胞增殖实验([³H]胸苷掺入法):LNCaP/KG1a细胞经I-CBP112处理72 h后,检测[³H]胸苷掺入量以评估增殖能力;计算IC50和希尔斜率(LNCaP:n=3,KG1a:n=4) [1] 3. 细胞毒性实验(WST1):将MLL-CBP永生化小鼠骨髓细胞、MLL-AF9⁺白血病母细胞暴露于不同浓度的I-CBP112,通过WST1试剂检测细胞活力,数据归一化至溶媒对照组(平均值±标准差),采用ANOVA结合Dunnett多重比较进行统计分析(p<0.01,p<0.0001,n=4) [2] 4. 集落形成/重铺实验:将MLL-CBP永生化小鼠骨髓祖细胞、MLL-AF9⁺白血病母细胞、人白血病细胞系(KASUMI-1、SEM、MOLM13)、原发性AML患者原代母细胞、健康供体CD34⁺细胞接种于含不同浓度I-CBP112的甲基纤维素培养基;计数集落形成数,数据归一化至溶媒对照组(平均值±标准差),采用ANOVA结合Dunnett多重比较进行统计分析(p<0.01,p<0.001,p<0.0001,n=2-5) [2] 5. 流式细胞术(细胞周期分析):KASUMI-1细胞经递增浓度I-CBP112处理(3天后更换培养基/药物),不同时间点通过流式细胞术分析细胞周期分布;数据归一化至溶媒对照组(平均值±标准差),采用双因素方差分析结合Turkey多重比较进行统计分析(p<0.01,p<0.001,p<0.0001,n=2-4) [2] 6. 光漂白后荧光恢复(FRAP)实验:将全长CBP/GFP、CBP溴结构域突变体(N1168F)/GFP、3xCBP_{BRD}/GFP质粒转染至细胞;检测荧光信号的半恢复时间以评估CBP溴结构域与染色质的相互作用,以SAHA(2.5 µM)处理的细胞作为对照 [2] 7. NanoBRET实验:在细胞中表达NanoLuc荧光素酶融合的全长CBP、分离的CBP溴结构域、全长GFP-BRD4;检测I-CBP112剂量依赖性置换染色质结合溴结构域的能力,计算置换CBP溴结构域的细胞IC50(600 ± 50 nM) [2] 8. q-RTPCR实验:收集不同时间点I-CBP112处理的白血病细胞,提取RNA并通过q-RTPCR定量所选基因的表达水平;报告3次生物学重复的平均值 [2] |
| 动物实验 |
5 μM of I-CBP112
Mice with Leukemic blasts expressing MLL-AF9 1. Murine AML model: Bone marrow cells retrovirally expressing MLL-AF9 fusion oncogene were transplanted into syngeneic mice to induce AML; leukemic blasts from diseased mice were ex vivo treated with 5 µM I-CBP112 or DMSO vehicle for 3 days, then transplanted into secondary syngeneic recipients (50,000/10,000/5,000/500 cells per mouse); survival of recipient mice was monitored by Kaplan-Meier analysis (n=4/5 per group) [2] |
| 毒性/毒理 (Toxicokinetics/TK) |
1. I-CBP112 showed no significant cytotoxicity in human/mouse leukemic cell lines (WST1 assay) at concentrations that impaired colony formation and induced differentiation [2]
2. I-CBP112 had minimal effects on clonogenic growth of CD34⁺ cells from healthy donors, indicating low toxicity to normal hematopoietic cells [2] |
| 参考文献 | |
| 其他信息 |
1. I-CBP112 is a specific and potent acetyl-lysine competitive protein-protein interaction inhibitor targeting CBP/p300 bromodomains; it allosterically activates p300/CBP-mediated nucleosome acetylation through bromodomain interactions (distinct from CBP30) [1]
2. I-CBP112 is a selective small molecule inhibitor of CBP/p300 bromodomains, with no significant binding to BRD4 bromodomains (BET family); it displaces CBP bromodomain from chromatin in a dose-dependent manner [2] 3. I-CBP112 impairs aberrant self-renewal of leukemic cells and induces differentiation, with synergistic effects with JQ1 (BET inhibitor) and doxorubicin (chemotherapeutic drug), providing opportunities for combinatorial leukemia therapy [2] 4. p300/CBP are histone acetyltransferases (HATs) and transcriptional coactivators, dysregulated in cancer (e.g., leukemia-associated chromosomal translocations); I-CBP112 modulates p300/CBP-mediated histone acetylation (specifically H3K18), a key epigenetic regulation mechanism [1,2] |
| 分子式 |
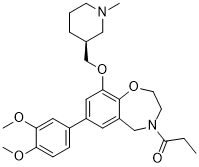
C27H36N2O5
|
|
|---|---|---|
| 分子量 |
468.59
|
|
| 精确质量 |
468.262
|
|
| CAS号 |
1640282-31-0
|
|
| 相关CAS号 |
|
|
| PubChem CID |
90488984
|
|
| 外观&性状 |
White to off-white solid powder
|
|
| 密度 |
1.1±0.1 g/cm3
|
|
| 沸点 |
623.5±55.0 °C at 760 mmHg
|
|
| 闪点 |
330.9±31.5 °C
|
|
| 蒸汽压 |
0.0±1.8 mmHg at 25°C
|
|
| 折射率 |
1.547
|
|
| LogP |
3.29
|
|
| tPSA |
60.5
|
|
| 氢键供体(HBD)数目 |
0
|
|
| 氢键受体(HBA)数目 |
6
|
|
| 可旋转键数目(RBC) |
7
|
|
| 重原子数目 |
34
|
|
| 分子复杂度/Complexity |
649
|
|
| 定义原子立体中心数目 |
1
|
|
| SMILES |
CCC(=O)N1CCOC2=C(C1)C=C(C=C2OC[C@H]3CCCN(C3)C)C4=CC(=C(C=C4)OC)OC
|
|
| InChi Key |
YKNAKDFZAWQEEO-IBGZPJMESA-N
|
|
| InChi Code |
InChI=1S/C27H36N2O5/c1-5-26(30)29-11-12-33-27-22(17-29)13-21(20-8-9-23(31-3)24(14-20)32-4)15-25(27)34-18-19-7-6-10-28(2)16-19/h8-9,13-15,19H,5-7,10-12,16-18H2,1-4H3/t19-/m0/s1
|
|
| 化学名 |
1-[7-(3,4-dimethoxyphenyl)-9-[[(3S)-1-methylpiperidin-3-yl]methoxy]-3,5-dihydro-2H-1,4-benzoxazepin-4-yl]propan-1-one
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (5.34 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (5.34 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.5 mg/mL (5.34 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.1341 mL | 10.6703 mL | 21.3406 mL | |
| 5 mM | 0.4268 mL | 2.1341 mL | 4.2681 mL | |
| 10 mM | 0.2134 mL | 1.0670 mL | 2.1341 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
 |
|---|
 |
 |
 Nucleosome acetylation by p300.Biochemistry.2016 Jul 12;55(27):3727-34. |
|---|
 Effects of I-CBP112 on full-length p300-mediated nucleosome acetylation.Biochemistry.2016 Jul 12;55(27):3727-34. |
 Effects of CBP30 on full-length p300-mediated nucleosome acetylation.Biochemistry.2016 Jul 12;55(27):3727-34. |