| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
MK2 (IC50 = 0.11 μM)
Addition of the MK2 inhibitor MK2-IN-1 induced more alkaline phosphatase (AP)-positive colonies than the other factors in a short time , implying that MK2 may be responsible for the phosphorylation of Tfcp2l1.[2] 46C mESCs were treated with MK2-IN-1 for a period of time. The Tfcp2l1 protein level gradually increased without a change in the Tfcp2l1 transcript level within 2 h .[2] |
|---|---|
| 体外研究 (In Vitro) |
添加MK2抑制剂MK2-IN-1在短时间内比其他因子诱导出更多的碱性磷酸酶(AP)阳性菌落,这意味着MK2可能是Tfcp2l1磷酸化的原因。[2]
用MK2-IN-1处理46C mESC一段时间。2小时内,Tfcp2l1蛋白水平逐渐升高,而Tfcp2l1转录水平没有变化。[2] 在含有100 µM ATP的生化分析中,化合物25抑制MK2酶活性的IC₅₀为0.1 µM (100 nM)。[4] 在基于细胞的MK2底物热休克蛋白27磷酸化(pHSP27)检测中,化合物25的EC₅₀为1.3 µM。[4] 在10 µM浓度下对150种蛋白激酶的选择性谱分析显示,化合物25仅对CK1/3有显著抑制(>50%),表明对MK2具有高选择性。[4] 在LPS刺激的人THP-1单核细胞中,化合物25剂量依赖性地抑制促炎细胞因子TNF-α和IL-6的分泌。[4] 在IL-1β刺激的SW1353软骨肉瘤细胞和人原发性骨关节炎软骨细胞中,化合物25剂量依赖性地抑制基质金属蛋白酶-13(MMP13)的分泌。[4] 饱和转移差(STD)NMR和¹H/¹⁵N异核单量子相干(HSQC)NMR研究证实,该系列先导化合物(如化合物1)以位点特异性、非ATP竞争性的方式与MK2结合。[4] 对初始苗头化合物(化合物1)针对肽底物(Acan肽)的酶动力学分析表明,最可能的抑制机制是非竞争性抑制模型。[4] |
| 酶活实验 |
MK2酶抑制实验使用重组人MK2激酶结构域(Gln41-Thr338)进行。生化效力(IC₅₀)在100 µM ATP和肽底物(Acan肽)存在下测定。通过量化磷酸化产物来测量活性,并将数据拟合至剂量反应曲线以得出IC₅₀值。[4]
为确定抑制模式,进行了酶动力学研究。在饱和ATP(100 µM)以及不同浓度的肽底物和抑制剂(如化合物1)存在下测量MK2活性。将所得数据全局拟合到各种动力学抑制模型(竞争性、非竞争性、反竞争性、混合型),并使用Akaike信息准则(AICc)评估最佳拟合。分析确定非竞争性抑制为最可能的模型。[4] 使用饱和转移差(STD)NMR研究其与ATP的结合竞争。实验使用MK2蛋白、ATP和MgCl₂进行。获取ATP的STD信号。然后加入测试化合物,通过新STD信号的出现且不影响ATP的STD信号来评估其结合,表明是非ATP竞争性结合。[4] 进行¹H/¹⁵N异核单量子相干(HSQC)NMR以确认位点特异性结合。比较apo-MK2的谱图与MK2-抑制剂复合物(如化合物1)的谱图。抑制剂特异性的化学位移扰动证实了与ATP结合位点不同的位点特异性结合。[4] |
| 细胞实验 |
基于细胞的效力(EC₅₀)通过测量化合物对细胞内MK2依赖性热休克蛋白27(HSP27)磷酸化的抑制来确定。用化合物处理细胞,裂解,并通常使用免疫分析法量化磷酸化HSP27(pHSP27)的水平。[4]
细胞毒性(CC₅₀)通过用不同浓度的化合物处理细胞一定时间(可能为24-72小时),并使用标准测定法(如基于ATP或染料的活力测定法)测量细胞活力/增殖来评估。[4] 对于THP-1细胞的功能实验,在存在或不存在递增浓度化合物25的情况下,用脂多糖(LPS)刺激细胞。孵育后,收集培养上清液,并通过ELISA或类似免疫分析法测量TNF-α和IL-6的分泌。[4] 对于SW1353软骨肉瘤细胞和原代人软骨细胞的功能实验,在存在或不存在化合物25的情况下,用白细胞介素-1β(IL-1β)刺激细胞。孵育后,收集培养上清液,并通过ELISA或类似免疫分析法测量MMP13的分泌。[4] |
| 动物实验 |
An oral pharmacokinetic (PK) study was conducted in rats. Compound 25 was administered as a single oral dose (10 mg/kg). Blood samples were collected over time, and plasma concentrations were measured to determine pharmacokinetic parameters such as area under the curve (AUC).[4]
|
| 药代性质 (ADME/PK) |
In an oral rat PK study, a single 10 mg/kg dose of compound 25 resulted in an area under the curve (AUC) of 2300 nM·h.[4]
Compound 25 showed no significant inhibition against a panel of major human cytochrome P450 (CYP) enzymes (e.g., CYP1A2, 2C9, 2C19, 2D6, 3A4) at concentrations up to 30 µM.[4] |
| 毒性/毒理 (Toxicokinetics/TK) |
The cytotoxicity (CC₅₀) of compound 25 in the cell-based assay was >20 µM, indicating a favorable separation (>10-fold) between cellular potency (EC₅₀ = 1.3 µM) and toxicity.[4]
Specific organ toxicity, drug-drug interactions, plasma protein binding, and lethal dose were not described in this study.[4] |
| 参考文献 | |
| 其他信息 |
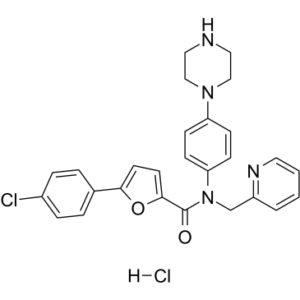
Compound 25 (chemical structure: N-methyl-5-(4-chlorophenyl)-N-(4-(piperazin-1-yl)phenyl)furan-2-carboxamide) is a representative optimized lead from a series of non-ATP-competitive MK2 inhibitors based on a furan-2-carboxamide scaffold.[4]
The series was discovered via high-throughput screening using the Automated Ligand Identification System (ALIS), an affinity selection-mass spectrometry platform.[4] The non-ATP-competitive binding mode is a key feature, potentially offering advantages in selectivity over ATP-competitive kinase inhibitors and efficacy in the high cellular ATP environment.[4] The biological rationale for targeting MK2 is based on its role downstream of p38 MAPK in regulating the production of pro-inflammatory cytokines (e.g., TNF-α, IL-6) and matrix-degrading enzymes (e.g., MMP13), implicating it in inflammatory diseases such as rheumatoid arthritis and osteoarthritis.[4] Compound 25 is proposed as an excellent pharmacological tool compound for specifically exploring MK2 biology due to its high potency, selectivity, and favorable in vitro PK properties.[4] |
| 分子式 |
C27H26CL2N4O2
|
|---|---|
| 分子量 |
509.43
|
| 精确质量 |
508.143
|
| CAS号 |
1314118-94-9
|
| 相关CAS号 |
MK2-IN-1;1314118-92-7
|
| PubChem CID |
70681199
|
| 外观&性状 |
Light yellow to pink solid
|
| LogP |
6.447
|
| tPSA |
61.61
|
| 氢键供体(HBD)数目 |
2
|
| 氢键受体(HBA)数目 |
5
|
| 可旋转键数目(RBC) |
6
|
| 重原子数目 |
35
|
| 分子复杂度/Complexity |
645
|
| 定义原子立体中心数目 |
0
|
| SMILES |
ClC1C=CC(=CC=1)C1=CC=C(C(N(CC2C=CC=CN=2)C2C=CC(=CC=2)N2CCNCC2)=O)O1.Cl
|
| InChi Key |
AZDOSXSDARWKGX-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C27H25ClN4O2.ClH/c28-21-6-4-20(5-7-21)25-12-13-26(34-25)27(33)32(19-22-3-1-2-14-30-22)24-10-8-23(9-11-24)31-17-15-29-16-18-31;/h1-14,29H,15-19H2;1H
|
| 化学名 |
5-(4-chlorophenyl)-N-(4-piperazin-1-ylphenyl)-N-(pyridin-2-ylmethyl)furan-2-carboxamide;hydrochloride
|
| 别名 |
MK2-IN-1; MK2-IN 1; MK2 IN-1; MK25; MK-25; MK 25; MK2 Inhibitor IV; MK2 Inhibitor-IV
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 请将本产品存放在密封且受保护的环境中(例如氮气保护),避免吸湿/受潮。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO: ~100 mg/mL (~196.3 mM)
Ethanol: ~2 mg/mL (~3.9 mM) |
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 1.67 mg/mL (3.28 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 16.7 mg/mL澄清的DMSO储备液加入到400 μL PEG300中,混匀;再向上述溶液中加入50 μL Tween-80,混匀;然后加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 1.67 mg/mL (3.28 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 16.7mg/mL澄清的DMSO储备液加入到900μL 20%SBE-β-CD生理盐水中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 1.67 mg/mL (3.28 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.9630 mL | 9.8149 mL | 19.6298 mL | |
| 5 mM | 0.3926 mL | 1.9630 mL | 3.9260 mL | |
| 10 mM | 0.1963 mL | 0.9815 mL | 1.9630 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。