| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 50mg |
|
||
| 100mg |
|
||
| 500mg |
|
||
| 1g |
|
||
| Other Sizes |
|
| 靶点 |
Natural flavonoid from Citrus reticulata Blanco; anti-inflammatory, antiviral, antioxidant
|
|---|---|
| 体外研究 (In Vitro) |
已证明Naringenin/柚皮素可抑制 HepG2 细胞增殖,部分原因是细胞在细胞周期的 G0/G1 和 G2/M 期积累。细胞核损伤和凋亡细胞比例较高表明柚皮素诱导细胞凋亡。 Bax/Bcl-2 比率增加、细胞色素 C 释放和 caspase-3 激活均表明柚皮素启动线粒体介导的凋亡途径[1]。暴露于柚皮素的 A431 细胞表现出剂量依赖性的核浓缩和 DNA 断裂增加,同时细胞活力显着降低。细胞周期研究证明了柚皮素诱导的细胞周期停滞在细胞周期的 G0/G1 期,并且 caspase-3 分析揭示了 caspase-3 活性的剂量依赖性增加,从而导致细胞凋亡[2]。
寻找具有抗增殖活性和诱导HepG2细胞凋亡潜力的新物质非常重要,因为众所周知,HCC对常规化疗具有耐药性。膳食植物化学物质具有显著的抗增殖和诱导细胞凋亡的潜力,被认为是有望用于癌症治疗的药物。Naringenin是一种常见的膳食类黄酮,大量存在于水果和蔬菜中,被认为对多种类型的癌症细胞具有强烈的细胞毒性活性。然而,其抗增殖作用和诱导凋亡的详细分子机制尚不清楚。在这项研究中,我们研究了柚皮素对人肝细胞癌HepG2细胞的抗增殖和凋亡诱导作用。柚皮素被证明可以抑制HepG2细胞的增殖,部分原因是细胞在细胞周期的G0/G1和G2/M期积累。柚皮素诱导p53的快速积累,这可能是柚皮素在Hep G2细胞中诱导G0/G1和G2/M期阻滞的原因。此外,柚皮素已被证明可以诱导细胞凋亡,这可以通过流式细胞术分析检测到的细胞核损伤和凋亡细胞比例的增加来证明。柚皮素触发了线粒体介导的凋亡途径,表现为Bax/Bcl-2比值的增加、随后细胞色素C的释放和半胱氨酸天冬氨酸蛋白酶-3的顺序激活。我们的研究结果表明,柚皮素通过抑制细胞增殖和诱导凋亡对HepG2细胞系的生长具有抑制作用。柚皮素抑制肿瘤细胞生长的药物靶点的阐明将有助于柚皮素在癌症治疗中的进一步发展。[1] 柚皮素Naringenin/是一种天然的主要黄酮类化合物,尤其在柑橘类水果中含量丰富,具有广泛的药理活性。寻找减少皮肤癌的抗增殖剂是一项非常重要的任务。本研究旨在利用MTT法、DNA断裂、核凝聚、线粒体膜电位变化、细胞周期动力学和半胱氨酸天冬氨酸蛋白酶-3作为生物标志物,分析柚皮素的抗增殖和凋亡机制,并研究其诱导活性氧(ROS)启动人表皮样癌A431细胞凋亡级联的能力。结果显示,柚皮素暴露显著降低了A431细胞的存活率(p<0.01),同时以剂量依赖的方式增加了核凝结和DNA断裂。细胞内ROS产生测定显示柚皮素的ROS产生与剂量相关,具有统计学意义(p<0.001)。它还通过诱导线粒体去极化引起柚皮素介导的表皮样癌细胞凋亡。细胞周期研究表明,柚皮素诱导细胞周期阻滞在G0/G1期,半胱氨酸天冬氨酸蛋白酶-3分析显示半胱氨酸天冬氨酰蛋白酶-3活性呈剂量依赖性增加,导致细胞凋亡。本研究证实了柚皮素的功效,柚皮素通过诱导ROS产生、线粒体去极化、核凝聚、DNA断裂、细胞周期阻滞在G0/G1期和半胱氨酸天冬氨酸蛋白酶-3激活,导致表皮样癌细胞死亡。[2] 血管平滑肌细胞(VSMC)的增殖和迁移是由各种炎症刺激引发的,在动脉粥样硬化和再狭窄的发病机制中起着重要作用。Naringenin/柚皮素是一种柑橘类黄酮类化合物,具有降脂和胰岛素样特性。在这里,我们研究了柚皮素是否影响TNF-α诱导的VSMC增殖和迁移,如果是这样,是否涉及血红素加氧酶-1(HO-1)。用柚皮素单独或联合TNF-α刺激处理大鼠VSMCs。我们发现柚皮素诱导VSMCs中HO-1 mRNA和蛋白质水平及其活性。柚皮素以剂量依赖的方式抑制TNF-α诱导的VSMC增殖和迁移。机制研究表明,柚皮素可阻止ERK/MAPK和Akt磷酸化,而p38 MAPK和JNK保持不变。柚皮素还阻断了TNF-α诱导的ROS产生的增加。更重要的是,特异性HO-1抑制剂ZnPP-IX或HO-1 siRNA部分消除了柚皮素对VSMCs的有益作用。这些结果表明,柚皮素可能通过诱导HO-1的表达/活性,随后降低VSMC的增殖和迁移,成为治疗这些疾病的新药。[3] 登革热是世界各地热带和亚热带地区最严重的健康问题之一。每年报告近3.9亿例病例。尽管某些国家最近批准了一种疫苗,但仍然需要一种抗登革热病毒药物。水果和蔬菜可能是具有药用价值的化合物的来源,如黄酮类化合物。本研究证明了黄酮类柑橘黄烷酮柚皮素的抗登革热病毒活性。柚皮素在Huh7.5细胞中预防了四种登革热病毒血清型的感染。此外,使用亚基因组RepDV-1和RepDV-3复制子系统的实验证实了柚皮素抑制登革热病毒复制的能力。即使在登革热病毒暴露后24小时使用柚皮素治疗Huh7.5细胞,也观察到抗病毒活性。最后,在感染登革热病毒支持蛋白-4的原代人单核细胞中证明了柚皮素的抗登革热病毒活性,支持柚皮素控制登革热病毒复制的潜在用途。总之,柚皮素是开发特定登革热病毒治疗方法的合适候选分子[6]。 |
| 体内研究 (In Vivo) |
服用柚皮素/Naringenin补充剂后,血浆和肝脏中的胆固醇和总甘油三酯水平显着降低。此外,柚皮素给药可降低子宫旁脂肪组织中的甘油三酯和肥胖水平。给予柚皮素的大鼠肝脏表现出 PPARα 蛋白的显着上调。柚皮素治疗会显着增加 CPT-1 和 UCP2 的表达,已知它们受 PPARα 控制[3]。柚皮素通过 PPARγ 共激活因子 1α/PPARα 驱动的转录程序增强肝脂肪酸的氧化。通过降低空腹高胰岛素血症,它可以抑制肝脏和肌肉的甾醇调节元件结合蛋白 1c 介导的脂肪生成。柚皮素可减少肝脏胆固醇和胆固醇酯的产生[4]。 Naringenin对 TNF-α 诱导的 VSMC 迁移和增殖表现出剂量依赖性抑制作用。根据机制研究,柚皮素抑制 p38 MAPK 和 JNK,但不抑制 ERK/MAPK 和 Akt 磷酸化。此外,柚皮素可防止 TNF-α 诱导的 ROS 产生增加 [5]。
补充柚皮素/Naringenin可显著降低血浆和肝脏中的总甘油三酯和胆固醇含量。此外,补充柚皮素可以降低宫旁脂肪组织中的脂肪和甘油三酯含量。柚皮素喂养的动物肝脏PPARα蛋白表达显著增加。此外,柚皮素处理显著增强了CPT-1和UCP2的表达,这两种物质都被PPARα调节。 结论:我们的结果表明,膳食中Naringenin/柚皮素激活PPARα转录因子并上调其脂肪酸氧化靶基因可能有助于体内降脂和抗肥胖作用。[4] 目的:代谢综合征及其并发症的全球流行要求快速评估新的和可获得的干预措施。胰岛素抵抗是代谢综合征的核心生化紊乱。柑橘衍生的黄酮类化合物柚皮素具有降脂特性,并以类似胰岛素的方式抑制培养肝细胞分泌VLDL。我们评估了柚皮素是否在体内胰岛素抵抗的情况下调节脂蛋白的产生和胰岛素敏感性。 研究设计和方法:喂食高脂肪(西方)饮食(42%的热量来自脂肪,0.05%的胆固醇)的LDL受体缺失(Ldlr(-/-))小鼠会出现血脂异常、胰岛素和葡萄糖不耐受以及肥胖。四组小鼠(标准饮食、西药和西药加1%或3%wt/wt柚皮素)随意喂食4周。测定VLDL的产生以及胰岛素和葡萄糖耐量的参数。 结果:我们报告,柚皮素/Naringenin对喂食西方饮食的Ldlr(-/-)小鼠的治疗纠正了VLDL的过度生产,改善了肝脂肪变性,减轻了血脂异常,而不影响热量摄入或脂肪吸收。柚皮素1)通过过氧化物酶体增殖物激活受体(PPAR)γ辅活化因子1alpha/PPARa介导的转录程序增加肝脂肪酸氧化;2)通过减少空腹高胰岛素血症,防止肝脏和肌肉中甾醇调节元件结合蛋白1c介导的脂肪生成;3)降低肝脏胆固醇和胆固醇酯合成;4)减少VLDL衍生和内源性合成的脂肪酸,防止肌肉甘油三酯积累;以及5)改善了总体胰岛素敏感性和葡萄糖耐量。 结论:因此,柚皮素/Naringenin通过纠正与胰岛素抵抗相关的许多代谢紊乱,为代谢综合征提供了一种有前景的治疗方法。[5] 补充柚皮素/Naringenin对食物摄入、体重增加和器官重量的影响[4] 柚皮素/Naringenin在6周的实验期间没有影响平均食物摄入量(数据未显示)。尽管柚皮素补充组的平均体重相对于对照组有增加的趋势,但它们没有显著差异。治疗6周后,所有组的肝脏重量没有显著差异(数据未显示)。 柚皮素降低脂肪甘油三酯(TAG)[4] 柚皮素/Naringenin喂养的大鼠,由附睾和肾周组成的宫旁脂肪垫的重量减轻。与对照组相比,在膳食柚皮素浓度为0.003、0.006和0.012%时,柚皮素治疗分别使脂肪组织重量减少了24.6、14.9和41.1%(图1)。0.012%柚皮素治疗组和对照组的参数脂肪组织重量差异显著(p<0.05),尽管其他组的差异没有达到显著性。由于甘油三酯是脂肪组织的主要成分,我们测量了脂肪组织甘油三酯的含量。与参数化脂肪垫重量的变化一致,最高剂量的柚皮素补充显著降低了脂肪组织中的TAG含量(图1)。 柚皮素降低血浆甘油三酯和胆固醇水平[4] 与对照组相比,补充柚皮素可显著降低血液甘油三酯水平(表2)。尽管柚皮素剂量依赖性地降低了血浆三酰甘油浓度(分别为0.003%、0.006%和0.012%,为对照组的6%、42%和55%),但组间差异未达到统计学意义。与对照组相比,0.006%柚皮素治疗组的血浆总胆固醇和游离胆固醇浓度也显著降低。然而,各组血浆游离脂肪酸浓度没有差异(表2)。 柚皮素降低肝脏甘油三酯和胆固醇水平[4] 与喂食对照饮食的动物相比,喂食补充柚皮素的饮食的大鼠肝脏甘油三酯水平降低(表3)。然而,只有0.012%的柚皮素降低了肝脏甘油三酯浓度,具有统计学意义(p<0.05)。与对照组相比,柚皮素喂养的大鼠肝脏中的胆固醇浓度也降低了,但与对照组比较,只有0.006%的柚皮素导致肝脏胆固醇水平显著降低(p<0.05)。 柚皮素增加肝脏PPARα、CPT-1和UCP2蛋白表达[4] 为了检查血浆和肝脏甘油三酯水平的降低是否是由于肝脏脂肪酸氧化增加引起的,我们分析了PPARα的表达,PPARα是脂质代谢和脂肪酸β氧化的关键转录调节因子,0.012%的柚皮素显著诱导了肝脏PPARα蛋白的表达,如图2所示。定量分析显示,与对照组相比,0.003、0.006和0.012%柚皮素喂养组的PPARα蛋白丰度分别增加了25%、40%和50%。我们进一步评估了柚皮素治疗激活PPARα是否会导致肝脏中PPARα调节基因如CPT-1和UCP2的表达增加[27-29]。与PPARα蛋白表达的增加一致,柚皮素剂量依赖性地增加了CPT-1和UCP2蛋白的量(0.003%、0.006%和0.012%柚皮素组CPT-1分别增加了112%、110%和130%,UCP2分别增加了113%、125%和127%)。0.012%柚皮素中PPARα、CPT1和UCP2的蛋白质水平显著高于对照组(图2)。 |
| 酶活实验 |
抗病毒活性测定[6]
在两种不同的试验中评估了Naringenin/柚皮素的抗病毒活性。浓度为2的Huh7.5细胞 × 104 96孔板中的细胞/孔以10的感染复数(MOI)感染四种DENV血清型(DENV-1/FGA/89、DENV-2/IC265、DENV-3/5532和DENV-4/TVP360)中的每一种的一种代表性菌株,持续90 分钟。在感染期间和之后,在其NTC中添加了柚皮素。分别使用IFN-α2A(200 IU/mL)和模拟感染细胞进行抗病毒活性的阳性和阴性对照。72之后 孵育h后,将细胞培养上清液储存在-86℃ °C用于病毒滴定。分离细胞并进行流式细胞术染色33。BD FACS Canto II用于定量DENV感染的细胞。细胞培养上清液也用于C6/36细胞焦点形成免疫检测测定中的滴定,以确认FACS结果44。 此外,从柚皮素的NTC开始连续稀释,获得了剂量反应曲线。使用非线性回归获得抑制50%病毒感染的浓度(IC50),然后构建S形浓度反应曲线(可变斜率;GraphPad)并计算选择性指数(SI = CC50/IC50)。所有检测均一式三份。 杀病毒试验[6] 如前所述,经过细微修改后进行了杀病毒试验34。简而言之,每种DENV血清型(2× 105 ffu/mL;DENV-1/FGA/89;DENV-2/ICC-265;DENV3/5532和DENV-4/TVP360)在150μM的存在或不存在下用Naringenin/柚皮素(250μM)处理 μg/mL RNase A 1 h 37 °C.治疗后,使用QIAamp病毒RNA迷你试剂盒提取病毒RNA。使用250 pmol随机引物和Improm II逆转录酶。如Lanciotti等人45所述,用D1(5′-TCATATATGAAACGCGCGAGAACCG-3′)和D2(5′-ATTGCACCAGACAGTCAACGTCATCTGTC-3′)引物对进行PCR扩增。用RNase处理或未处理的DENV RNA样品分别用作阳性和阴性对照。 药物添加试验时间[6] 最初,密度为2的Huh7.5细胞 × 104 96孔板中的细胞/孔(i)用Naringenin处理1 DENV感染前h;(ii)在DENV感染期间用柚皮素治疗;(iii)在DENV感染后用柚皮素治疗;或(iv)在DENV感染期间和之后用柚皮素治疗。DENV感染的MOI为10,柚皮素的浓度为250 μM.如前所述,使用FACS测定感染细胞的百分比。 在另一项实验中,如前所述,细胞被DENV-1菌株FGA/89(MOI:10)感染,并在感染后的不同时间点(0、1、2、4、6、24、30和48)用<强>柚皮素(250μM)或IFN-α2A(200IU/mL)处理 h).使用FACS测定感染细胞的百分比。在焦点形成免疫检测试验72中滴定上清液 h感染后。 柚皮素阻碍Huh7.5细胞中DENV的复制[6] 在确认了柚皮素在病毒进入Huh7.5细胞后的抗DENV作用后,我们确定了这种黄烷酮是否会损害DENV的复制。在这些实验中使用了来自DV1-BR/90(RepDV1)和BR DEN3 290-02(RepDV3)的两个亚基因组复制子27,28。获得DENV复制子RNA并用于转染Huh7.5细胞(2μg RNA/2 × 106 根据制造商的说明,Nucleofector 2B设备中的细胞)。1之后 转染h后,用柚皮素(250μM)处理Huh7.5细胞。将平板进一步孵育72小时 h.孵育后,如前所述,回收细胞并进行FACS分析。作为阴性对照,Huh7.5细胞在没有RNA的情况下转染,不进行处理。用RNA(来自DENV-1或DENV-3复制子)转染的Huh7.5细胞和未处理的细胞用作病毒复制的阳性对照。对照组包括用重组IFN-α2A(200 IU/mL)和20 μM利巴韦林。 原代人类细胞中的抗病毒作用[6] 使用Ficoll组织水溶液和经典方案纯化从提供签署知情同意书的健康供体获得的PBMC 46。纯化后,将PBMC以1 × 106 细胞/孔,用200 μM的Naringenin/柚皮素,然后评估膜联蛋白V/7-AAD的暴露量。此外,我们还量化了用柚皮素治疗后的人单核细胞(CD14+)数量(250、125和62.5 μM)处理5天。确定柚皮素对人单核细胞的NTC为62.5 μM,感染登革热。将人PBMC以1 × 106 细胞/孔,用DENV-4 TVP/360(MOI:10)感染2 h.去除接种物,用柚皮素(62.5μM)、IFN-α2A(200IU/mL)或RPMI培养基处理细胞。在37℃下孵育5天后 在100℃和5%CO2的条件下,用小鼠抗人CD14 PE-Cy7抗体47对细胞进行DENV E蛋白(单克隆抗体4G2-FITC偶联)染色。CD14表达用于门控单核细胞。计算该人群中DENV E阳性细胞(4G2+)的百分比。 |
| 细胞实验 |
细胞活力测定[1]
细胞以每孔8×103个细胞的密度铺在96孔板上,用培养基孵育24小时。用PBS冲洗细胞,并在含有不同浓度(50、100、150、200、250、300μM)的Naringenin/柚皮素的培养基中生长。溶剂DMSO处理的细胞用作对照。处理24小时后,取出培养基,用另一种含有3-(4,5-二甲基噻唑-2-基)-2,5-二苯基-2H-溴化四唑(MTT)溶液(1 mg/mL)的培养基替换,并在37°C下孵育细胞2小时。为了评估活细胞的比例,甲赞用150μL DMSO溶解。然后将板在室温下涡旋30分钟,并使用分光光度计在575nm处测量甲赞的含量。 细胞形态变化的观察[1] 在6 cm培养皿上生长的Hep G2细胞用不同剂量的Naringenin/柚皮素处理24小时,剂量分别为100、150和200μM。在倒置显微镜下观察形态学变化。 DAPI核染色[1] 用柚皮素(100、150和200μM)处理Hep G2细胞24小时后,收获细胞,在冰冷的磷酸盐缓冲盐水(PBS)中洗涤,并在室温下用3.7%多聚甲醛在PBS中固定10分钟。用PBS洗涤固定的细胞,并在室温下用4,6-二脒基-2-苯二腈溶液染色10分钟。通过荧光显微镜检查细胞的核形态。 细胞周期分析[1] HepG2细胞用浓度逐渐增加的Naringenin/柚皮素(100、150和200μM)处理24小时。处理结束时,细胞被胰蛋白酶消化,所得细胞悬浮液以1000 rpm的速度离心5分钟。细胞在4°C的70%乙醇中固定过夜,以1000 rpm离心5分钟,用冰冷的PBS洗涤颗粒两次。然后将细胞沉淀重新悬浮在含有50μg/ml碘化丙啶 和100μg/ml RNase A的0.5 ml PBS中,在37°C下孵育30分钟,然后用流式细胞仪 进行分析。通过流式细胞仪分析细胞DNA含量)。每次分析至少使用10000个细胞,结果以直方图显示。测量G0/G1、G2/M和S期细胞分布的百分比,并使用Modfit LT 5.2版细胞周期图软件对结果进行分析。 蛋白质印迹分析[1] 用DMSO(对照)和不同浓度的Naringenin/柚皮素(100、150和200μM)处理细胞。刺激24小时后,收集漂浮细胞和贴壁细胞,用冰冷的PBS洗涤三次,并在裂解缓冲液中收获。将裂解物在4°C下以12000 rpm离心15分钟,收集上清液。采用Bradford法测定裂解物的蛋白质浓度。根据Laemmli,使用每个样品的等效蛋白质提取物(55μg)进行SDS-PAGE。将分离的蛋白质电泳转移到聚偏二氟乙烯膜上。 MTT法检测HaCaT和A431细胞的存活率[2] 该测定基于3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑(MTT)染料的酶还原现象,并提供了活细胞与吸光度之间的直接关系。如前所述,通过MTT还原法评估了柚皮素对细胞存活率的影响[18]。在二甲基亚砜(DMSO)中制备了选择性剂量,即50µM、100µM、200µM、300µM、400µM、500µM和750µM的柚皮素,最终体积为100µl培养基。暴露21小时后,在每个孔中加入10µl MTT溶液(5mg/ml储备溶液),在37°C下重新孵育3小时,直至形成甲赞蓝晶体。从每个孔中丢弃培养基,加入100µl DMSO,在37°C下溶解甲酰胺晶体10分钟。通过微孔板读数器(BIORAD-680)在540nm处记录吸光度,并评估细胞存活率的相对百分比。 细胞形态分析[2] 分析了柚皮素/Naringenin对培养细胞形态变化的影响。将细胞以1×104个细胞/孔的密度接种在96孔培养板上。孵育过夜后,用不同浓度的柚皮素处理细胞24小时。在倒置相差显微镜下观察细胞形态。 活性氧(ROS)活性测定[2] 显微荧光成像用于研究A431细胞在暴露于不同浓度的Naringenin/柚皮素后ROS的产生。如上所述接种细胞(每孔1×104个)进行MTT测定。然后将细胞暴露于50µM、100µM、200µM、300µM、400µM、500µM和750µM浓度的柚皮素中12小时。将细胞与2,7-二氯二氢荧光素二乙酸酯(DCFH-DA)(10 mM)在37°C下孵育30分钟。吸取反应混合物,并在每个孔中用200µl磷酸缓冲盐水(PBS)代替。将平板在室温下在黑暗中放置在振荡器上10分钟。使用倒置荧光显微镜观察细胞内的荧光并捕获图像。对于定量ROS分析,将细胞(每孔1×104个)重新接种在96孔黑色底部培养板中,并在37°C的CO2培养箱中粘附24小时。A431细胞用不同浓度的柚皮素处理12小时。暴露后,细胞在37°C下用DCFH-DA(10 mM)孵育30分钟。在485nm的激发波长和528nm的发射波长下,用多孔微孔板阅读器测量荧光强度。数值表示为相对于对照孔的荧光强度百分比。 流式细胞术分析细胞DNA含量[2] 使用流式细胞术进行细胞周期相位分布和细胞DNA含量。将A431细胞以1×106个细胞/ml的密度接种到6孔板中,并在5%CO2培养箱和37°C的温度下用100µM、300µM和500µM的Naringenin/柚皮素处理24小时。孵育24小时后,收获培养的细胞,用冷PBS洗涤,用70%乙醇固定,用RNase A(10mg/ml)处理。固定细胞用碘化丙啶(PI)染料染色,然后在室温下在黑暗中孵育30分钟。使用流式细胞仪测量单个细胞核的PI荧光。使用Cell Quest Pro V 3.2.1软件分析数据。 细胞培养[3] 如前所述(Gordon等人,1986),从3至4周龄的雄性Sprague-Dawley大鼠的胸主动脉中分离VSMCs。实验中使用了第4-8代的细胞。为了评估Naringenin/柚皮素对培养的VSMCs的影响,我们在无血清培养基中用柚皮素预孵育细胞,然后用100ng/ml TNF-α攻击细胞。必要时,在柚皮素治疗前1小时给予10-4mM ZnPP-IX。另一种降低HO-1表达的方法是siRNA转染。使用siRNA TargetFinder软件设计大鼠HO-1特异性siRNA(5′-CCG UGG CAG UGG GAA UUU AUG CCA U-3′)和非特异性siRNA(5’-CCG ACG GUG AGG UUA UAU CGUGCA U-3′,作为阴性对照),并由Invitrogen合成。根据制造商的说明,使用X-tremeGENE HP转染试剂将每种siRNA转染到VSMCs中。转染后24小时,如前所述处理VSMCs。 增殖试验[3] 通过使用MTT(Marshall等人,1995)和直接细胞计数法分析细胞增殖。对于MTT分析,VSMCs被接种在96孔板中(每孔1×104个细胞)。用Naringenin/柚皮素(25或100μM)预处理细胞1小时,然后在柚皮素存在下用或不用TNF-α(100ng/ml)刺激24小时。之后,向每个孔中加入MTT(0.2mg/ml)并孵育4小时。去除上清液,将甲赞晶体溶解在DMSO中。通过使用酶标仪测量550nm处的吸光度来评估细胞增殖。MTT分析也通过直接细胞计数和BrdU掺入试验得到证实。为了进行细胞计数,将VSMCs接种在6孔板中(每孔5×104个细胞)。经过类似的处理后,用0.05%胰蛋白酶和0.02%EDTA重新悬浮细胞,并用血细胞计数器计数。对于BrdU掺入试验,在所有处理完成后,将10μM BrdU加入培养基中2小时,用4%多聚甲醛固定细胞并用HCl处理。使用抗BrdU抗体和Alexa Fluor 555测定BrdU掺入。用DAPI(Sigma)对细胞进行复染。通过荧光显微镜观察信号,并计算BrdU阳性(粉红色)和总DAPI染色核(蓝色)之间的平均比率进行统计分析。 迁移分析[3] 用24孔改良的Boyden室评估VSMCs的TNF-α依赖性趋化性,Boyden室含有纤维连接蛋白涂层的聚碳酸酯膜(8μm孔径)(Grotendorst等人,1981)。简而言之,如图中图例所示,在存在或不存在Naringenin的情况下,用补充/不补充100 ng/ml TNF-α的无酚红DMEM填充腔室的下部孔。过滤器涂有50mg/ml纤维连接蛋白,并固定在底部孔的顶部。每孔1×105个VSMCs被允许迁移6小时,用棉签从膜的上侧去除未迁移的细胞。膜下侧的细胞用Hoechst 33342染色,然后用荧光显微镜在每个孔中随机选择五个方格进行计数。数据以每个字段的迁移细胞数表示。细胞迁移也通过划痕运动试验进行评估(Majack和Clowes,1984)。对于该试验,将VSMCs接种在6孔板中(每孔1.5×105个细胞),并生长至融合。血清剥夺24小时后,将细胞安装到可重复使用的模板上,形成标准伤口(<3mm)。然后将细胞与柚皮素(25或100μM)一起孵育1小时,然后用或不用TNF-α(100 ng/ml)刺激24小时。通过直接显微镜观察,在板底部伤口区域的参考点跟踪伤口闭合率。该程序允许每次拍摄同一地点。通过显微照片确定剩余的无细胞区域,并在损伤24小时后立即进行。 |
| 动物实验 |
Animals, diets, and experimental design [4]
Male Long-Evans hooded rats obtained at 3 weeks of age (40–50 g) were housed individually in animal cages in a room with controlled temperature (23 to 24 °C) and lightning (12-h light/dark cycle) and fed a commercial non-purified diet and water prior to receiving the dietary treatments. Animals were assigned to treatments so that each group was balanced for body weight and fed one of four experimental diets (n = 6) for 6 weeks. Semi-purified, powdered diets were prepared for concentrations of Naringenin: 0, 0.003, 0.006, and 0.012% of diet. After 7 days of acclimatization, rats were assigned to one of four groups, with six animals per group, and fed semi-purified experimental diets for 6 weeks. The experimental diets contained 16% fat, 45.5% sucrose, and different Naringenin concentration (0, 0.003, 0.006, or 0.012%) (Table 1). Rats had ad libitum access to food and water during the study period. Food intake and body weight were measured throughout the experiment. At the end of the experiment, the animals were fasted for 12 h before the intraperitoneal injection of ketamine (90 mg/kg) and xylazine (10 mg/kg) and euthanized by exsanguination. Blood was immediately collected into heparinized tubes for further analysis. Livers and other tissues were perfused with physiological saline, removed, weighed, and frozen in liquid nitrogen and stored at −80 °C until further analysis. [4] Male C57BL/6J and Ldlr−/− mice on the C57BL/6J background were housed in pairs and maintained at 23°C on a 12-h light/dark cycle. Experiments were approved by the animal care committee of the University of Western Ontario. Eight- to 12-week-old mice were fed ad libitum a rodent standard diet (4% of calories from fat, TD8604; Harlan Teklad) or a high-fat diet containing 42% of calories from fat plus cholesterol (0.05% wt/wt). Naringenin was added to the Western diet at 1 or 3% (wt/wt). Ldlr−/− mice were fed for 4 weeks and C57BL/6J mice for 30 weeks. Food intake was measured daily, and body weight was measured biweekly. Mice were fasted for 6 h before intervention [5]. |
| 药代性质 (ADME/PK) |
Metabolism / Metabolites
Narigenin has known human metabolites that include Narigenin 7-O-glucuronide. |
| 毒性/毒理 (Toxicokinetics/TK) |
Naringenin Toxicity AVIAN Red-winged blackbird Oral LD50 (Lethal Dose 50) > 100 mg/kg
Naringenin Repellency AVIAN Red-winged blackbird Oral R50 (Repellency 50) > 1 % |
| 参考文献 | |
| 其他信息 |
(S)-naringenin is the (S)-enantiomer of naringenin. It has a role as an expectorant and a plant metabolite. It is a Naringenin and a (2S)-flavan-4-one. It is a conjugate acid of a (S)-naringenin(1-). It is an enantiomer of a (R)-naringenin.
Naringenin has been reported in Camellia sinensis, Humulus lupulus, and other organisms with data available. See also: Naringin (has subclass); Flavanone (subclass of). In conclusion, we are the first to provide evidence that naringenin is highly effective in inhibiting cell proliferation and inducing apoptosis cell death in human hepatocellular carcinoma Hep G2 cells and naringenin may be a promising candidate for hepatocarcinogenesis treatment. [1] In conclusion, the present study provides a novel insight into the mechanism of action of Naringenin-induced apoptosis in human skin carcinoma cells without/little affecting normal skin cells and shows a link between antiproliferative and apoptotic induction, and the cell death was due to the induction of ROS mediated mitochondrial membrane depolarization, nuclear condensation and DNA fragmentation. We also observed that naringenin induced cell cycle arrest at G0/G1 phase and caspase-3 activity. Our data confirm the potential of naringenin as an agent of chemotherapeutic and cytostatic activity in human skin carcinoma cancer and therefore, may be potentially valuable for application in drug developments. For further confirmation, molecular mechanism will be carried out to elucidate the molecular pathways. [2] In atherosclerosis, mitogenesis is induced in VSMCs via ERK phosphorylation/activation and in turn promotes VSMC proliferation and migration (Sprague and Khalil, 2009). Such process is mediated by activation of PI3K and its downstream target Akt (Chandrasekar et al., 2004), an important regulator involved in cell metabolism, growth and vascular remodeling (Dugourd et al., 2003). In the present study, we demonstrated that TNF-α stimulation significantly increased phosphorylated ERK1/2 and Akt levels in VSMCs, which was inhibited by Naringenin treatment. More importantly, these effects of naringenin were completely abolished by pretreatment with ZnPP IX. These data indicate: (1) the blockade of mitogenesis and p-ERK/p-Akt activity may serve as the molecular basis for the functions of naringenin; (2) given that intracellular ROS can activate MAPK family members such as ERK1/2, JNK, and p38 MAPK (Adhikari et al., 2006), the importance of inhibiting upstream second messengers such as ROS by naringenin should be highlighted when evaluating the molecular mechanisms mentioned above and (3) HO-1 induction at least dominantly, if not totally, mediates the naringenin-induced deactivation of VSMCs. Taken together, our findings suggest naringenin has profound effects on various pathways involved in VSMC pathological changes in atherosclerosis and HO-1 is one of the major targets of naringenin. In conclusion, the present study demonstrates that Naringenin inhibits TNF-α-induced VSMC proliferation and migration. We also revealed the roles of HO-1 in the anti-inflammatory and antioxidant functions of naringenin in VSMCs. Naringenin can be therefore developed as a novel drug to treat cardiovascular diseases related to VSMC proliferation and migration such as atherosclerosis. In a broader context, our findings strongly suggest that enhancement of antioxidant defense has highly therapeutic values for atherosclerosis and HO-1 ranks one of the most promising drug targets due to its dynamically modulatory property. [3] In summary, dietary Naringenin exerts hypolipidemic and anti-adiposity effects in vivo at physiologically relevant concentrations. These effects can be explained in part by upregulation of hepatic PPARα and its target genes and by decreasing TAG level in adipose tissue. Together, our results indicate that decreased adipose TAG amounts by Naringenin treatment may increase the release of TAG, which is in turn diverted into hepatic fatty acid oxidation, resulting in lowered plasma level of TAG. However, we could not exclude the possibility that naringenin may also upregulate fatty acid oxidation in the adipose tissue itself. Future studies should address this to clarify a potential mechanism by which dietary naringenin elicits its beneficial effects in vivo.[4] The protective effect of Naringenin was not restricted to mice with Ldlr deficiency. In wild-type mice, we found that naringenin significantly reduced plasma and hepatic lipids, normalized glucose tolerance and insulin sensitivity, and prevented obesity compared with Western diet–fed mice. Collectively, these findings demonstrate that Naringenin has marked lipid- and lipoprotein-lowering potential. Naringenin normalizes hepatic VLDL production, glucose tolerance, and insulin sensitivity and prevents hepatic steatosis and obesity associated with a high-fat diet. The ability of naringenin to modulate metabolic pathways linked to the metabolic syndrome suggests that these molecules represent valuable tools in the search for regulators of insulin signaling, lipid homeostasis, and energy balance. [5] In conclusion, data from multiple assays (flow cytometry, viral titration and replicon system) employed to assess infection with eleven different strains representing the four DENV serotypes in two cell types (the Huh7.5 cell line and primary human monocytes) support the ability of Naringenin to target DENV replication, making naringenin a suitable candidate for the treatment of DENV infection. Our results provide novel insights for the development of specific anti-DENV drugs to treat infected patients. [6] |
| 分子式 |
C15H12O5
|
|
|---|---|---|
| 分子量 |
272.25
|
|
| 精确质量 |
272.068
|
|
| 元素分析 |
C, 66.17; H, 4.44; O, 29.38
|
|
| CAS号 |
480-41-1
|
|
| 相关CAS号 |
Naringenin-d4;1192260-78-8;(±)-Naringenin;67604-48-2
|
|
| PubChem CID |
439246
|
|
| 外观&性状 |
White to light yellow solid powder
|
|
| 密度 |
1.5±0.1 g/cm3
|
|
| 沸点 |
577.5±50.0 °C at 760 mmHg
|
|
| 熔点 |
247-250 °C(lit.)
|
|
| 闪点 |
224.7±23.6 °C
|
|
| 蒸汽压 |
0.0±1.7 mmHg at 25°C
|
|
| 折射率 |
1.693
|
|
| LogP |
3.19
|
|
| tPSA |
86.99
|
|
| 氢键供体(HBD)数目 |
3
|
|
| 氢键受体(HBA)数目 |
5
|
|
| 可旋转键数目(RBC) |
1
|
|
| 重原子数目 |
20
|
|
| 分子复杂度/Complexity |
363
|
|
| 定义原子立体中心数目 |
1
|
|
| SMILES |
C1[C@H](OC2=CC(=CC(=C2C1=O)O)O)C3=CC=C(C=C3)O
|
|
| InChi Key |
FTVWIRXFELQLPI-ZDUSSCGKSA-N
|
|
| InChi Code |
InChI=1S/C15H12O5/c16-9-3-1-8(2-4-9)13-7-12(19)15-11(18)5-10(17)6-14(15)20-13/h1-6,13,16-18H,7H2/t13-/m0/s1
|
|
| 化学名 |
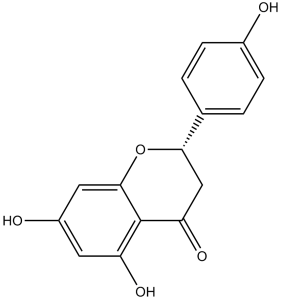
(2S)-5,7-dihydroxy-2-(4-hydroxyphenyl)-2,3-dihydrochromen-4-one
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 3 mg/mL (11.02 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 30.0 mg/mL 澄清的 DMSO 储备液加入到400 μL PEG300中,混匀;再向上述溶液中加入50 μL Tween-80,混匀;然后加入450 μL 生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 3 mg/mL (11.02 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 30.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 3 mg/mL (11.02 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 3.6731 mL | 18.3655 mL | 36.7309 mL | |
| 5 mM | 0.7346 mL | 3.6731 mL | 7.3462 mL | |
| 10 mM | 0.3673 mL | 1.8365 mL | 3.6731 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
| NCT Number | Recruitment | interventions | Conditions | Sponsor/Collaborators | Start Date | Phases |
| NCT04697355 | Completed | Dietary Supplement: naringenin and beta carotene |
Energy Expenditure Safety Issues |
Pennington Biomedical Research Center | April 19, 2021 | Not Applicable |
| NCT01091077 | Completed | Dietary Supplement: Naringenin | Hepatitis C Virus HCV Infection |
Massachusetts General Hospital | June 2009 | Phase 1 |
| NCT03582553 | Recruiting | Drug: Larotrectinib Sulfate Procedure: Bone Scan |
Recurrent Glioma Refractory Glioma |
National Cancer Institute (NCI) |
August 23, 2017 | Phase 2 |
| 444 | Completed | Dietary Supplement: Extracts of citrus peels standardized in AUR and NAR (phytocomplex). |
Subjective Cognitive Decline | Pennington Biomedical Research Center | May 25, 2018 | Early Phase 1 |
|
|
|