| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
OX2 Receptor
|
|---|---|
| 体外研究 (In Vitro) |
体外活性:Orexin 2 Receptor Agonist 是一种有效的选择性 Orexin2 受体激动剂,对 OX2R 的 EC50 为 0.023 μM;它是 OX2R 选择性的(OX1R/OX2R EC50 比率为 70)。食欲素是调节睡眠/觉醒的神经肽家族,作用于两种 G 蛋白偶联受体:食欲素受体 1 (OX1R) 和 2 (OX2R)。遗传和药理学证据表明,食欲素受体激动剂,尤其是 OX2R 激动剂,将可用于睡眠障碍发作性睡病/猝倒症的机械治疗。我们在此报告发现了一种有效的(OX2R 上的 EC50 为 0.023 μM)和 OX2R 选择性(OX1R/OX2R EC50 比率为 70)激动剂,4-甲氧基-N,N-二甲基-3-[N-(3-{ [2-(3-甲基苯甲酰胺基)乙基]氨基}苯基)氨磺酰基]-(1,1-联苯)-3-甲酰胺 26. 激酶测定:Orexin 2 Receptor Agonist 是一种有效的选择性 Orexin2 受体激动剂,EC50 为 0.023 μM在 OX2R 上;它是 OX2R 选择性的(OX1R/OX2R EC50 比率为 70)。食欲素是调节睡眠/觉醒的神经肽家族,作用于两种 G 蛋白偶联受体:食欲素受体 1 (OX1R) 和 2 (OX2R)。细胞测定:食欲素是调节睡眠/觉醒的神经肽家族,作用于两种 G 蛋白偶联受体:食欲素受体 1 (OX1R) 和 2 (OX2R)。遗传和药理学证据表明,食欲素受体激动剂,尤其是 OX2R 激动剂,将可用于睡眠障碍发作性睡病/猝倒症的机械治疗。我们在此报告发现了一种有效的(OX2R 上的 EC50 为 0.023 μM)和 OX2R 选择性(OX1R/OX2R EC50 比率为 70)激动剂,4'-甲氧基-N,N-二甲基-3'-[N-(3 -{[2-(3-甲基苯甲酰胺基)乙基]氨基}苯基)氨磺酰基]-(1,1'-联苯)-3-甲酰胺 26/Orexin 2 Receptor Agonist .
最近,与双食欲素受体拮抗剂suvorexant结合的人OX2R的X射线晶体结构在2.5Å处得到了解决。通过使用这种X射线结构,通过分子对接计算检查了Orexin 2 Receptor Agonist /食欲素2受体激动剂/26与OX2R的结合模式(见支持信息)。由此产生的食欲素2受体激动剂/26的结合模式(图3)表明,食欲素2接收器激动剂/26上的二甲基氨基甲酰基位于OX2R配体结合位点的深处,其羰基与N324(跨脑螺旋5,TM5)形成氢键。化合物26还使用乙二胺部分的氮原子与C210(TM3)的主链羰基形成额外的氢键。26的联苯基位于由V138(TM3)、F227(TM5)、Y317(TM6)、I320(TMA6)和V353(TM7)组成的疏水口袋中,以进行疏水相互作用。磺酰酰胺基团26与OX2R的T111(TM2)、H350(TM7)和Y354(TM7。有趣的是,26分别将磺酰酰胺基团的两个氧导向T111(TM2)和Y354(TM7)的羟基以及H350(TM7”)的咪唑环。26的磺酰酰胺基团可以在与受体活化相关的结构变化中形成氢键。这可以解释羧酰胺衍生物29是无活性的,因为羧酰胺和磺酰酰胺基团之间的氧方向不同。OX2R的T111(TM2)在OX1R中突变为Ser。这种突变可能与表2中化合物对OX2R的高选择性有关。26的中间和末端部分中的苯基团还与V114(TM2)、W120(ECL1)和I130(TM3)以及Y343(TM7)和F346(TM7。化合物26的B环邻域如图3所示。这也可以解释,在3-位具有取代基的化合物23、26和28具有强大的活性,因为我们可以在3-位方向上看到很大的空间来容纳取代基。图4比较了suvorexant和26与OX2R的结合模式。如文献所述,suvorexan采用π堆叠的马蹄形构象,将其七元环导向OX2R的TM5和TM6。这种结合模式被认为是suvorexantOX2R拮抗剂活性的原因,因为七元环似乎抑制了TM5和TMI相对于TM束其余部分的向内运动,这可能是GPCR激活的一般触发因素。相比之下,26以延伸的构象结合OX2R,我们检测到26与OX2R的TM5和TM6之间存在一些空间容差。因此,我们可以认为26与OX1R的结合可能会诱导TM5和TMI的向内运动,这将使26具有OX2R激动剂活性。[1]
|
| 体内研究 (In Vivo) |
食欲素受体 1 (OX1R) 和 2 (OX2R) 是两种 G 蛋白偶联受体,是控制睡眠和觉醒的食欲素神经肽家族的靶标。根据遗传和药理学证据,睡眠障碍发作性睡病/猝倒症的机械治疗可能受益于食欲素受体激动剂,特别是 OX2R 激动剂的使用。本文报道了 4'-甲氧基-N,N-二甲基-3'-[N-(3-{[2-(3-甲基苯甲酰氨基)乙基]氨基}苯基)氨磺酰]的发现,作为一种有效的(OX2R 上的 EC50)为 0.023 μM)和 OX2R 选择性(OX1R/OX2R EC50 比率为 70)激动剂。 -(联苯-1,1′)26-甲酰胺-3。
在表2中,最强的化合物是3-甲基衍生物26/食欲素2受体激动剂。同时,对OX2R最具选择性的化合物是3-甲氧基衍生物23。然而,表2中的化合物11和22-28几乎不溶于水,这导致难以确认体内活性,尽管每种化合物在体外都显示出令人满意的活性和效力。因此,我们在B环上引入了2-二甲氨基,得到了更具极性的衍生物30(图5),然后将30转化为二盐酸盐31(食欲素2受体激动剂类似物),可以在1.3 M下溶解在生理盐水中。为了评估31的体内药理作用,我们在光照期将其注入侧脑室,并通过记录C57BL/6J小鼠的脑电图/肌电图来观察其对睡眠/觉醒状态的影响。31以剂量依赖的方式促进觉醒(图6)。260nmol的31将清醒时间增加到53分钟,与3.0nmol的食欲素a(58分钟)报告的程度相似。相比之下,31并没有增加OX1R/OX2R双敲除(DKO)小鼠的清醒度,这表明31的作用需要食欲素受体。31的腹腔注射也产生了类似的效果[1]。 |
| 酶活实验 |
体外结合试验[1]
根据文献对与人OX1R或OX2R的结合亲和力进行了评估。在含有25 mM Hepes/NaOH(pH 7.4)、0.5 mM EDTA、2.5 mM CaCl2和2.5 mM MgCl2(OX1R)或25 mM Heps/NaOH(pH 7.4,2.5 mM CaCl_2)、2.5 mM Ca2、1 mM MgCl2和0.5%BSA(OX2R)的缓冲液中,在不存在或存在测试化合物的情况下,将表达人OX1R的CHO-K1细胞或表达人OX2R的HEK-293细胞(20µg蛋白质)的细胞膜匀浆在22°C下与0.1 nM[125I]食欲素-A一起孵育60分钟。在1µM SB-334867(OX1R)或食欲素-B(OX2R)存在的情况下测定非特异性结合。孵育后,在真空下通过用0.3%PEI预浸的玻璃纤维过滤器 快速过滤样品,并使用96个样品细胞采集器 用含有50 mM Tris-HCl和150 mM NaCl(OX1R)或50 mM Tris-HaCl(OX2R)的冰冷缓冲液冲洗数次。将过滤器干燥,然后使用闪烁鸡尾酒 在闪烁计数器中计数放射性。结果表示为对照放射性配体特异性结合的抑制百分比。标准参考化合物是食欲素-A(OX1R)或食欲素-B(OX2R),在每个实验中以几种浓度进行测试,以获得竞争曲线。 26/食欲素2受体激动剂与OX2R结合模式的建模[1] 所有计算均使用薛定谔套件2013-2进行。首先使用LigPrep2.7程序将26/食欲素2受体激动剂的2D结构转换为3D结构。使用Epik2.5程序预测了26的质子化状态4。然后,使用ConfGen2.5程序5进行构象搜索,并将得到的构象用于以下对接计算。OX2R与suvorexant(PDB ID:4S0V)复合物的X射线结构被用作对接受体6。该结构是使用Maestro9.5中的蛋白质制备向导制备的。使用Prime3.3程序7补偿了侧链的缺失原子。最后,使用力场OPLS 2005将结构最小化。在对接计算之前,我们去除了H2O分子,但位于OX2R配体结合位点的HOH4021和HOH4025除外。由于HOH4021/HOH4025分别在OX2R的N324和R328侧链之间以及OX2R的H350和suvorexant之间形成水介导的氢键网络,这些水分子似乎对配体结合位点或配体识别的结构稳定性很重要。26与OX2R的对接计算是使用薛定谔套件2013-28中实现的IFD 2006协议进行的。“受体网格生成”方案的盒中心设置为suvorexant与OX2R结合的质心。初始滑翔对接使用蛋白质和配体的范德华半径标度为0.8进行,每个构象的最大姿势数设置为2。Prime用于精炼配体位置5.0Å以内的残基。在Glide中使用标准设置进行重新对接。根据IFDScore对生成的姿势进行排名,以选择前10%的对接复合体。然后使用Prime程序通过分子力学广义玻恩表面积(MM-GBSA)方法估算这些配合物(Gcomplex)的自由能,我们最终选择了Gcomplex最低的对接配合物作为相互作用模型。为了测试我们的程序,我们将其应用于suvorexant-OX2R复合物。结果如图1所示。由此产生的模型,即排名第一的姿势,再现了suvorexant和OX2R之间的所有相互作用,以及通过HOH4025在晶体结构中观察到的水介导的氢键。位置和构象均方根偏差(RMSD)分别为1.30和0.99Å。这些结果表明,我们的程序适用于建立26和OX2R之间可靠的相互作用模型。 Orexin 2 Receptor Agonist 是一种有效且特异性的 Orexin2 受体激动剂,对 OX2R 的 EC50 为 0.023 μM。它仅对 OX2R 有选择性(OX1R 和 OX2R 之间的 EC50 比率为 70)。食欲素受体 1 (OX1R) 和 2 (OX2R) 是两种 G 蛋白偶联受体,是控制睡眠和觉醒的食欲素神经肽家族的靶标。 |
| 细胞实验 |
细胞系和细胞培养[1]
根据制造商的建议,使用FuGENE 6转染48小时后,收获逆转录病毒液。为了产生表达受体的细胞,用逆转录病毒上清液感染CHO(中国仓鼠卵巢)K1细胞。感染后24小时,用10µg/mL的嘌呤霉素选择感染细胞。为了产生稳定的指示细胞系,使用FuGENE 6将NFAT反应萤光素酶报告质粒(pNFAT TA-Luc)与携带抗生素抗性基因的pSV2neo一起转染组成型受体表达的CHO-K1细胞系。24小时后,用1mg/mL G418选择转染的细胞。将G418抗性细胞接种在含有5%胎牛血清、1种非必需氨基酸、100 U/mL青霉素和100µg/mL链霉素、10µg/mL嘌呤霉素、1 mg/mL G418的Dulbecco改良Eagle培养基中,分离出一个克隆。生成了与人OX1R或OX2R cDNA和NFAT反应荧光素酶报告基因共转染的细胞系。这些细胞系保持在上述培养基中。 钙动员试验[1] 将稳定表达人OX1R(CHOOX1R)或OX2R(CHOOX2R)的CHO-K1细胞接种在96孔板(10000个细胞/孔)中,在37°C下与5%FBS/DMEM一起孵育48小时。然后,在Hanks平衡盐溶液(HBSS:GIBCO)中用5µM荧光钙指示剂Fura 2-AM装载细胞,其中包括20 mM HEPES、2.5 mM Probenecid、5%CremophorEL和0.1%BSA,在37℃下孵育1小时。洗涤细胞一次,加入75µL HBSS缓冲液。然后,用25µL不同浓度的受试化合物或食欲素A(OXA:稀释于PBS/0.1%BSA中)处理细胞。FDSS 3000系统监测了施用受试化合物或OXA后细胞内Ca2+浓度的增加。通过Graph Pad Prism 5J(MDF)计算每种化合物的EC50值 萤光素酶测定[1] 将CHOOX1R或CHOOX2R细胞(10000个细胞/孔)接种在96孔板中,并生长至融合24小时。用指定的测试化合物或OXA处理细胞。OXA(在PBS/0.1%BSA中稀释)用作阳性对照。六小时后,通过抽吸去除培养基。将细胞单层溶解在50µL Steay Glo萤光素酶试剂中,通过ARVO x5测定萤光素酶活性。将Steady-Glo试剂在25 mM Tris(pH 7.5)/10%甘油/1%曲拉通X-100作为工作溶液中稀释10倍。 |
| 动物实验 |
In vivo experiments [1]
Experimental mice were individually housed and kept on a 12 h: 12 h light: dark schedule at an ambient temperature of 23 ± 1 °C and under specific pathogen-free conditions. 8- to 12-wk-old male C57BL/6J mice were anesthetized with isoflurane (4%) and remained anesthetized with isoflurane (2%), and then were surgically installed with a guide cannula into left lateral ventricle for intracerebroventricular (ICV) administration and were simultaneously implanted with electroencephalograph/electromyography (EEG/EMG) electrodes. Two EEG electrodes were implanted over the right hemisphere coordinates, and two EMG electrodes were implanted over both sides of the trapezius muscle. All mice were recovered for at least 1 week and were habituated with the recording tether for 1 week before experiments. After habituation, baselines of EEG/EMG were recorded for 1 day, and at ZT6 on the next day, ICV administrations were performed under transient anesthesia with isoflurane through a cannula by using a syringe pump and an oil-filled syringe. An injection volume of 5.0 µL was delivered over a 10 min period to each mouse. Mice were immediately returned to home cages and EEG/EMG recorded. After saline administration, we administrated 32, 130, 260 nmol of 31 (water soluble analog of Orexin 2 Receptor Agonist ) on every other day. EEG/EMG signals were analyzed by using custom semi-automated software. We assessed the wake time for 2 h after ICV administration. All values are expressed as means ± SEM. In wild-type mice, data were analyzed with a repeated one-way ANOVA, and then individual groups were compared with a Bonferroni test. Differences were considered significant when P <0.05, P <0.001. In OX1R/OX2R DKO mice, data were analyzed with a paired t-test. |
| 药代性质 (ADME/PK) |
Barely soluble in water [1]
|
| 参考文献 | |
| 其他信息 |
Researchers paid attention to the sulfonamide group of hit compound 1 and synthesized more than 1000 compounds. Those compounds were tested against a CHO cell line expressing the human orexin receptor using the NFAT-luciferase assay and the calcium influx assay. We found the first lead compound 5, then focused on the transformation of the A-ring and the B-ring in 5. As a result, the first, potent, and selective agonist 26/Orexin 2 Receptor Agonist for OX2R was discovered. The conversion from the sulfonamide group in 26/Orexin 2 Receptor Agonist to the carbonylamide group and the evaluation of the obtained 29 suggested that the sulfonamide moiety is one of the most important structural features for the OX2R agonistic activity. In addition, we also developed the dimethylamino derivative 30 and its dihydrochloride salt, which could be dissolved in saline at 1.3 M. The in vivo assay of the dihydrochloride salt showed a definite wake-promoting effect. These results would be helpful for further design of OXR agonists.[1]
|
| 分子式 |
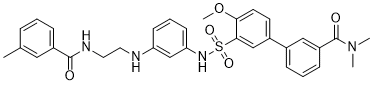
C32H34N4O5S
|
|
|---|---|---|
| 分子量 |
586.70
|
|
| 精确质量 |
586.224
|
|
| 元素分析 |
C, 65.51; H, 5.84; N, 9.55; O, 13.63; S, 5.46
|
|
| CAS号 |
1796565-52-0
|
|
| 相关CAS号 |
|
|
| PubChem CID |
91810287
|
|
| 外观&性状 |
White to off-white solid powder
|
|
| 密度 |
1.3±0.1 g/cm3
|
|
| 折射率 |
1.629
|
|
| LogP |
3.4
|
|
| tPSA |
125
|
|
| 氢键供体(HBD)数目 |
3
|
|
| 氢键受体(HBA)数目 |
7
|
|
| 可旋转键数目(RBC) |
11
|
|
| 重原子数目 |
42
|
|
| 分子复杂度/Complexity |
986
|
|
| 定义原子立体中心数目 |
0
|
|
| SMILES |
S(C1C(=CC=C(C2C=CC=C(C(N(C)C)=O)C=2)C=1)OC)(NC1C=CC=C(C=1)NCCNC(C1C=CC=C(C)C=1)=O)(=O)=O
|
|
| InChi Key |
RHLMXWCISNJNDH-UHFFFAOYSA-N
|
|
| InChi Code |
InChI=1S/C32H34N4O5S/c1-22-8-5-10-25(18-22)31(37)34-17-16-33-27-12-7-13-28(21-27)35-42(39,40)30-20-24(14-15-29(30)41-4)23-9-6-11-26(19-23)32(38)36(2)3/h5-15,18-21,33,35H,16-17H2,1-4H3,(H,34,37)
|
|
| 化学名 |
N-[2-[3-[[5-[3-(dimethylcarbamoyl)phenyl]-2-methoxyphenyl]sulfonylamino]anilino]ethyl]-3-methylbenzamide
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (4.26 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (4.26 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL 澄清 DMSO 储备液加入到 900 μL 玉米油中并混合均匀。 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.7044 mL | 8.5222 mL | 17.0445 mL | |
| 5 mM | 0.3409 mL | 1.7044 mL | 3.4089 mL | |
| 10 mM | 0.1704 mL | 0.8522 mL | 1.7044 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。