| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| Other Sizes |
|
| 靶点 |
Human CCR2 ( IC50 = 5.2 nM ); Mouse CCR2 ( IC50 = 0.06 nM ); Rat CCR2 ( IC50 = 13 nM )
|
||
|---|---|---|---|
| 体外研究 (In Vitro) |
体外活性:PF-4136309(以前称为 INCB8761)是一种新型、有效、选择性、可口服的小分子 CCR2 拮抗剂,对人、小鼠和大鼠 CCR2 的 IC50 值分别为 5.2 nM、17 nM 和 13 nM。 PF-4136309 表现出有效的 CCR2 拮抗活性、高选择性、弱 hERG 活性以及出色的体外和体内 ADMET 特性。 PF-4136309已进入人体临床试验。目前,PF-4136309已完成治疗胰腺肿瘤的I期研究,但尚未公布结果。激酶测定:PF-4136309 在人类趋化活性 (IC50=3.9 nM) 和全血测定 (IC50=19 nM) 中具有有效作用,在小鼠和大鼠趋化测定中,IC50 分别为 16 和 2.8 nM。 PF-4136309 可有效抑制 CCR2 介导的信号事件,例如细胞内钙动员和 ERK(细胞外信号调节激酶)磷酸化,IC50 值分别为 3.3 和 0.5 nM。在 hERG 膜片钳测定中,PF-4136309 抑制 hERG 钾电流,IC50 为 20 μM。 PF-4136309 不是细胞色素 P450 (CYP) 抑制剂,对五种主要 CYP 同工酶 CYP1A2、CYP2C9、CYP2C19、CYP2D6 和 CYP3A4 的 IC50 值 >30 μM。此外,PF-4136309 在浓度高达 30 μM 时不是 CYP 诱导剂。细胞测定:体外 ADME(吸收、分布、代谢和排泄)分析显示 17 (PF-4136309) 在 Caco-2 单层上具有中等渗透性,值为 3.1 × 10–6 cm/s。在蛋白质结合方面,17 在人血清中的游离分数为 23%。当与人肝微粒体一起孵育时,17 表现出中等的内在清除率,半衰期 (t1/2) 为 89 分钟。当17与人S9在有或没有NADPH和辅因子谷胱甘肽的情况下一起孵育时,没有检测到谷胱甘肽加合物。化合物 17 不是细胞色素 P450 (CYP) 抑制剂,对五种主要 CYP 同工酶 CYP1A2、CYP2C9、CYP2C19、CYP2D6 和 CYP3A4 的 IC50 值 >30 μM。浓度高达 30 μM 时,化合物 17 不是 CYP 诱导剂。
|
||
| 体内研究 (In Vivo) |
静脉注射后,PF-4136309 在两种物种中均表现出中等的半衰期(2.5 和 2.4 小时)。口服给药时,PF-4136309 (10 mg/kg) 被迅速吸收,大鼠的峰值浓度时间 (Tmax) 为 1.2 小时,狗的峰值浓度时间为 0.25 小时。在静脉给药和口服给药之间,在两个物种中观察到相似的半衰期。 PF-4136309 吸收良好,两种物种的口服生物利用度均为 78%
|
||
| 酶活实验 |
ERK5激酶活性体外测定[1]
在含有200 ng纯活性ERK5和指定量抑制剂的激酶缓冲液(50 mM Tris-HCl, pH 7.5, 0.1 mM EGTA, 1 mM 2-巯基乙醇)中检测40 μL的激酶活性。反应开始时,加入10 mM醋酸镁,50 μM [γ-32P]-ATP (500 cpm/pmol)和250 μM PIMtide (ARKKRRHPSGPPTA)作为底物。实验在30°C下进行20分钟,通过将反应混合物涂在p81纸上并按照前面的描述测量掺入的放射性来终止。 LRRK2的接头激酶检测[G2019S][1] 体外激酶检测在Invitrogen公司(麦迪逊,WI)使用SelectScreen激酶分析服务进行。 |
||
| 细胞实验 |
在无血清 DMEM 培养基中,使用或不使用 PF-4136309 培养 500,000 个 HPBMC,并加热至 37 °C。对于除阴性对照之外的每个孔,将 400 μL 加热的 10 nM MCP-1 添加到底部室。将 8 微米膜过滤器置于顶部后,关闭室盖。接下来,将细胞插入与滤膜下方的室孔相对应的室盖孔中。整个室在 37°C、5% CO2 下孵育 30 分钟。之后,小心地取下过滤器,打开室盖,吸出细胞。过滤器风干后,应用赖特·盖姆萨染色剂。显微镜对过滤器进行计数。使用迁移到含有拮抗剂的孔中底部室的细胞数和迁移到MCP-1对照孔中底部室的细胞数来计算拮抗剂效力。
|
||
| 动物实验 |
|
||
| 药代性质 (ADME/PK) |
In vitro ADME (absorption, distribution, metabolism, and excretion) profiling revealed that 17 (INCB8761/PF-4136309) has a moderate permeability across Caco-2 monolayers with a value of 3.1 × 10–6 cm/s. In protein binding, 17 had a free fraction of 23% in human serum. When incubated with human liver microsomes, 17 exhibited a moderate intrinsic clearance, with a half-life (t1/2) of 89 min. When 17 was incubated with human S9 with or without NADPH and the cofactor glutathione, no glutathione adducts were detected. Compound 17 is not a cytochrome P450 (CYP) inhibitor, with IC50 values of >30 μM against five major CYP isozymes CYP1A2, CYP2C9, CYP2C19, CYP2D6, and CYP3A4. Compound 17 is not a CYP inducer at concentrations up to 30 μM.
[1]
The pharmacokinetics of 17 (INCB8761/PF-4136309) was assessed in rats and dogs (Table 4). Following iv administration of 17, the total systemic clearance was moderate in rats but low in dogs. The apparent steady-state volume of distribution (Vss) followed the same trend as in clearance, with high Vss in rats and low Vss in dogs. As a result, 17 exhibited a moderate half-life in both species after iv administration (2.5 and 2.4 h). When administered orally, 17 was absorbed rapidly, with peak concentration time (Tmax) at 1.2 h for rats and 0.25 h for dogs. A similar half-life was observed in both species between iv dosing and po dosing. Compound 17 was well absorbed, with an oral bioavailability of 78% in both species.[1] |
||
| 参考文献 | |||
| 其他信息 |
The benzo[e]pyrimido-[5,4-b]diazepine-6(11H)-one core was discovered as a novel ERK5 (also known as MAPK7 and BMK1) inhibitor scaffold, previously. Further structure-activity relationship studies of this scaffold led to the discovery of ERK5-IN-1 (26) as the most selective and potent ERK5 inhibitor reported to date. 26 potently inhibits ERK5 biochemically with an IC₅₀ of 0.162 ± 0.006 μM and in cells with a cellular EC₅₀ for inhibiting epidermal growth factor induced ERK5 autophosphorylation of 0.09 ± 0.03 μM. Furthermore, 26 displays excellent selectivity over other kinases with a KINOMEscan selectivity score (S₁₀) of 0.007, and exhibits exceptional bioavailability (F%) of 90% in mice. 26 will serve as a valuable tool compound to investigate the ERK5 signaling pathway and as a starting point for developing an ERK5 directed therapeutic agent.[1]
We report the discovery of a new (S)-3-aminopyrrolidine series of CCR2 antagonists. Structure-activity relationship studies on this new series led to the identification of 17 (INCB8761/PF-4136309) that exhibited potent CCR2 antagonistic activity, high selectivity, weak hERG activity, and an excellent in vitro and in vivo ADMET profile. INCB8761/PF-4136309 has entered human clinical trials.[2] |
| 分子式 |
C₂₉H₃₁F₃N₆O₃
|
|
|---|---|---|
| 分子量 |
568.59
|
|
| 精确质量 |
568.241
|
|
| 元素分析 |
C, 61.26; H, 5.50; F, 10.02; N, 14.78; O, 8.44
|
|
| CAS号 |
1341224-83-6
|
|
| 相关CAS号 |
(s)-PF-4136309; 1372407-07-2; (Rac)-PF-4136309; 857679-55-1
|
|
| PubChem CID |
11192346
|
|
| 外观&性状 |
Off-white to light yellow solid powder
|
|
| LogP |
4.027
|
|
| tPSA |
120.34
|
|
| 氢键供体(HBD)数目 |
3
|
|
| 氢键受体(HBA)数目 |
10
|
|
| 可旋转键数目(RBC) |
7
|
|
| 重原子数目 |
41
|
|
| 分子复杂度/Complexity |
894
|
|
| 定义原子立体中心数目 |
1
|
|
| SMILES |
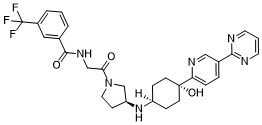
O[C@]1(CC[C@](CC1)([H])N[C@@H]2CN(CC2)C(CNC(C3=CC=CC(C(F)(F)F)=C3)=O)=O)C4=NC=C(C=C4)C5=NC=CC=N5
|
|
| InChi Key |
ZNSVOHSYDRPBGI-CBQRAPNFSA-N
|
|
| InChi Code |
InChI=1S/C29H31F3N6O3/c30-29(31,32)21-4-1-3-19(15-21)27(40)36-17-25(39)38-14-9-23(18-38)37-22-7-10-28(41,11-8-22)24-6-5-20(16-35-24)26-33-12-2-13-34-26/h1-6,12-13,15-16,22-23,37,41H,7-11,14,17-18H2,(H,36,40)/t22?,23-,28?/m0/s1
|
|
| 化学名 |
N-[2-[(3S)-3-[[4-hydroxy-4-(5-pyrimidin-2-ylpyridin-2-yl)cyclohexyl]amino]pyrrolidin-1-yl]-2-oxoethyl]-3-(trifluoromethyl)benzamide
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 5 mg/mL (8.79 mM) (饱和度未知) in 10% EtOH + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,将 100 μL 50.0 mg/mL 澄清乙醇储备液加入到 400 μL PEG300 中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 5 mg/mL (8.79 mM) (饱和度未知) in 10% EtOH + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 50.0 mg/mL 澄清乙醇储备液加入到 900 μL 20% SBE-β-CD 生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 5 mg/mL (8.79 mM) (饱和度未知) in 10% EtOH + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 配方 4 中的溶解度: ≥ 2.08 mg/mL (3.66 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将100 μL 20.8 mg/mL澄清的DMSO储备液加入400 μL PEG300中,混匀;再向上述溶液中加入50 μL Tween-80,混匀;然后加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 5 中的溶解度: ≥ 2.08 mg/mL (3.66 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将100 μL 20.8 mg/mL澄清的DMSO储备液加入到400 μL PEG300中,混匀;再向上述溶液中加入50 μL Tween-80,混匀;然后加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 6 中的溶解度: ≥ 2.08 mg/mL (3.66 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 20.8 mg/mL 澄清 DMSO 储备液加入到 900 μL 玉米油中并混合均匀。 配方 7 中的溶解度: ≥ 2.08 mg/mL (3.66 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,要配制1 mL工作液,可将100 μL 20.8 mg/mL 澄清DMSO 储备液加入900 μL 玉米油中,混匀。 配方 8 中的溶解度: 10 mg/mL (17.59 mM) in 0.5% Methylcellulose/saline water (这些助溶剂从左到右依次添加,逐一添加), 悬浊液; 超声助溶。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.7587 mL | 8.7937 mL | 17.5874 mL | |
| 5 mM | 0.3517 mL | 1.7587 mL | 3.5175 mL | |
| 10 mM | 0.1759 mL | 0.8794 mL | 1.7587 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
| NCT Number | Recruitment | interventions | Conditions | Sponsor/Collaborators | Start Date | Phases |
| NCT01413022 | Completed | Drug: Oxaliplatin Drug: Irinotecan Drug: Leucovorin |
Pancreatic Neoplasms | Washington University School of Medicine |
April 2012 | Phase 1 |
| NCT01226797 | Terminated | Drug: Placebo Drug: PF-04136309 |
Female Patients With Overactive Bladder Syndrome |
Hepatitis C, Chronic | January 17, 2011 | Phase 2 |
ACS Med Chem Lett.2011 Oct 5;2(12):913-8. |
|---|
ACS Med Chem Lett.2011 Oct 5;2(12):913-8. |
X-ray crystal structure of two molecules of compound17.ACS Med Chem Lett.2011 Oct 5;2(12):913-8. |