| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 100mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
TAAR1 (EC50 = 17~35 nM)
|
|---|---|
| 体外研究 (In Vitro) |
RO5263397在HEK-293细胞中以剂量依赖性方式增加cAMP介导的BRET信号[3]
为了研究RO5263397的药理作用,我们首先采用体外方法。由于TAAR1是与刺激性G蛋白偶联的GPCR,其激活引起cAMP的产生。为了实时监测TAAR1激活,除了小鼠和人TAAR1外,我们还转染了cAMP BRET生物传感器,该传感器根据cAMP波动改变光的发射(见“材料和方法”部分)。然后,我们在转染小鼠或人TAAR1的细胞中测试了一系列浓度的RO5263397。如图1所示,RO5263397以浓度依赖的方式增加camp介导的BRET信号(图1A,B),在观察期内无脱敏现象。RO5263397在未转染TAAR1的细胞中不激发BRET信号(数据未显示)。与已知的TAAR1完全激动剂β-苯乙胺(PEA)的最大浓度(10 μM)相比,RO5263397在mTAAR1上表现为完全激动剂(EC50: 0.12 nM, Emax: 100%),在hTAAR1上表现为部分激动剂(EC50: 47 nM, Emax: 82%),分别如图1C,D所示。数据还表明,RO5263397在mTAAR1上的效力是hTAAR1的392倍,具有物种相关差异。 TAAR1拮抗剂EPPTB抑制RO5263397作用[3] 通过使用选择性TAAR1拮抗剂EPPTB预处理细胞,我们进一步验证了RO5263397中camp介导的BRET信号是由于TAAR1的激活。在这些实验中,我们使用了带有mTAAR1的细胞,因为EPPTB对小鼠和大鼠具有物种选择性。EPPTB (1 μM)预处理部分阻断了对最大浓度(0.1 μM) RO5263397的响应(图1E)。单独的EPPTB不影响mTAAR1转染细胞的BRET信号。此外,它不影响腺苷酸环化酶激活剂forskolin (20μM)引发的cAMP-BRET信号,如图1F所示。这些数据表明mTAAR1的激活是观察EPPTB拮抗剂特性所必需的。 RO5263397介导的HEK293细胞ERK和CREB磷酸化[3] 除cAMP诱导外,TAAR1信号通路可能涉及其他蛋白,如β-arrestin2和AKT/GSK3通路。然而,cAMP和β-arrestin2与下游效应物如CREB和ERK有关,TAAR1似乎调节这两种蛋白的活性。为了验证这一假设,我们使用了表达mTAAR1或hTAAR1的HEK293细胞。首先,我们用RO5263397处理表达mTAAR1的细胞,根据我们之前的BRET实验(mTAAR1为10 nM, hTAAR1为100 nM),我们在第一个达到100%疗效的化合物浓度下进行了一个时间过程。如图2A、B所示,RO5263397能够诱导ERK2和CREB的磷酸化,对pERK和pCREB的作用在5分钟和15分钟时达到最大。在测量了诱导pERK和pCREB的最佳时间后,我们使用不同浓度的RO5263397进行了浓度响应曲线(图2C,D)。然后,我们在表达hTAAR1的细胞中重复相同的时间过程实验,得到了类似的结果(图3)。 |
| 体内研究 (In Vivo) |
0.3 和 1 mg/kg 时,RO5263397(0.1-1.0 mg/kg;侧壁;中间光位期 (ZT6) 用药)可延长苏醒时间 [2]。 RO5263397(0.3 和 1.0 mg/kg;口服)显着延长 OE 模型中的光照时间 5-6 小时,同时减少 WT 小鼠 RO5263397(0.3 和 1.0 mg/kg;侧壁)。所有模型中的 NREM 睡眠都会减少四到六个小时,但 REM 睡眠。
微量胺相关受体1 (TAAR1)激动剂已被证明具有促进认知、抗精神病样、抗焦虑、减肥、降血糖和促进清醒的活性。我们使用Taar1敲除(KO)和过表达(OE)小鼠以及Taar1激动剂来阐明Taar1在睡眠/清醒中的作用。记录Taar1 KO、OE和WT小鼠的脑电图、肌电图、体温和运动活动。在记录24小时以表征基础睡眠/觉醒参数后,小鼠被剥夺睡眠(SD) 6小时。在另一项实验中,小鼠被给予三剂量的TAAR1部分激动剂RO5263397,咖啡因或对照品p.o。与WT小鼠相比,OE小鼠的基线觉醒程度适度增加。在非快速眼动和快速眼动睡眠中,与OE小鼠相比,KO小鼠的基线θ (4.5-9 Hz)和低γ (30-60 Hz)活动升高。SD后,KO和OE小鼠均表现出稳态睡眠反弹。在WT小鼠中,RO5263397增加清醒,减少非快速眼动和快速眼动睡眠,降低清醒和非快速眼动期间的伽马功率,在不影响LMA的情况下降低Tb;这些作用在KO小鼠中不存在,而在OE小鼠中增强。与对照相比,咖啡因增加了所有品系的清醒时间、NREM伽马能量和LMA;这种作用在KO小鼠中减弱,在OE小鼠中增强。TAAR1过表达适度地增加清醒,而TAAR1部分激动作用增加清醒,也减少非快速眼动和快速眼动睡眠。这些结果表明TAAR1在睡眠/觉醒和皮层活动中起调节作用,并提示TAAR1是促进觉醒治疗的新靶点。 RO5263397抑制DAT-KO小鼠自发性亢进[3] 微量胺相关受体1激动剂可以减少多巴胺能的过度激活,例如在可卡因治疗后(Revel等,2011)。我们测试了RO5263397降低DAT-KO小鼠自发存在的过度活跃的能力。RO5263397剂量依赖性地抑制DAT-KO小鼠的运动活动,在所有测试剂量(0.03,0.1和0.3 mg/kg, i.p)中,0.1 mg/kg剂量的作用最明显(图4A)。在WT小鼠中,RO5263397也表现出明显的运动抑制作用(图4B)。 抗抑郁样作用RO5263397参与AMPA和D1受体[3] 微量胺相关受体1选择性激动剂具有多种体内作用,影响运动和情绪行为。然而,虽然运动行为主要是由多巴胺系统介导的,但对TAAR1对情绪行为影响的神经生物学基础知之甚少。因此,我们在FST中检测RO5263397,以特别研究5HT1A、AMPA或D1受体在大鼠抗抑郁样活性中的作用。与载药组相比,RO5263397显著降低了1和10 mg/kg (p.o.)大鼠的不动能力,分别降低了40%和47%(图5A)。低剂量RO5263397 (0.1 mg/kg p.o.)对静止时间无显著影响。RO5263397仅在10 mg/kg p.o时显著提高了攀爬行为144%。在较低剂量下,0.1和1 mg/kg RO5263397分别增加了26%和62%,尽管这些影响并不显著。在测试的剂量下,对游泳活动没有影响。RO5263397引起的静止时间减少的幅度与氟西汀(10 mg/kg, p.o.)相似,尽管后者也显著增加了游泳时间(图5B)。 然后,为了了解其他神经递质是否参与RO5263397的抗抑郁作用,我们将RO5263397单独或联合D1受体、5-HT1A血清素受体和AMPA受体拮抗剂治疗大鼠。RO5263397单独给药显著减少大鼠在1 mg/kg (p.o)下的不动时间,与载药组相比减少40%(图5C)。RO5263397 (1 mg/kg)与D1受体拮抗剂SCH23390 (0.1 mg/kg, s.c)联用后,小鼠的静止时间较单独用药提高88%,比对照组高14%。与AMPA拮抗剂NBQX (10 mg/kg, s.c)联合使用,与单独使用RO5263397相比,静止时间也显著增加,增加了47%。5-HT1A拮抗剂WAY100635 (1 mg/kg, s.c)对ro5263397诱导的静止时间减少无显著影响。RO5263397单用1 mg/kg (p.o.)或与D1、5-HT1A或AMPA受体拮抗剂合用对攀爬行为无显著影响。然而,在本实验中,RO5263397显著增加了游泳行为,而这一行为被所有三种拮抗剂所减弱。 |
| 酶活实验 |
生物发光共振能量转移(BRET)测量[3]
生物发光共振能量转移实验如前所述(Espinoza et al., 2013)。RO5263397和EPPTB粉末溶解在DMSO中,浓度为10 mM,然后在PBS中稀释至所需浓度。对于时间过程实验,在加入RO5263397后立即读取板,大约20分钟。为了计算EC50值,使用不同浓度的激动剂绘制浓度响应曲线。为了评价EPPTB的拮抗作用,在RO5263397前5min加入拮抗剂。所有实验均在磷酸二酯酶抑制剂3-异丁基-1-甲基黄嘌呤存在的条件下进行,终浓度为200 μM。使用Tecan Infinite仪器收集读数,该仪器允许在465至505 nm和515至555nm窗口中使用具有适当带通的滤波器并使用iControl软件对检测到的信号进行顺序集成。受体/供体比例按先前描述计算(Espinoza et al., 2013)。我们使用EPAC BRET生物传感器监测cAMP水平。使用这种传感器,cAMP的增加反映在BRET比率的降低上。曲线拟合采用非线性回归和GraphPad Prism 5单位点特异性结合。数据为四个独立实验的代表性数据,用均数±SEM表示。 测定人肾上腺素能α2A受体的功能活性:[3] 膜制备:将稳定表达肾上腺素能α2A受体的CHL细胞置于含有胎牛血清(5%,56°C热灭活30分钟)和250µg/ml遗传素的DMEM高糖培养基中,37°C和5% CO2保存。使用胰蛋白酶/ EDTA将细胞从培养瓶中释放出来,收获细胞,用冰冷的PBS(不含Ca2+和Mg2+)洗涤两次,在4°C下以1000 rpm的速度成球5分钟,冷冻并保存在-80°C。冷冻微球悬浮在含有10 mM EDTA的20 ml HEPES-NaOH (20 mM, pH 7.4)中,用Polytron在14000 rpm下均质20 s。匀浆在4℃下48000 x g离心30min。随后,去除上清并丢弃,使用Polytron将颗粒重悬于含有0.1 mM EDTA的20 ml HEPES-NaOH (20 mM, pH 7.4)中(14 ' 000 rpm, 20 s)。重复这一过程,并将最终颗粒重悬在含有0.1 mM EDTA的HEPES-NaOH中,并使用Polytron均质。通常,等分2ml的膜部分保存在-80°C。 小麦胚芽凝集素SPA珠测定:[3] 采用放射性配体[35S] GTPγS,终浓度为0.5 nM。非特异性结合定义为GTP(未标记配体)最终浓度为10µM时GTPγ s的结合量。化合物在广泛的浓度范围内(30 pM至30µM)进行重复测试。去甲肾上腺素作为拮抗活性参考,RX821002作为拮抗剂参考。制备混合物M,其中GDP终浓度为1.5µM,膜含量为5µg蛋白/孔,小麦胚芽凝集素SPA珠含量为1 mg/孔。将测试化合物(20µl/孔)转移到OptiPlate上。加入30µl/孔的缓冲液,其中含有50 mM Tris、5 mM MgCl2、100 mM NaCl、1 mM EDTA和1 mM DTT。为了确定总结合用缓冲液20µl,非特异性结合用10µM的3gtp 20µl。加入100µl mix M和50µl [35S] gtp - γ s进行激动剂测试。然后,OptiPlate在350 rpm/min的转速下,在RT下孵育30分钟,在3000 rpm的转速下离心3分钟。使用TopCount微孔板闪烁计数器计算放射性。加入100µl mix M和50µl [35S] gtp - γ s进行拮抗剂试验。然后,OptiPlate在350 rpm/min的转速下,在RT下孵育5分钟。在含有化合物的孔中加入30µl 20µM的去甲肾上腺素。在350 rpm/min的转速下,在RT下振荡孵育25 min,在3000 rpm下离心3 min。使用TopCount微孔板闪烁计数器计数放射性。将50µl的35s - gtp γ - s试剂计数在5 ml ReadySafe闪烁鸡尾酒中,以确定添加到各自检测中的总计数。 选定化合物[3] 形成谷胱甘肽(GSH)加合物[3] 用100 mM磷酸钾缓冲液(pH7.4)稀释微粒体悬液,制成2 mg/ml溶液。其中一部分在95°C下加热变性10分钟,而另一部分则保持在冰上。变性蛋白溶液在使用前冷却。每次孵育由220.5µl预处理蛋白溶液(见上文,终浓度1mg /ml)和4.5µl底物(终浓度10µM)组成。加热至37°C 10分钟,然后在磷酸盐缓冲液中加入225µl预热谷胱甘肽溶液(终浓度5 mM)。在37℃下,加入150µl猝灭试剂(150:100:1,10%三氯乙酸:乙腈:30%过氧化氢的混合物),孵育10或20分钟后停止孵育。样品在冰上冷冻1小时后离心(20,000x g, 10分钟)。取上清液,用高效液相色谱法分析200µl。质谱分析采用LCQ质谱仪,安装Xcalibur 1.2软件包。 |
| 细胞实验 |
抗体和Western Blot分析[3]
采用抗磷酸化- erk1 /2 (Thr-202/ tir -204)、抗erk、抗磷酸化- creb (Thr-34)和抗creb抗体。为了分析RO5263397对HEK-293细胞中taar1介导的细胞内信号事件的影响,我们在细胞中短暂表达hTAAR1或mTAAR1。转染24 h后,用RO5263397处理细胞,浓度范围为0.01 ~ 100 nM(浓度响应实验)或相同浓度,然后在不同时间点裂解细胞(时间过程实验)。用含有蛋白酶和磷酸酶抑制剂的RIPA缓冲液裂解细胞。在冰上孵育10分钟后,裂解物在13000 rpm下离心10分钟,收集上清液进行蛋白浓度测定。用10% SDS/PAGE分离蛋白提取物25 μg,转移到硝化纤维素膜上。所有一抗在4°C下孵育过夜。使用合适的过氧化物酶偶联二抗和化学发光试剂。为了进行定量分析,总蛋白作为磷蛋白信号的加载对照。用RO5263397获得的结果归一化到各自的Vehicle对照。 生物试验部分[1] 结果来自至少三个独立的实验。实验至少是重复进行的。EC50值以nM为单位给出平均值。TAAR1受体的功能活性数据的Emax值描述了与天然配体和完全激动剂苯乙胺相比的100%的功能活性程度。Emax<85%的化合物被认为是部分激动剂。hTAAR1与hα2A的功能选择性比由hα2A的EC50或IC50值除以hTAAR1的EC50值确定。 cAMP法测定人和大鼠TAAR1受体的功能活性[3] 表达人、小鼠或大鼠TAAR1的重组HEK293细胞在37℃、5% CO2 / 95%空气条件下于Falcon培养瓶中30 ml培养基中培养。细胞培养基中含有DMEM高葡萄糖、胎牛血清(10%,未透析,在56℃下热灭活30min)、遗传素(375µg/ml, Gibco)和青霉素/链霉素(1%)。当细胞融合80 - 90%时收获细胞。从培养瓶中取出培养基,用5ml PBS洗涤细胞一次。除去PBS后,加入5 ml胰蛋白酶/ EDTA溶液,在37℃下静置5 min。随后,在5 ml分离的细胞液中加入45 ml培养基,并将总共50 ml的培养基转移到Falcon试管中。在RT下900 rpm离心5分钟,去除上清。将细胞颗粒重悬于新鲜培养基中,使其浓度达到5 × 10个E5细胞/ ml,然后用多移液管(100µl/孔,50’000个细胞/孔)将细胞接种于96孔板中,37℃孵育20 h。 对细胞的刺激:[1] 取出细胞培养基,加入100µl PBS(不含AMIMED内毒素),在RT下振荡5 min后,取出PBS,加入90µl含有1 mM IBMX的PBS。振荡细胞2分钟后,在37°C和5% CO2 / 95%空气中孵育10分钟。所有化合物在广泛的浓度范围(100 pM至10µM)下进行重复测试。通常,加入10 μ l PBS和1 mM IBMX的复合溶液或10 μ l 0.3 mM β-苯乙胺溶液(作为最大响应)或10 μ l 2% DMSO溶液(作为基础水平),振荡10分钟后,细胞2在37°C下孵养30分钟。然后,除去溶液,用150µl裂解缓冲液裂解细胞。摇匀30分钟,-20℃保存。 cAMP测定(Millipore cAMP kit):[1] 在96孔兔抗cAMP抗体包被板中,加入50µl cAMP标准品(8个标准品从1 pmol/µl到0.0039 pmol/µl, 1个不加cAMP)或50µl细胞板样品。在每个板上做一个标准曲线。在所有孔中加入稀释的cAMP碱性磷酸酶偶联示踪剂25µl,然后加入稀释的兔抗cAMP抗体50µl。密封后,板在室温下振荡孵育30分钟,然后用自动洗板机从每孔中取出上清,并用1倍洗涤缓冲液洗涤5次。然后加入稀释后的碱性磷酸酶底物100µl,封板,摇瓶室温孵育30 min。最后,用光度计(1420 Multilabel计数器)读取1 s。 |
| 动物实验 |
Animal/Disease Models: Adult 4-5 month old male WT littermates (C57BL/6 background) [2]
Doses: 0.1, 0.3, 1 mg/kg Mode of Route of Administration: po; almost completely suppressed for 6 hrs (hrs (hours)) [3]. Mid-light phase dosing (ZT6) Experimental Results: increased wake time at 0.3 and 1 mg/kg. TAAR1 agonism. All mice received p.o. RO5263397 (0.1, 0.3, and 1 mg/kg), Caf (10 mg/kg), or vehicle (0.3% Tween-80) in the mid-light phase (ZT6) in balanced order with at least 3 days between treatments. Mice were acclimated to oral dosing with vehicle (Veh) for at least 3 days before data collection.[2] Locomotor Activity [3] Effect of RO5263397 on spontaneous locomotor activity of DAT-KO or WT mice was tested as described previously (Revel et al., 2011). Briefly, DAT-KO or WT mice were placed in the locomotor activity chambers for 30 min and then were treated with either saline or RO5263397 at different doses and total distance traveled was measured by analyzing infrared beam interruptions for another 90 min. Forced Swim Test [3] Male Spraque-Dawley rats (230–270 g) were used in the FST. The test was performed in a glass cylinder (46 cm × 20 cm), with tap water 25 cm deep and +24–25°C. Water was refreshed after each test and it was performed over two consecutive days. On the first day, the rats were forced to swim for a 15-min period and immediately after that the first dose of test compound or vehicle was administered (5 ml/kg p.o.). The second drug or vehicle administration was on the next day, 23 h after the first dosing. One hour after the second administration and 24 h after the first swimming session, the rats were subjected to a second 5-min swimming session and immobility, climbing and swimming time were registered. Rats were considered to show immobility when animals were inactive and displaying minor movements with one limb only; climbing behavior was registered when the rats were actively climbing at the walls of the cylinder; finally, time spent swimming (horizontal activity) was measured as the remaining time after immobility and climbing have been subtracted from total test time. After each FST session, the rats were dried with towel and allow rest under heating lamp. RO5263397 (0.1, 1.0, and 10 mg/kg) formulations were prepared in 5% Tween 80 in sterile H2O. Each formulation was freshly prepared each day of dosing. In experiments examining the effects of dopamine D1 (D1) receptor antagonist SCH23390 (0.1 mg/kg, s.c.), glutamate AMPA receptor antagonist NBQX (10 mg/kg, s.c.), and serotonin 5-HT1A antagonist WAY100635 (1 mg/kg, s.c.) the antagonists were administered 10 min prior to RO5263397. The dose selection for SCH23390, WAY100635, and NBQX was based on previous work with these agents (Jordan et al., 2005; Snigdha et al., 2011). Statistical analysis was done by using one-way ANOVA followed by Dunnett’s post hoc test. |
| 药代性质 (ADME/PK) |
Pharmacokinetic analyses in rat, mouse, and cynomolgous monkey revealed very favorable in vivo properties, which have already been reported elsewhere. [Mol. Psychiatry 2013, 18, 543–556]
|
| 参考文献 |
|
| 其他信息 |
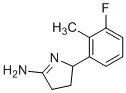
2-Aminooxazolines were discovered as a novel structural class of TAAR1 ligands. Starting from a known adrenergic compound 1, structural modifications were made to obtain highly potent and selective TAAR1 ligands such as 12 (RO5166017), 18 (RO5256390), 36 (RO5203648), and 48 (RO5263397). These compounds exhibit drug-like physicochemical properties, have good oral bioavailability, and display in vivo activity in a variety of animal models relevant for psychiatric diseases and addiction. [1]
Trace amine-associated receptor 1 (TAAR1) is a G protein-coupled receptor, which signals through elevating intracellular cAMP levels, and expressed in most vertebrates, including rodents and humans. In recent years, several lines of evidence indicated the role of TAAR1 in the regulation of dopaminergic system and its importance in physiological processes such as locomotion, control of emotional states and cognition. In our study, we used RO5263397, a selective TAAR1 agonist, as a tool and characterized its pharmacology in vitro in HEK293 cells and its effects in vivo in tests assessing potential antidepressant and antipsychotic actions. We found that RO5263397 not only increases cAMP levels at very low concentrations but also can induce the phosphorylation of ERK and CREB in a concentration- and time-dependent manner. Like other TAAR1 agonists, RO5263397 potently suppressed high dopamine-dependent hyperactivity in mice lacking the dopamine transporter. Moreover, RO5263397 produced a strong antidepressant-like effect in the forced swim test comparable to fluoxetine. Furthermore, the antidepressant-like activity was blocked by pretreatment with SCH23390 (dopamine D1 receptor antagonist) or NBQX (glutamate AMPA receptor antagonist) but only in part by WAY100635 (serotonin 5HT1A receptor antagonist). In conclusion, our study confirms some previous in vitro and in vivo findings in relation to the pharmacological effects of RO5263397 but more importantly provides new insight on intracellular signaling pathway and other neurotransmitter receptors modulated by TAAR1 receptor activation.[3] Taken together, in this study we demonstrated that TAAR1 activation not only induce the increase of cAMP levels inside the cells, but also can induce the phosphorylation of two important signaling proteins, the MAP Kinase ERK and the transcription factor CREB. RO5263397 is highly effective in vivo in mice and rats demonstrating potential antipsychotic and antidepressant activity. Moreover, the antidepressant-like effect of the TAAR1 agonist RO5263397 relies on the engagement of other neurotransmitter systems, particularly involving the D1 receptor and the AMPA glutamate receptor.[3] |
| 分子式 |
C10H11FN2O
|
|---|---|
| 分子量 |
194.21
|
| 精确质量 |
194.085
|
| 元素分析 |
C, 44.96; H, 4.91; Cl, 26.54; F, 7.11; N, 10.49; O, 5.99
|
| 相关CAS号 |
1357266-05-7;1357266-80-8
|
| 外观&性状 |
White to off-white solid powder
|
| LogP |
1.4
|
| tPSA |
47.6
|
| 氢键供体(HBD)数目 |
1
|
| 氢键受体(HBA)数目 |
3
|
| 可旋转键数目(RBC) |
1
|
| 重原子数目 |
14
|
| 分子复杂度/Complexity |
244
|
| 定义原子立体中心数目 |
1
|
| InChi Key |
IOHOUWIYOVWGHV-SECBINFHSA-N
|
| InChi Code |
InChI=1S/C10H11FN2O/c1-6-7(3-2-4-8(6)11)9-5-14-10(12)13-9/h2-4,9H,5H2,1H3,(H2,12,13)/t9-/m1/s1
|
| 化学名 |
(4R/S)-4-(3-fluoro-2-methylphenyl)-4,5-dihydro-1,3-oxazol-2-amine
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : ~260 mg/mL (~1338.76 mM)
|
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 6.5 mg/mL (33.47 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 65.0 mg/mL澄清DMSO储备液加入400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 6.5 mg/mL (33.47 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 65.0 mg/mL 澄清 DMSO 储备液加入 900 μL 20% SBE-β-CD 生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 6.5 mg/mL (33.47 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 5.1491 mL | 25.7453 mL | 51.4907 mL | |
| 5 mM | 1.0298 mL | 5.1491 mL | 10.2981 mL | |
| 10 mM | 0.5149 mL | 2.5745 mL | 5.1491 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
|
|