| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 体外研究 (In Vitro) |
瑞米布替尼(实施例 6)在生化酶测定中抑制 Btk 酶活性,IC50 值为 1 nM [1]。在体外 B 细胞激活试验中,瑞米布替尼降低了血液 Btk 酶活性,IC50 值为 0.023 μM。 Sector Lewis 处于麻醉状态,从腹主动脉抽取全血 [1]。
|
|---|---|
| 参考文献 | |
| 其他信息 |
Drug Indication
Treatment of multiple sclerosis Treatment of chronic spontaneous urticaria |
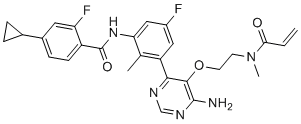
| 分子式 |
C27H27F2N5O3
|
|---|---|
| 分子量 |
507.531792879105
|
| 精确质量 |
507.208
|
| CAS号 |
1787294-07-8
|
| PubChem CID |
118107483
|
| 外观&性状 |
White to off-white solid powder
|
| LogP |
3.9
|
| tPSA |
110
|
| 氢键供体(HBD)数目 |
2
|
| 氢键受体(HBA)数目 |
8
|
| 可旋转键数目(RBC) |
9
|
| 重原子数目 |
37
|
| 分子复杂度/Complexity |
815
|
| 定义原子立体中心数目 |
0
|
| SMILES |
FC1=C(C(NC2C=C(C=C(C3C(=C(N)N=CN=3)OCCN(C(C=C)=O)C)C=2C)F)=O)C=CC(=C1)C1CC1
|
| InChi Key |
CUABMPOJOBCXJI-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C27H27F2N5O3/c1-4-23(35)34(3)9-10-37-25-24(31-14-32-26(25)30)20-12-18(28)13-22(15(20)2)33-27(36)19-8-7-17(11-21(19)29)16-5-6-16/h4,7-8,11-14,16H,1,5-6,9-10H2,2-3H3,(H,33,36)(H2,30,31,32)
|
| 化学名 |
N-(3-{6-amino-5-[2-(N-methylprop-2-enamido)ethoxy]pyrimidin-4-yl}-5-fluoro-2-methylphenyl)-4-cyclopropyl-2-fluorobenzamide
|
| 别名 |
LOU064 LOU-064 LOU 064
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : ~125 mg/mL (~246.29 mM)
|
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.08 mg/mL (4.10 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 20.8 mg/mL澄清DMSO储备液加入400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.08 mg/mL (4.10 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 20.8 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.08 mg/mL (4.10 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.9703 mL | 9.8516 mL | 19.7033 mL | |
| 5 mM | 0.3941 mL | 1.9703 mL | 3.9407 mL | |
| 10 mM | 0.1970 mL | 0.9852 mL | 1.9703 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
A Phase 3 Study of Efficacy and Safety of Remibrutinib in the Treatment of CSU in Adults Inadequately Controlled by H1-antihistamines
CTID: NCT05032157
Phase: Phase 3 Status: Completed
Date: 2024-11-01