| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| 1g |
|
||
| Other Sizes |
|
| 靶点 |
RON (IC50 = 9 nM)
|
|---|---|
| 体外研究 (In Vitro) |
SYN1143(化合物 I)(10-1000 nM;1 小时)抑制 HT-29 和 BxPC3 细胞的功能活性和 c-Met 介导的信号传导[1]。
SYN1143(10-1000 nM;1 小时)抑制 NIH3T3 RON 和 BxPC3 细胞的 RON 介导的信号传导和功能活性[1]。 SYN1143(0.3-30 μM;2 小时或 3 d)抑制 MC3T3-E1 和 C3H10T1/2 细胞中的 c-Met 信号传导和细胞增殖[ 2]. SYN1143(0.3-2 μM;4-12 d)可增加前体细胞成骨分化[2]。 化合物I/SYN1143抑制RON和c-Met的激酶活性。[1] 化合物I的结构如图1A所示。体外激酶实验表明,化合物I是人RON和c-Met的有效抑制剂,ic50分别为9和4 nmol/L。为了确定其选择性,化合物1对一组酪氨酸和丝氨酸/苏氨酸激酶进行了测试。化合物1对Lck、Tie2、Src和BTK具有较弱的抑制活性,ic50值在160 ~ 710 μmol/L之间(图1B),对其他所有被测激酶的ic50值为> μmol/L(>20个激酶;图1 b;数据未显示)。这些数据表明化合物I是RON和c-Met的选择性抑制剂。 化合物I/SYN1143抑制c- met介导的信号传导和功能活性。[1] 为了证实其对c-Met的活性,我们评估了化合物1抑制hgf介导的c-Met磷酸化和下游信号传导的能力。在这些研究中使用了HT-29和BxPC3细胞,因为它们都表达c-Met和RON(图4A)。在这两种细胞系中,外源性HGF刺激c-Met磷酸化和下游信号传导,Gab1、ERK1/2和AKT的磷酸化证明了这一点(图2A)。化合物I以剂量依赖的方式抑制hgf介导的c-Met磷酸化和下游信号传导。此外,化合物1在两种细胞系中抑制c-Met磷酸化的效力相似(图2A)。 化合物I/SYN1143抑制ron介导的信号传导和功能活性。[1] 由于化合物I也抑制RON激酶活性,我们评估了其阻断msp介导的信号传导的能力。由于市场上可买到的phospho-RON抗体都不能通过Western blotting识别合适的分子量带(数据未显示),我们采用免疫沉淀法来测试化合物I对msp诱导的NIH3T3 RON或BxPC3细胞中RON磷酸化的影响。用抗磷酸酪氨酸4G10抗体从MSP和/或化合物I处理的细胞裂解物中免疫沉淀Phospho-RON。然后使用针对受体COOH末端的抗体进行Western blotting检测RON。我们发现化合物I在两种细胞系中都以剂量依赖的方式抑制RON磷酸化(图3A和B,顶部)。然后,我们在NIH3T3 RON细胞或BxPC3中测试了MSP和/或化合物I对下游信号的影响,包括Gab1、ERK1/2和AKT的磷酸化。外源性MSP处理导致NIH3T3 RON细胞中Gab1、AKT和ERK1/2的强烈磷酸化(图3A),而MSP处理导致Gab1的磷酸化较弱,对BxPC3细胞中AKT和ERK1/2的磷酸化几乎没有影响(图3B)。由于MSP的唯一已知受体是RON,因此可以合理地推断,Gab1、AKT和ERK1/2的激活是由RON介导的。化合物1在NIH3T3 RON细胞中以剂量依赖性的方式抑制msp诱导的Gab1、ERK1/2和AKT的磷酸化(图3A),在BxPC3细胞中抑制msp介导的Gab1磷酸化(图3B)。与HGF/c-Met信号传导相比(图2A), MSP/RON信号传导在BxPC3细胞中较弱,对ERK1/2和AKT磷酸化的影响较小(图3B) c-Met特异性小分子激酶抑制剂SYN1143和SGX523体外抑制c-Met信号传导和细胞增殖[2] c-Met化学抑制剂促进前体细胞矿化[2] 我们接下来研究了c-Met抑制剂对前体细胞成骨分化的影响。MC3T3-E1细胞用成骨培养基处理,c-Met抑制剂存在或不存在,浓度为0.3-2 μM)。通过分析MC3T3-E1细胞早期标志物ALP的活性来确定c-Met抑制剂对成骨细胞分化的影响。有趣的是,c-Met抑制剂SYN1143在浓度为1 μM时显著增加ALP活性。SYN1143诱导的ALP活性与BMP2诱导的ALP活性相当(图2A)。细胞外基质矿化是骨形成过程中最重要的过程。基于茜素红染色(AR-S),在相同条件下,c-Met抑制剂SYN1143显著增加矿化(图2A, 2B)。c-Met抑制剂SGX523在低浓度下也具有促进成骨分化的能力(图2A, 2B)。与上述发现一致,c-Met抑制剂还增加了编码骨形成过程中最重要的骨基质蛋白含量的Col1a1、ALP和BSP基因的表达水平(Alford et al., 2015)(图2 - 2e)。在C3H10T1/2细胞中也观察到类似的效果,尽管c-Met抑制剂促进C3H10T1/2细胞成骨分化的能力低于MC3T3-E1细胞(图2F, 2G)。这些结果表明c-Met抑制剂SYN1143和SGX523可能促进前体细胞的成骨分化。 SYN1143或sgx523介导的c-Met抑制通过独立于Erk-Smad的途径增加Runx2 [2] 据报道,HGF可以通过阻止hMSCs和C2C12细胞中Smads的活性磷酸化来抑制BMP2信号通路(Standal et al., 2007)。为了了解c-Met抑制剂调节成骨细胞分化的机制,我们首先检查了c-Met抑制剂对bmp - smad信号活性的影响。在非成骨和成骨诱导条件下,用SYN1143或SGX523治疗并没有显著影响Smads磷酸化活性形式的水平(Smad1的Ser463/465和Smad5的Ser463/465的磷酸化)(图3A, 3B)。据报道,抑制Smad1功能的磷酸化,包括Smad1连接区域Ser206的磷酸化,可以由Erk1/2激活(Kretzschmar等人,1997,Sapkota等人,2007)和HGF激活Ras-Erk1/2途径(Schlessinger, 2004, Yu等人,2001)引起。然而,c-Met抑制剂不影响MC3T3-E1细胞中的Erk1/2或Smad1 Ser206磷酸化(图3B)。这些数据表明c-Met抑制剂可以通过独立于Erk1/2-Smad的途径促进成骨细胞分化。 |
| 体内研究 (In Vivo) |
SYN1143(10-100 mg/kg;口服 22 d)可抑制表达 RON 的肿瘤的生长,这些肿瘤具有持续活性和 c-Met 依赖性[1]。
SYN1143(20-50 μg;转移到颅骨缺损中) )促进小鼠颅骨临界尺寸缺损中新骨的生长[2]。 化合物I/SYN1143抑制c- met依赖性和组成型活性ron表达肿瘤的生长。[1] 尽管已经确定了依赖于c-Met活性的细胞系模型,但很少有(如果有的话)已知RON的等效模型。c-Met、RON的表达,甚至它们的共表达,并不一定意味着肿瘤生长依赖于这些途径。我们的目标是鉴定依赖c-Met或表达组成活性形式的RON的模型,以研究化合物I 的体内抗肿瘤活性 化合物I/SYN1143在两种c- met依赖的异种移植模型中进行评估:U-87 MG和NIH3T3 TPR-Met。这两种模型都依赖于c-Met活性。此外,它们都缺乏RON表达(图4A),排除了通过阻断RON活性介导肿瘤生长抑制的可能性。 [1] 与对照动物相比,每天1次用化合物I/SYN1143治疗NIH3T3 TPR-Met荷瘤小鼠,可产生剂量依赖性的肿瘤生长抑制(图5A)。化合物1在30或100 mg/kg 1次/ d或30 mg/kg 2次/ d剂量下显著抑制肿瘤生长(P < 0.02)。此外,在100mg /kg每日一次的剂量下观察到完全的肿瘤生长抑制。使用化合物I治疗对体重没有不良影响(数据未显示)。为了证实肿瘤生长抑制是由于c-Met活性的抑制而发生的,我们用100 mg/kg的单剂量化合物I治疗NIH3T3 TPR-Met肿瘤小鼠。在给药后的不同时间从小鼠身上摘取肿瘤,分析TPR-Met和Gab1的磷酸化。与未治疗小鼠的肿瘤相比,TPR-Met和Gab1的磷酸化水平在12小时内显著降低,24小时后恢复到接近基础水平(图5B)。从图5A和B所示的实验中评估了化合物I在小鼠血浆中的水平。在两项研究中,以100 mg/kg处理的小鼠在12小时内具有高浓度的化合物I,但在24小时时浓度显著降低(图5C;数据未显示)。这些数据表明,phospho-Gab1和phospho-Met抑制与化合物I的血浆水平相关,反过来,这些变量也与NIH3T3 TPR-Met肿瘤生长抑制相关。化合物1在体内对Src磷酸化没有直接影响,尽管在小鼠体内达到了高浓度(补充图S2B)。 [1] 为了进一步证实化合物I/SYN1143抑制c- met依赖性肿瘤模型的生长,我们对化合物I对已建立的U-87 MG肿瘤异种移植物进行了测试。如图5D所示,化合物1以剂量依赖的方式抑制这些肿瘤的生长。与NIH3T3 TPR-Met模型的数据相似,化合物1在100mg /kg每日1次或30mg /kg每日2次剂量下显著抑制肿瘤生长(P < 0.0001)。 [1] 接下来,我们测试了RONΔ160对HT-29肿瘤生长的贡献。当携带已建立HT-29肿瘤的小鼠每天给药时,化合物I/SYN1143,观察到肿瘤生长有统计学意义的剂量依赖性降低(P < 0.02;图6 a)。移植HT-29异种移植物的小鼠也接受单剂量100 mg/kg的化合物I处理,以评估体内ERK1/2磷酸化的影响。单剂量化合物I后1至12小时,HT-29异种移植物ERK1/2磷酸化被部分抑制(图6B)。体内ERK1/2磷酸化的部分抑制与肿瘤生长的部分抑制相关(图6A),与体外观察到的ERK1/2磷酸化的部分抑制相关(图4C)。有趣的是,O'Toole和他的同事 在使用人类RON单克隆抗体的HT-29异种移植物中也有类似的发现。总之,这些数据表明RONΔ160有助于HT-29细胞的致癌特性。 [1] 为了证实化合物I/SYN1143不具有非特异性抗肿瘤作用,我们在同时表达野生型c-Met和RON的col205异种移植物中对其进行了测试(图4A),但没有显示任何受体构成活性的迹象(数据未显示)。此外,这些细胞与HT-29细胞一样,表达活化的b-Raf突变体V600E。图6C显示,在c- met依赖模型和表达RONΔ160的模型中,化合物I在显著抑制肿瘤生长的剂量下对col205肿瘤的生长没有影响。 c-Met化学抑制剂刺激小鼠颅骨临界尺寸缺陷的骨形成[2] 受损的骨可以通过成骨细胞再生。在小鼠临界尺寸颅骨缺损中研究了c-Met抑制剂对骨再生的影响。采用可吸收胶原海绵将SYN1143 (20,50 μg)或SGX523 (20,50 μg)转移至颅骨缺损。经SYN1143或SGX523治疗3周后,采用μ-CT和组织学检查骨再生区域。与对照组相比,两种c-Met抑制剂产生了边际愈合(图4A)。μ-CT体积分析显示,与胶原海绵对照相比,c-Met抑制剂以剂量依赖的方式诱导骨形成(图4B,左面板)。在缺损内新骨形成的面积分析中,SYN1143 (50 μg)和SGX523 (50 μg)在50%的骨缺损区域产生新骨。在对照组中,只有10%的骨缺损区域被新骨填充(图4B,右面板)。组织学分析显示,携带c-Met抑制剂的缺损区域充满了新形成的骨。在对照组中,缺损区域仅填充纤维组织,未填充骨组织(图4A)。 |
| 酶活实验 |
激酶化验。[1]
c-Met SYN1143/compound I的IC50测量采用均匀时间分辨荧光法测量,如前所述,略有修改。采用改良的激酶反应缓冲液,包括60 mmol/L HEPES (pH 7.4)、50 mmol/L NaCl、20 mmol/L MgCl2和5 mmol/L MnCl2。化合物I在10点连续稀释中进行测试,使用ATP浓度为c-Met的三分之二Km值,并使用edie - hofstee和Lineweaver-Burke方法计算。荧光比在RubyStar仪器上读取。为了测量化合物I对RON的IC50,采用Invitrogen LanthaScreen程序,并使用荧光素-聚gt底物。在Tecan Safire II上读取荧光比率。 |
| 细胞实验 |
Western blot分析。[1]
将细胞培养至融合,血清饥饿过夜,然后用不同浓度的SYN1143/化合物I处理1小时。为了研究化合物I抑制配体依赖性受体激活的能力,用增加浓度的化合物I处理血清饥饿细胞1小时,然后在化合物I存在的情况下用重组人HGF刺激10分钟(250 ng/mL)或MSP刺激30分钟(800 ng/mL)。这些生长因子的浓度是根据先前的剂量反应研究选择的,这些浓度表明这些浓度最大限度地激活了它们的受体。 免疫沉淀反应。[1] 使用抗磷酸酪氨酸4G10抗体,分别从NIH3T3 RON细胞和HT-29细胞中免疫沉淀磷酸化的RON和RONΔ160。随后用RON C-20抗体Western blotting检测RON/RONΔ160。 单层划痕试验。[1] 将NIH3T3 RON和NIH3T3 TPR-Met细胞接种于六孔板,培养至融合。将细胞血清饥饿过夜,然后用不同浓度的SYN1143/化合物I处理1小时。用P200吸管尖端引入间隙。在NIH3T3 RON细胞中,用160 ng/mL MSP C672A单独或MSP C672A和化合物I刺激细胞在间隙中迁移,而NIH3T3 TPR-Met细胞仅用化合物I处理。孵育过夜后,光镜检查细胞并拍照。放大(×40)显示。 细胞增殖试验[1] 利用细胞计数试剂盒-8,采用WST法分析单层培养细胞的增殖情况。细胞用含10%胎牛血清的α-MEM或DMEM培养于96孔板中。一旦达到70%的合度,将培养基改为含有2.5% FBS的α-MEM或DMEM,不含或含SYN1143或SGX523 (0.3, 1, 3, 5, 10, 30 μM),培养24 h。然后在每孔中加入CCK-8溶液(10µl),在37°C下孵育1 h。使用酶标仪测定450 nm处的吸光度。以含10% CCK-8的α-MEM或DMEM为对照。 |
| 动物实验 |
Female CD1 nu/nu mice (6-8 weeks) bearing NIH3T3 TPR-Met s.c. tumors[1]
10, 30, 100 mg/kg Oral gavage either once or twice daily for 22 days Xenograft studies. [1] NIH3T3 TPR-Met (1 × 106), U-87 MG (5 × 106), HT-29 (2 × 106 with Matrigel at a ratio of 2:1), or Colo205 (2 × 106 with Matrigel) cells were injected s.c. in the right flank of female CD1 nu/nu mice (n = 10 per group). SYN1143/Compound I treatment began either 1 d after tumor implantation or when tumors were established (∼200 mm3). Compound I/SYN1143 was formulated in 2% hydroxypropylmethylcellulose 1% Tween 80 in water (pH 2.2 adjusted with HCl). Mice were dosed by oral gavage either once or twice daily. Tumor volume was measured twice weekly with a Pro-Max Fowler Digital Ultra Caliper (Fred Fowler Co., Inc.) as length (mm) × width (mm) × height (mm) and expressed as cubic millimeters. Data are expressed as mean ± SE for each group and plotted as a function of time. The statistical significance of observed differences between growth curves was evaluated by repeated measures ANOVA followed by Scheffe post hoc test. To assess the pharmacodynamic effect in tumors, mice bearing established (∼300–400 mm3) NIH3T3 TPR-Met or HT-29 xenograft tumors were treated with a single dose of compound I at 100 mg/kg. Tumors were harvested (n = 3 per time point) at the indicated times after treatment and immediately frozen in liquid nitrogen. Western blot analysis was performed to determine the effect of treatment on the phosphorylation of c-Met and Gab1, an adaptor protein immediately downstream of c-Met, or ERK1/2, which is downstream of RON. Animal studies, radiographic and histology analyses [2] Six-week-old male mice were randomly assigned to each experimental group. These animals were anesthetized with an intraperitoneal injection of a mixture of Zoletil (30 mg/kg) and Rompun (10 mg/kg. A critical-sized calvarial defect was created by using a 5-mm diameter trephine bur. The c-Met inhibitor SYN1143 or SGX523 was administered into the defect with absorbable collagen sponges. Three weeks after the administration, bone formation was evaluated by using a two-dimensional radiographic apparatus and three-dimensional micro-computed tomography (μ-CT) system. For soft X-ray analysis, scanned images were collected using diagnostic X-ray film under the following conditions: 35 kVp and 400 μA for 45 s. For μ-CT analysis, the scanned images were collected at 50 kV and 200 μA. These images were reconstructed using NRecon and CT analyzer software. 3D surface rendering image and repaired bone volume were obtained by using Mimics imaging program. For histology study, the implant or calvarial specimens were harvested, fixed in 10% neutral-buffered formalin, decalcified in Calci-Clear Rapid, embedded in paraffin, and then sectioned (4 µm in thickness). These sections were stained with hematoxylin/eosin to evaluate general tissue response and bone formation. |
| 药代性质 (ADME/PK) |
Pharmacokinetics. [1]
Mouse plasma samples (20 μL) were extracted by using protein precipitation to isolate SYN1143/compound I and internal standard. Extracted samples were separated by reversed-phase liquid chromatography on a Varian Pursuit C18 analytic column (30 × 2.0 mm, 5 μm). The reagents were water with 0.1% formic acid (mobile phase A) and acetonitrile with 0.1% formic acid (mobile phase B). Gradient at a flow rate of 0.6 mL/min was used, with a total run time of 2 min. SYN1143/Compound I concentrations were determined in mouse samples by liquid chromatography-tandem mass spectrometry using ion atmospheric pressure ionization with multiple reaction monitoring in the positive ion mode. Peak areas were integrated by the Sciex program Analyst, version 1.4.1. The data were then exported to the software package Small Molecules Discovery Assay Watson where concentrations were determined by a weighted (1/×2) linear regression of peak area ratios (peak area of compound I/peak area of internal standard) versus the theoretical concentrations of the calibration standards. Overall precision and accuracy for the calibration standards and QC samples were determined by Small Molecules Discovery Assay Watson. |
| 参考文献 |
|
| 其他信息 |
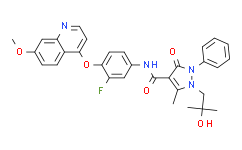
N-[3-fluoro-4-[(7-methoxy-4-quinolinyl)oxy]phenyl]-1-(2-hydroxy-2-methylpropyl)-5-methyl-3-oxo-2-phenyl-4-pyrazolecarboxamide is an aromatic amide.
Recepteur d'origine nantais (RON) is a receptor tyrosine kinase closely related to c-Met. Both receptors are involved in cell proliferation, migration, and invasion, and there is evidence that both are deregulated in cancer. Receptor overexpression has been most frequently described, but other mechanisms can lead to the oncogenic activation of RON and c-Met. They include activating mutations or gene amplification for c-Met and constitutively active splicing variants for RON. We identified a novel inhibitor of RON and c-Met, compound I, and characterized its in vitro and in vivo activities. Compound I selectively and potently inhibited the kinase activity of RON and c-Met with IC(50)s of 9 and 4 nmol/L, respectively. Compound I inhibited hepatocyte growth factor-mediated and macrophage-stimulating protein-mediated signaling and cell migration in a dose-dependent manner. Compound I was tested in vivo in xenograft models that either were dependent on c-Met or expressed a constitutively active form of RON (RONDelta160 in HT-29). Compound I caused complete tumor growth inhibition in NIH3T3 TPR-Met and U-87 MG xenografts but showed only partial inhibition in HT-29 xenografts. The effect of compound I in HT-29 xenografts is consistent with the expression of the activating b-Raf V600E mutation, which activates the mitogen-activated protein kinase pathway downstream of RON. Importantly, tumor growth inhibition correlated with the inhibition of c-Met-dependent and RON-dependent signaling in tumors. Taken together, our results suggest that a small-molecule dual inhibitor of RON/c-Met has the potential to inhibit tumor growth and could therefore be useful for the treatment of patients with cancers where RON and/or c-Met are activated. [1] The c-Met receptor tyrosine kinase and its ligand, hepatocyte growth factor (HGF), have been recently introduced to negatively regulate bone morphogenetic protein (BMP)-induced osteogenesis. However, the effect of chemical inhibitors of c-Met receptor on osteoblast differentiation process has not been examined, especially the applicability of c-Met chemical inhibitors on in vivo bone regeneration. In this study, we demonstrated that chemical inhibitors of c-Met receptor tyrosine kinase, SYN1143 and SGX523, could potentiate the differentiation of precursor cells to osteoblasts and stimulate regeneration in calvarial bone defects of mice. Treatment with SYN1143 or SGX523 inhibited HGF-induced c-Met phosphorylation in MC3T3-E1 and C3H10T1/2 cells. Cell proliferation of MC3T3-E1 or C3H10T1/2 was not significantly affected by the concentrations of these inhibitors. Co-treatment with chemical inhibitor of c-Met and osteogenic inducing media enhanced osteoblast-specific genes expression and calcium nodule formation accompanied by increased Runx2 expression via c-Met receptor-dependent but Erk-Smad signaling independent pathway. Notably, the administration of these c-Met inhibitors significantly repaired critical-sized calvarial bone defects. Collectively, our results suggest that chemical inhibitors of c-Met receptor tyrosine kinase might be used as novel therapeutics to induce bone regeneration. [2] |
| 分子式 |
C31H29FN4O5
|
|---|---|
| 分子量 |
556.58
|
| 精确质量 |
556.212
|
| 元素分析 |
C, 68.88; H, 5.41; F, 3.51; N, 10.36; O, 11.84
|
| CAS号 |
913376-84-8
|
| 相关CAS号 |
913376-84-8
|
| PubChem CID |
16757524
|
| 外观&性状 |
Light yellow to yellow solid powder
|
| 密度 |
1.3±0.1 g/cm3
|
| 折射率 |
1.660
|
| LogP |
4.39
|
| tPSA |
107.61
|
| 氢键供体(HBD)数目 |
2
|
| 氢键受体(HBA)数目 |
8
|
| 可旋转键数目(RBC) |
8
|
| 重原子数目 |
41
|
| 分子复杂度/Complexity |
986
|
| 定义原子立体中心数目 |
0
|
| SMILES |
O=C(C1=C(C)N(CC(C)(C)O)N(C2C=CC=CC=2)C1=O)NC1C=C(F)C(OC2C3C(=CC(=CC=3)OC)N=CC=2)=CC=1
|
| InChi Key |
UYMSIPINLJNNOU-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C31H29FN4O5/c1-19-28(30(38)36(21-8-6-5-7-9-21)35(19)18-31(2,3)39)29(37)34-20-10-13-27(24(32)16-20)41-26-14-15-33-25-17-22(40-4)11-12-23(25)26/h5-17,39H,18H2,1-4H3,(H,34,37)
|
| 化学名 |
N-[3-fluoro-4-(7-methoxyquinolin-4-yl)oxyphenyl]-1-(2-hydroxy-2-methylpropyl)-5-methyl-3-oxo-2-phenylpyrazole-4-carboxamide
|
| 别名 |
RON-IN-1; RONIN1; RON inhibitor 1; 913376-84-8; N-[3-Fluoro-4-[(7-methoxyquinolin-4-yl)oxy]phenyl]-1-(2-hydroxy-2-methylpropyl)-5-methyl-3-oxo-2-phenyl-2,3-dihydro-1H-pyrazole-4-carboxamide; N-(3-Fluoro-4-((7-methoxyquinolin-4-yl)oxy)phenyl)-1-(2-hydroxy-2-methylpropyl)-5-methyl-3-oxo-2-phenyl-2,3-dihydro-1H-pyrazole-4-carboxamide; N-{3-fluoro-4-[(7-methoxyquinolin-4-yl)oxy]phenyl}-1-(2-hydroxy-2-methylpropyl)-5-methyl-3-oxo-2-phenyl-2,3-dihydro-1H-pyrazole-4-carboxamide; AMG-1; SYN1143; RON-IN-1; N-[3-fluoro-4-(7-methoxyquinolin-4-yl)oxyphenyl]-1-(2-hydroxy-2-methylpropyl)-5-methyl-3-oxo-2-phenylpyrazole-4-carboxamide; RON IN 1; Met Kinase Inhbitor IV ; RON inhibitor-1; Ron Inhibitor I
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO: ~100 mg/mL (179.7 mM)
Ethanol: ~60 mg/mL (107.8 mM) |
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: 2.5 mg/mL (4.49 mM) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 悬浮液;超声助溶。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (4.49 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.5 mg/mL (4.49 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.7967 mL | 8.9834 mL | 17.9669 mL | |
| 5 mM | 0.3593 mL | 1.7967 mL | 3.5934 mL | |
| 10 mM | 0.1797 mL | 0.8983 mL | 1.7967 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。