| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
Src (IC50 = 2.7 nM); v-Abl (IC50 = 30 nM); EGFR (IC50 = 66 nM); c-Kit (IC50 = 200 nM)
|
||
|---|---|---|---|
| 体外研究 (In Vitro) |
一种名为Saracatinib (AZD0530)的口服 Src 抑制剂已被证明在体外具有很强的抗迁移和抗侵袭特性。它还可以预防小鼠模型中的膀胱癌转移。 Saracatinib 的抗增殖功效因细胞系而异(IC50 0.2-10 μM)。 Saracatinib 在表达内源性 Src 的多种人类癌细胞系中表现出不同的抗增殖功效,并有效抑制 Src3T3 小鼠成纤维细胞的增殖。用萨拉卡替尼检查的五种人类癌细胞系获得了 0.2-0.7 μM 的 IC50 值,代表结肠癌、前列腺癌、肺癌和白血病肿瘤类型,表明亚微摩尔生长抑制。在 3 天的 MTS 细胞增殖测试中,Saracatinib 可抑制 Bcr-Abl 驱动的人白血病细胞系 K562 的增殖,IC50 为 0.22 μM。在微滴迁移试验中,Saracatinib 以浓度依赖性方式降低人肺癌 A549 细胞的运动 (IC50 0.14 μM)[1]。
抑制分离的蛋白激酶活性[1] Saracatinib(AZD0530)能有效抑制Src和所研究的其他Src酪氨酸激酶家族成员(c‐Yes、Fyn、Lyn、Blk、Fgr和Lck),对参与信号转导的一组其他蛋白激酶具有高度选择性(表1),包括Src激活的细胞内负调节因子Csk。观察到的唯一其他显著活性是与Abl(与其他ATP竞争性Src抑制剂一样(Golas等人,2003;Lombardo等人,2004))和与激活EGFR突变形式(L858R和L861Q)。 抑制细胞增殖[1] Saracatinib(AZD0530)有效抑制Src3T3小鼠成纤维细胞的体外增殖,并在一系列含有内源性Src的人类癌症细胞系中表现出可变的抗增殖活性(表2)。观察到用AZD0530测试的五种人类癌症细胞系(肿瘤类型:结肠、前列腺、肺和白血病)的亚微摩尔生长抑制,IC50值为0.2–0.7μM。在为期3天的MTS细胞增殖试验(Promega G3580)中,AZD0530抑制了Bcr-Abl驱动的人白血病细胞系K562的体外增殖,IC50为0.22μM。 抑制细胞迁移[1] 在微滴迁移测定中,Saracatinib(AZD0530)以浓度依赖性方式减少了人类肺癌A549细胞的迁移(IC50 0.14μM;图1A)。在人类乳腺癌症MDA-MB-231细胞的单层划痕试验中,与未经治疗的对照组相比,浓度为0.01–0.5μM的AZD0530表现出明显的剂量依赖性抗迁移作用(图1B)。AZD0530还剂量依赖性地抑制NBT-II膀胱癌症细胞的EGF和胶原刺激的迁移(图1C)。此外,在0.25μM的单一浓度下,AZD0530在膀胱癌症细胞系的单层划痕测定中持续抑制迁移(在T24、SCaBER和1A6细胞系中,与未处理的对照相比,分别抑制31%、37%和78%)。 抑制细胞侵袭[1] Saracatinib(AZD0530)治疗显著削弱了HT1080细胞通过三维(3D)胶原基质的侵袭(图1D)。与其他3D侵袭检测相比,我们的检测(见方法)监测了3D基质中侵袭超过指定深度(60μm)的总细胞比例,从而将抑制的细胞侵袭与可能由于粘附、增殖或过度细胞死亡而导致的细胞损失区分开来。该方法证实,AZD0530暴露对HT1080细胞的侵袭特性产生了显著的剂量依赖性抑制。 抑制细胞散射[1] Saracatinib(AZD0530)1μM完全抑制NBT-II膀胱癌症细胞中EGF诱导的细胞散射,恢复细胞-细胞粘附和桥粒蛋白在桥粒连接处的定位(图2A)。 抑制paxillin磷酸化[1] Saracatinib(AZD0530)剂量依赖性抑制NBT-II膀胱癌症细胞中Src底物帕罗西林的磷酸化(图2B)。此外,AZD0530处理(1μM)诱导paxillin从细胞膜重新定位到细胞质中(图2C),进一步支持Src在细胞迁移行为早期发展中的作用。 对EGFR的影响[1] 鉴于在分离激酶测定中观察到Saracatinib(AZD0530)对EGFR的中度抑制作用(IC50 66nM;表1),进行了进一步的研究以研究AZD0530对EGFR的影响。在测量KB细胞中EGFR磷酸化的头对头试验中,AZD0530的IC50为1.25μM,而EGFR酪氨酸激酶抑制剂吉非替尼的IC50为11nM。在分离的激酶检测中,AZD0530对EGFR点突变亚型L858R和L861Q的IC50分别为5和4nM。在PC–9细胞中进一步研究了对EGFR L858R异构体的影响,PC–9是一种携带这种EGFR突变的非小细胞肺癌(NSCLC)细胞系。AZD0530在3天MTS细胞增殖试验中抑制PC-9细胞的生长,IC50为0.23μM。 酶动力学[1] Src激酶与100nM Saracatinib(AZD0530)预孵育(在160μM ATP存在的情况下)导致Src活性抑制率>95%。在高浓度ATP(1.60mM)存在下,将AZD0530稀释10倍至10nM,导致Src活性恢复,仅抑制30%,表明抑制是可逆的。在没有稀释步骤的情况下,对于相同的AZD0530和ATP终浓度,观察到类似程度的抑制。 可逆性研究表明,Saracatinib(AZD0530)与ATP具有竞争性,正如其他苯胺喹唑啉类药物所报道的那样(Bridges,2001)。在实验中证实了ATP竞争性抑制,其中ATP和AZD0530的浓度在固定浓度的底物Src II肽下变化。估计的抑制常数K为1.5,95%置信区间(CI)为1.2、1.9nM。这低于表1中报告的2.7nM的IC50,因为它与不存在竞争性ATP的情况有关。当Src II肽的浓度在250μM ATP下变化时,AZD0530显示出遵循纯非竞争动力学,表观K i′为10nM(95%CI 8.4,12.0;图3A和B),这对应于在没有ATP的情况下K i为1.1nM(95%CI 0.9,1.3)。许多激酶在其活性和非活性形式之间存在结构差异(Huse和Kuriyan,2002)。失活的Src采用封闭构象,AZD0530与失活Src的结合力弱约10倍(K d 11nM;95%CI 9.3,14)。 c-Met和Src的双重抑制比单独使用任何一种抑制剂都更有效[2] 用Saracatinib(AZD0530)/萨拉卡替尼(0.5μmol/L)和增加卡博扎替尼浓度处理的MD MSCs,卡博扎替尼的IG50降低了三倍(0.6μmol/L,而单独使用卡博扎替尼为2.2μmol/L),选择性是WT MSCs的五倍多(IG50=3.4μmol/L;图4A)。用Saracatinib(AZD0530)(0.5μmol/L)和增加卡博扎替尼浓度处理MD MSCs,6小时后导致c-Met(Y1234/1235)、Erk1/2和Akt(T308)磷酸化水平降低(图4B)。联合治疗24小时后,MD-MSCs在较低的cabozantinib浓度下,细胞周期蛋白D1水平降低,p27水平升高,与单独使用cabozantini治疗相比(图4C)。 c-Met和Src的双重抑制降低了原代VS细胞的存活率[2] 我们研究了这种药物组合在降低从两名患者获得的原代VS细胞存活率方面的疗效。VS01是一种散发性VS,具有NF2外显子5的杂合重复和外显子7的纯合重复。VS02来自一名NF2患者,外显子14缺失。VS细胞与卡博扎替尼(2μmol/L)和Saracatinib(AZD0530)/萨拉卡替尼(AZD0530)单独或联合培养48小时。对于VS01和VS02,与赋形剂(0.3%DMSO)相比,联合治疗使VS细胞存活率降低了约35%-40%,并且比单独使用萨拉卡替尼更有效。此外,对于VS01细胞,联合治疗比单独使用cabozantinib更有效(图4D)。 |
||
| 体内研究 (In Vivo) |
Saracatinib (AZD0530) 治疗可有效且剂量依赖性地抑制小鼠和大鼠皮下移植的 Src3T3 成纤维细胞的增殖。在剂量≥6 mg/kg/天的两种模型中均观察到显着的肿瘤生长抑制(与用媒介物治疗的动物相比,小鼠为 60%,大鼠为 98%),并且在所研究的最高剂量下观察到完全肿瘤生长抑制(100%大鼠和小鼠分别为 25 mg/kg/天和 10 mg/kg/天)[1]。
Src3T3同种异体移植物和异种移植物[1] Saracatinib(AZD0530)治疗以剂量依赖的方式显著抑制了小鼠(图4B)和大鼠(Hennequin等人,2006)皮下移植的Src3T3成纤维细胞的增殖。在这两种模型中,当剂量≥6mg/kg/天时,肿瘤生长受到显著抑制(与用赋形剂治疗的动物相比,小鼠的抑制率为60%[P<0.01],大鼠的抑制率达到98%[P<0.001]),在所研究的最大剂量下,观察到完全的肿瘤生长抑制(小鼠在25mg/kg/天和大鼠在10mg/kg/天时受到100%的抑制)(Hennequin等人,2006)。 人肿瘤异种移植物[1] 在所测试的4/10异种移植物模型中,每天口服一次Saracatinib(AZD0530)导致中度生长延迟(表3)。在异种移植物组的其余部分,AZD0530治疗未能抑制原发性肿瘤生长。AZD0530生长抑制敏感模型(Calu-6)和AZD0530增长抑制不敏感模型(LoVo)的代表性异种移植物生长延迟曲线分别如图4C和D所示。通过血管数量或CD31阳性血管评估,AZD0530不影响异种移植物模型中肿瘤血管的任何方面(数据未显示)。 NBT-II膀胱癌症转移模型[1] 在携带NBT-II膀胱癌症细胞皮下异种移植物的裸鼠中,每日一次Saracatinib(AZD0530)剂量为10、25和50mg/kg/天的治疗仅在最高剂量下导致异种移植物生长的小而不显著的延迟(50mg/kg/日;图4E)。相比之下,所有三种剂量的AZD0530都导致从肠系膜淋巴结提取物中生长肿瘤集落的小鼠数量减少(图5A)。在另一项实验中,AZD0530的抗转移作用似乎不受细胞接种和给药之间7天延迟的影响。在肿瘤细胞接种后7天开始用AZD0530 50mg/kg/天治疗的一组中,七分之一的小鼠发生了转移,在细胞接种后立即开始用相同剂量治疗的组中,有七分之一发生了转移。 Src激酶底物FAK和paxillin的磷酸化[1] 使用磷酸特异性抗体通过免疫组织化学评估的磷酸化FAK(pY861)和paxillin(pY31)水平在接受萨拉卡替尼(AZD0530)50mg/kg/天治疗14-28天后,在患有生长抑制敏感和生长抑制不敏感异种移植物的动物的肿瘤中显著降低(图5B-D)。检测FAK或paxillin非磷酸表位的抗体对这两种蛋白质的表达均无影响(数据未显示)。 c-Met和Src的双重抑制减缓了MD-MSC在体内的生长[2] 为了评估cabozantinib和Saracatinib(AZD0530)的体内疗效,将表达萤光素酶的MD-MSCs移植到NSG小鼠的坐骨神经中,并通过生物发光成像(BLI)监测移植大小。在确认移植成功后(补充图S2A),将小鼠分为赋形剂、卡博扎替尼(12.5mg/kg/天)、萨拉卡替尼(25mg/kg/天)和联合治疗组(卡博扎替尼和萨拉卡替尼分别为12.5mg/kg/日和25mg/kg/日)。BLI显示,与单一药物组相比,联合治疗组的移植物生长速度明显较慢(图5A和B)。尽管载体处理的同种异体移植物在14天内BL信号增加了160倍,但用萨拉卡替尼或卡博扎替尼处理的移植物BL信号分别增加了50倍和60倍。值得注意的是,联合组的同种异体移植物在治疗14天后BL信号仅增加了25倍(图5C)。与赋形剂组相比,联合治疗组BL信号的减少与较低的肿瘤重量相关(图5D;补充图S2B)。 c-Met和Src的双重抑制调节同种异体移植物中的FAK和ERK信号通路[2] 为了评估药物治疗调节的信号通路,通过免疫组织化学分析了同种异体移植物切片。与体外研究结果类似,与载体对照组相比,萨拉卡替尼(AZD0530)降低了FAK磷酸化水平,卡博扎替尼降低了ERK1/2磷酸化水平(图5E)。在联合治疗的同种异体移植物中也观察到了这些变化。此外,与载体对照组相比,卡博扎替尼治疗的移植物内皮细胞的CD31染色减少,表明卡博扎替尼在体内也靶向血管系统(图5E)。与赋形剂治疗的小鼠相比,单独或联合使用卡博扎替尼或萨拉卡替尼治疗的小鼠移植的细胞周期蛋白D1和Ki67阳性细胞较少。此外,与赋形剂组和单一治疗组相比,联合治疗组的移植物具有升高的切割胱天蛋白酶3染色(图5E),支持药物联合诱导体内MD-MSCs凋亡的结论。 c-Met和Src的双重抑制诱导MD-MSC凋亡[2] 为了证实体内发现,我们研究了培养的MD-MSCs中胱天蛋白酶依赖性凋亡。仅当以高剂量(3μmol/L萨拉卡替尼或10μmol/L卡博扎替尼)给药19至24小时时,单独使用卡博扎替尼或萨拉卡替尼(AZD0530)才会触发半胱天冬酶3/7活性(图6A)。然而,与单独使用卡博扎替尼相比,将MD MSCs与萨拉卡替尼(0.5μmol/L)联合治疗并增加卡博扎替尼浓度可诱导卡博扎替尼浓度低100倍的胱天蛋白酶3/7活性(0.1μmol/L vs.10μmol/L;图6A)。同样,用卡博扎替尼(0.5μmol/L)处理并增加萨拉卡替尼浓度的MD MSCs诱导胱天蛋白酶3/7活性,与单独使用萨拉卡替尼比低约30倍(0.1μmol/L对3μmol/L;图6A)。膜不对称性分析证实,与单独使用任何一种药物相比,药物组合诱导了更大的凋亡细胞群(图6B)。2μmol/L萨拉卡替尼治疗导致6.2%的凋亡细胞、4.8%的死细胞和88.4%的活细胞,而2μmol/L卡博扎替尼治疗则导致7.7%的凋亡细胞,9%的死细胞,82.8%的活细胞。19小时后,联合治疗将凋亡群体增加到20%(图6C)。单独给药时,萨拉卡替尼不会诱导胱天蛋白酶3的切割。卡博扎替尼在1μmol/L时诱导胱天蛋白酶切割,而在0.5μmol/L萨拉卡替尼存在的情况下,卡博扎替尼在0.1μmol/L时检测到胱天蛋白酶断裂(图6D)。总的来说,我们的结果表明,尽管单独的药物可以促进MD-MSCs的G1细胞周期阻滞,但萨拉卡替尼和卡博扎替尼的组合具有细胞毒性,可以促进胱天蛋白酶3/7依赖性凋亡。 |
||
| 酶活实验 |
分离蛋白激酶测定[1]
使用酶联免疫吸附试验(ELISA)检测酪氨酸激酶活性的抑制作用,该试验使用一组受体和非受体酪氨酸激酶的重组催化结构域(在某些情况下仅使用部分催化结构域)。这种方法之前已经描述过(Plé等人,2004)Saracatinib(AZD0530)剂量范围因所测试的特定激酶的活性而异,但通常为0.001-10μM 使用32P的过滤器捕获试验对一组丝氨酸/苏氨酸激酶进行特异性试验。简而言之,在加入10μL 20mM Mg.ATP引发反应之前,将含有0.5μLSaracatinib(AZD0530)或对照(单独使用二甲亚砜[DMSO]或pH 3.0缓冲液对照)的多滴384板与15μL酶加肽/蛋白质底物一起孵育5分钟。对于所有酶,最终浓度近似为米氏常数(K m)。在室温下进行30分钟的测定,然后加入5μL正磷酸终止测定。混合后,使用正磷酸作为洗涤缓冲液,将孔内容物收获到P81单滤板上。Microcal Origin软件用于通过非线性回归插值IC50值。 酶动力学[1] 使用全长活化的人Src(酪氨酸416磷酸化),在改编自Jenkins(1991)的连续偶联试验中,对 Saracatinib (AZD0530)的可逆性和机制进行了研究。在非变化底物(ATP 1.6mM;Src II肽1.0mM)的饱和浓度下,ATP和肽底物(Src II多肽)浓度依次变化(ATP 40-1280μM;SrcⅡ肽100-800μM),并与 Saracatinib (AZD0530)(0-30nM)结合。 Saracatinib (AZD0530)对失活Src(在酪氨酸527而非酪氨酸416处磷酸化)的结合亲和力使用BIAcore抑制溶液测定法进行测量(Karlsson等人,2000)。该测定遵循AZD0530和固定化脲喹唑啉(Sullivan等人,2005)之间的竞争结合,以结合Src。使用GraFit第5版 通过未加权非线性回归进行数据分析,并使用F检验(Mannervik,1982)确定最合适的方程。 |
||
| 细胞实验 |
细胞系[1]
所使用的细胞系是小鼠NIH 3T3成纤维细胞,其经改造以过表达在c末端结构域(Y530F)的负调控酪氨酸位点发生点突变的组成型活性形式的人Src(Src3T3)(Pléet al.,2004)和含有内源性Src的人癌症细胞系(表2)。Src3T3成纤维细胞在软琼脂中形成集落,并在免疫功能低下的无胸腺大鼠和小鼠体内皮下生长,而野生型亲本3T3细胞则没有。Src3T3细胞将在含有低至0.5%胎牛血清(FCS;用于检测条件)的培养基中生长,而野生型非Src转染的3T3细胞将不会在这些低血清条件下生长。在体外增殖试验中,使用已知通过Bcr-Abl活性驱动生长的K562人白血病细胞评估 Saracatinib (AZD0530)对Abl激酶的功能活性(Lozzio和Lozzio,1975)。NBT-II大鼠膀胱癌症细胞来源和培养如前所述(Boyer等人,2002)。 细胞增殖试验[1] 如前所述(Plé等人,2004),使用比色法5-溴脱氧尿苷(BrdU)细胞增殖ELISA试剂盒 评估细胞增殖。简而言之,将细胞铺在96孔板上(1.5×104个细胞/孔),第二天加入0.039-20μM的 Saracatinib (AZD0530)二甲基亚砜溶液(终浓度为0.5%),并孵育细胞24小时。用BrdU脉冲标记细胞2小时并固定。然后用提供的溶液使细胞DNA变性,并用抗BrdU过氧化物酶孵育90分钟。用磷酸盐缓冲盐水洗涤三次后,加入四甲基联苯胺底物溶液,在摇床上孵育平板10-30分钟,直至690nm处的阳性对照吸光度约为1.5吸光度单位。 EGFR磷酸化测定[1] KB(鼻咽癌)细胞以5000个细胞/孔的速度接种在96孔板中,在含有10%FCS的Rosewell Park纪念研究所(RPMI)1640培养基中培养72小时,然后与无血清RPMI 1640孵育24小时。用浓度为0至10μM的化合物处理细胞90分钟。在裂解之前,细胞与15ng/mL EGF配体(将受体磷酸化增加到最大值的90%所需的浓度)一起孵育5分钟。使用人磷酸化EGFR Duoset ELISA试剂盒测量磷酸化EGFR水平。 微滴迁移(趋化运动)测定[1] 微滴迁移测定评估测试化合物抑制人上皮A549肺癌细胞随机运动(趋化运动)的能力,这些细胞在Dulbecco改良的Eagle培养基(DMEM)+10%FCS中常规培养。该测定方法已在之前完整描述(Plé等人,2004)。简而言之,将A549细胞(2×107/mL)悬浮在含有0.3%琼脂糖的温热DMEM(37°C)中。将悬浮液移入96孔板(2μL/孔)中,在冰上短暂冷却,使琼脂糖微滴凝胶。设置后,向每个孔中加入90μL冷冻RPMI 1640培养基,然后加入10μL Saracatinib (AZD0530)(0.02-5μM)。将平板在37°C下孵育72小时,以使其发生迁移。通过从琼脂滴周围到运动细胞的迁移前沿进行几次等距测量来测量细胞迁移。图1A显示了微滴迁移测定的图示,说明了如何测量细胞迁移。 单层划痕试验[1] 人MDA-MB-231乳腺癌症细胞和T24、SCaBER和1A6膀胱癌症细胞在适合的六孔组织培养板中作为单层生长。用无菌移液管尖端轻轻刮擦融合的单层,形成划痕,并在培养基(无酚红DMEM,补充10%木炭/葡聚糖处理的FCS和1%l-谷氨酰胺)中向孔中加入萨拉卡替尼(AZD0530)(0.01-0.5μM)。通过18小时的延时摄影记录了细胞运动回到划痕区域。 NBT-II细胞粘附和迁移试验[1] 如前所述,通过视频显微镜评估了 Saracatinib (AZD0530)对EGF和胶原蛋白诱导的NBT-II细胞运动的影响(Valles等人,2004)。如前所述,AZD0530对EGF诱导的细胞分散的影响是通过使用抗桥粒蛋白抗体的免疫荧光来评估的,以监测EGF诱导的桥粒从细胞外周的损失(Boyer等人,1997)。 paxillin磷酸化评估[1] 在NBT‐II细胞中评估了 Saracatinib (AZD0530)对paxillin磷酸化的影响,该细胞在添加了越来越多的 Saracatinib (AZD0530)的情况下,用100ng/mL EGF刺激15分钟。通过免疫印迹法,使用针对磷酸Y118-帕西林和总帕西林的多克隆抗体,揭示了帕西林酪氨酸磷酸化。 三维侵袭试验[1] 通过用1/10体积的10×DMEM浓缩液中和I型胶原 溶液,用蒸馏水稀释至最终浓度为1×,并向其中加入1/11体积的0.1N NaOH,制备了纤维蛋白I型胶原凝胶(终浓度为1mg/mL)。在细胞接种前,将纤维蛋白胶原凝胶(80μL)置于24孔transwell插入物的上腔中,8μm孔径的聚碳酸酯过滤器 上方,温度为37°C,持续18小时。将人HT1080纤维肉瘤细胞(ATCC CCL 121;DMEM,补充0.2%FCS和2mM l谷氨酰胺)接种在上透孔室的胶原凝胶上(每个透孔1×104个细胞)。将补充了10%FCS和2mM l‐谷氨酰胺(总体积750μl)的DMEM放入下腔室,以提供趋化梯度Saracatinib(AZD0530)(0.1、1和10μM)或载体(0.1%DMSO)在接种前加入细胞,也加入下腔室内的培养基。Transwell在37°C下孵育72小时,然后与10μM Hoechst 33342在无血清DMEM中孵育30分钟。通过共聚焦显微镜分析,使用尼康Eclipse倒置显微镜上的Bio-Rad Radiance 2000多光子共聚焦照明单元对入侵细胞进行可视化。如前所述,通过修改方案对细胞侵袭进行定量(Carragher等人,2006)。简而言之,使用20倍物镜,从胶原凝胶表面以20μm的间隔扫描光学切片。Image‐Pro分析软件用于识别阳性像素的数量(赫斯特染色超过阈值),并在每个光学切片上分割成单个细胞核。胶原凝胶顶部下方60至200μm的光学切片中存在的阳性核的累积总和表示为胶原凝胶顶部和内部阳性核总数的百分比。因此,该值表示每个样本中侵入深度超过60μm至200μm的总细胞比例。 |
||
| 动物实验 |
|
||
| 药代性质 (ADME/PK) |
Saracatinib reduces MD-MSC viability and has good nerve penetration [2]
A pharmacokinetic study of saracatinib (25 mg/kg oral dose) in NSG mice revealed that plasma and nerve concentrations of saracatinib peaked at 0.5 hours with a t1/2 of 4.4 hours, but remained constant in the nerve at approximately 300–400 ng/g for at least 8 hours, the longest time point measured (Fig. 3D). Saracatinib selectively reduced MD-MSC viability (IG50 = 0.3 μmol/L) but had a low maximum effect of approximately 40%–50%, compared with an 80% maximum effect for dasatinib (Fig. 3E). Saracatinib decreased the levels of Src(Y416) phosphorylation compared with total Src levels, and also decreased Src-dependent phosphorylation of FAK(Y576), and Src/FAK-dependent phosphorylation of paxillin(Y118) at 6 hours of treatment (Fig. 3F). After 24 hours of saracatinib treatment, MD-MSCs had increased p27 levels compared with controls (Fig. 3G). Pharmacokinetics [1] The AZD0530 plasma concentration 6h after oral dosing increased proportionally to the dose (Figure 4A). |
||
| 参考文献 |
|
||
| 其他信息 |
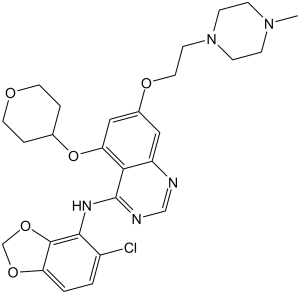
Saracatinib is a member of the class of quinazolines that is quinazoline substituted by (5-chloro-2H-1,3-benzodioxol-4-yl)amino, (oxan-4-yl)oxy and 2-(4-methylpiperazin-1-yl)ethoxy groups at positions 4, 5 and 7, respectively. It is a dual inhibitor of the tyrosine kinases c-Src and Abl (IC50 = 2.7 and 30 nM, respectively). Saracatinib was originally developed by AstraZeneca for the treatment of cancer but in 2019 it was granted orphan drug designation by the US Food and Drug Administration for the treatment of idiopathic pulmonary fibrosis (IPF), a type of lung disease that results in scarring (fibrosis) of the lungs. It has a role as an antineoplastic agent, an EC 2.7.10.2 (non-specific protein-tyrosine kinase) inhibitor, a radiosensitizing agent, an autophagy inducer, an apoptosis inducer and an anticoronaviral agent. It is a member of quinazolines, a secondary amino compound, a N-methylpiperazine, an aromatic ether, a member of oxanes, a member of benzodioxoles, an organochlorine compound and a diether.
Saracatinib has been investigated for the treatment of Cancer, Osteosarcoma, Ovarian Cancer, Fallopian Tube Cancer, and Primary Peritoneal Cancer. Saracatinib is an orally available 5-, 7-substituted anilinoquinazoline with anti-invasive and anti-tumor activities. Saracatinib is a dual-specific inhibitor of Src and Abl, protein tyrosine kinases that are overexpressed in chronic myeloid leukemia cells. This agent binds to and inhibits these tyrosine kinases and affects cell motility, cell migration, adhesion, invasion, proliferation, differentiation, and survival. Specifically, Saracatinib inhibits Src kinase-mediated osteoclast bone resorption. AZD0530, an orally available Src inhibitor, demonstrated potent antimigratory and anti-invasive effects in vitro, and inhibited metastasis in a murine model of bladder cancer. Antiproliferative activity of AZD0530 in vitro varied between cell lines (IC(50) 0.2 ->10μM). AZD0530 inhibited tumor growth in 4/10 xenograft models tested and dynamically inhibited in vivo phosphorylation of Src substrates paxillin and FAK in both growth-inhibition-resistant and -sensitive xenografts. The activity of AZD0530 in NBT-II bladder cancer cells in vitro was consistent with inhibition of cell migration and stabilization of cell-cell adhesion. These data suggest a dominant anti-invasive pharmacology for AZD0530 that may limit tumor progression in a range of cancers. AZD0530 is currently in Phase II clinical trials.[1] The data presented here support a mechanistic role of endogenous Src in promoting an invasive cell phenotype through the regulation of cell adhesion, migration, and invasion. AZD0530 inhibited cancer cell proliferation in vitro and in vivo in a constitutively active Src fibroblast tumor model, and in some human tumor cell lines. The lack of consistent antiproliferative activity and the underlying mechanism of such diverse responses require further investigation in additional tumor models. Effects on models of invasion were more clear cut: AZD0530 inhibited invasion and migration of cancer cells in vitro, and inhibited phosphorylation of proteins controlling migration in vitro and in vivo. In an in vivo model of bladder cancer metastasis, AZD0530 inhibited the number of lymph node metastases, detected through colony forming assays, thus recapitulating the effects seen with dominant‐negative Src and Csk constructs in earlier studies in this model (Boyer et al., 2002). We and others have recently demonstrated activity of AZD0530 in inhibiting metastasis in pancreatic cancer models (Green et al., 2005) and in an orthotopic model of human colorectal carcinoma (Phillips et al., 2007). Together with the results presented here, these data suggest that AZD0530 may provide clinical benefit by preventing or delaying tumor progression through inhibition of tumor cell migration and invasion. AZD0530 is currently in Phase II clinical trials.[1] Neurofibromatosis type 2 (NF2) is a nervous system tumor disorder caused by inactivation of the merlin tumor suppressor encoded by the NF2 gene. Bilateral vestibular schwannomas are a diagnostic hallmark of NF2. Mainstream treatment options for NF2-associated tumors have been limited to surgery and radiotherapy; however, off-label uses of targeted molecular therapies are becoming increasingly common. Here, we investigated drugs targeting two kinases activated in NF2-associated schwannomas, c-Met and Src. We demonstrated that merlin-deficient mouse Schwann cells (MD-MSC) treated with the c-Met inhibitor, cabozantinib, or the Src kinase inhibitors, dasatinib and saracatinib, underwent a G1 cell-cycle arrest. However, when MD-MSCs were treated with a combination of cabozantinib and saracatinib, they exhibited caspase-dependent apoptosis. The combination therapy also significantly reduced growth of MD-MSCs in an orthotopic allograft mouse model by greater than 80% of vehicle. Moreover, human vestibular schwannoma cells with NF2 mutations had a 40% decrease in cell viability when treated with cabozantinib and saracatinib together compared with the vehicle control. This study demonstrates that simultaneous inhibition of c-Met and Src signaling in MD-MSCs triggers apoptosis and reveals vulnerable pathways that could be exploited to develop NF2 therapies. [2] This study demonstrates that simultaneous c-Met and Src inhibition induced apoptosis of merlin-deficient mouse Schwann cells in culture and in allografts, and reduced growth of primary VS cells with NF2 mutations. The drug combination also decreased the viability of two merlin-deficient human SC lines and a human benign meningioma line in vitro (Supplementary Fig. S4), confirming that the effects are not cell-line or species-dependent. Both ERK and Src-FAK kinases converge onto the PI3K/Akt pathway; inhibitors of which induce apoptosis in NF2-associated cells. Considering the severe toxicity associated with direct targeting of PI3K with Idelalisib, and until additional PI3K inhibitors are approved, simultaneous inhibition of c-Met-ERK and Src-FAK pathways with cabozantinib and dasatinib/saracatinib may promote schwannoma cell apoptosis with fewer adverse effects. This study provides preclinical data supporting further investigation of dual inhibition of c-Met and Src as a potential therapy for NF2-associated schwannomas.[2] |
| 分子式 |
C27H32CLN5O5
|
|---|---|
| 分子量 |
542.0265
|
| 精确质量 |
541.209
|
| 元素分析 |
C, 59.83; H, 5.95; Cl, 6.54; N, 12.92; O, 14.76
|
| CAS号 |
379231-04-6
|
| 相关CAS号 |
Saracatinib difumarate;893428-72-3
|
| PubChem CID |
10302451
|
| 外观&性状 |
White to light yellow solid powder
|
| 密度 |
1.3±0.1 g/cm3
|
| 沸点 |
671.3±55.0 °C at 760 mmHg
|
| 闪点 |
359.8±31.5 °C
|
| 蒸汽压 |
0.0±2.1 mmHg at 25°C
|
| 折射率 |
1.641
|
| LogP |
2.74
|
| tPSA |
90.44
|
| 氢键供体(HBD)数目 |
1
|
| 氢键受体(HBA)数目 |
10
|
| 可旋转键数目(RBC) |
8
|
| 重原子数目 |
38
|
| 分子复杂度/Complexity |
743
|
| 定义原子立体中心数目 |
0
|
| SMILES |
ClC1C([H])=C([H])C2=C(C=1N([H])C1C3=C(C([H])=C(C([H])=C3OC3([H])C([H])([H])C([H])([H])OC([H])([H])C3([H])[H])OC([H])([H])C([H])([H])N3C([H])([H])C([H])([H])N(C([H])([H])[H])C([H])([H])C3([H])[H])N=C([H])N=1)OC([H])([H])O2
|
| InChi Key |
OUKYUETWWIPKQR-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C27H32ClN5O5/c1-32-6-8-33(9-7-32)10-13-35-19-14-21-24(23(15-19)38-18-4-11-34-12-5-18)27(30-16-29-21)31-25-20(28)2-3-22-26(25)37-17-36-22/h2-3,14-16,18H,4-13,17H2,1H3,(H,29,30,31)
|
| 化学名 |
N-(5-Chloro-1,3-benzodioxol-4-yl)-7-[2-(4-methyl-1-piperazinyl)ethoxy]-5-[(tetrahydro-2H-pyran-4-yl)oxy]-4-quinazolinamine
|
| 别名 |
AZD0530; Saracatinib; AZD-0530; Saracatinib; 379231-04-6; AZD0530; Saracatinib (AZD0530); N-(5-Chloro-1,3-benzodioxol-4-yl)-7-[2-(4-methyl-1-piperazinyl)ethoxy]-5-[(tetrahydro-2H-pyran-4-yl)oxy]-4-quinazolinamine; Saracatinib [USAN]; AZD 0530
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (4.61 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (4.61 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.5 mg/mL (4.61 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 配方 4 中的溶解度: 2% DMSO+30% PEG 300+ddH2O: 5 mg/mL 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.8449 mL | 9.2246 mL | 18.4492 mL | |
| 5 mM | 0.3690 mL | 1.8449 mL | 3.6898 mL | |
| 10 mM | 0.1845 mL | 0.9225 mL | 1.8449 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
| NCT Number | Recruitment | interventions | Conditions | Sponsor/Collaborators | Start Date | Phases |
| NCT04307953 | Recruiting | Drug: AZD0530 Difumarate Drug: Matching placebo |
Fibrodysplasia Ossificans Progressiva | Amsterdam UMC, location VUmc | August 5, 2020 | Phase 2 |
| NCT02116712 | Completed | Drug: Saracatinib | Pulmonary Lymphangioleiomyomatosis | Tony Eissa | August 2014 | Phase 1 |
| NCT02732587 | Completed Has Results | Drug: Saracatinib | Alcohol Drinking | Yale University | November 2015 | Phase 1 |
| NCT02737202 | Terminated | Drug: saracatinib | Pulmonary Lymphangioleiomyomatosis | Baylor College of Medicine | April 2016 | Phase 2 |
|
 |
 |
AZD0530 inhibits cell proliferation through β-catenin, ERK1/2 and GSK3β-mediated cyclin D1 and c-myc regulation.Oncogene.2008 Oct 23;27(49):6365-75. |
AZD0530 inhibits Src activation through inhibition of Y419 phosphorylation.Oncogene.2008 Oct 23;27(49):6365-75. |
AZD0530 inhibits cell migration through Src-mediated FAK activation.Oncogene.2008 Oct 23;27(49):6365-75. |