| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| Other Sizes |
|
| 靶点 |
RORα (Ki = 172); RORγ (Ki = 111)
|
|---|---|
| 体外研究 (In Vitro) |
SR1001通过减少IL-17A基因的表达和IL-17A蛋白的合成来阻止TH17细胞的增殖。 SR1001 以剂量依赖性方式减弱共激活剂 TRAP220 NR box 2 肽对 RORγ 的反应(IC50 值 ≈ 117 nM)。此外,当添加到分泌物或人 TH17 细胞中时,SR1001 会抑制细胞因子的表达 [1]。
SR1001是一种高亲和力的合成配体,是一类新型化合物中的第一种,对RORα和RORγt都有特异性,并抑制t(H)17细胞的分化和功能。SR1001特异性结合RORα和RORγt的配体结合结构域,诱导配体结合结构体内的构象变化,包括螺旋12的重新定位,导致对共激活剂的亲和力降低,对共阻遏物的亲和力增加,从而抑制受体的转录活性。SR1001抑制了小鼠T(H)17细胞的发育,这可以通过抑制白细胞介素-17A基因表达和蛋白质产生来证明。此外,当添加到分化的小鼠或人T(H)17细胞中时,SR1001抑制了细胞因子的表达。[1] 使用T1317支架作为先导化合物,我们开发了一种衍生物SR1001(图1a和补充图1),它没有所有LXR活性,但保留了抑制RORα和RORγ活性的能力。我们发现SR1001以剂量依赖的方式抑制GAL4-RORα和GAL4-RORγ的转录活性(图1b),但对LXRα活性没有影响(图1b)。我们在基于细胞的共转染试验中评估了SR1001在所有48个人核受体中的特异性,没有观察到除RORα或RORγ以外的受体的活性(数据未显示)。我们使用竞争性放射性配体结合试验检测了SR1001与RORα和RORγ的直接结合。SR1001剂量依赖性地取代[3H]25-羟基胆固醇与RORα和RORγ的结合(Ki=172和111 nM)(图1c),但未显示与RORβ的结合(数据未显示)。[1] 我们研究了SR1001是否会影响Il17启动子驱动的萤光素酶报告子的RORα和RORγ依赖性调控。HEK293细胞用Il17报告基因和全长RORα或RORγ转染,并用SR1001或载体处理。如图1d所示,SR1001剂量依赖性地抑制了每种受体驱动的Il17启动子活性。由于SR1001与RORα和RORγ结合,导致每种受体的转录活性受到抑制,我们预计SR1001会抑制辅激活子与受体的结合。SR1001以剂量依赖的方式减少了辅活化剂TRAP220 NR box 2肽与RORγ的相互作用(图1e)(IC50值~117 nM)。总的来说,这些数据表明SR1001是RORα/RORγ的反向激动剂配体。[1] 接下来,我们确定了SR1001是否影响内源性Il17a基因的表达。EL4小鼠肿瘤细胞系组成性表达RORα(Rora)、RORγt(Rorc)和IL-17A(Il17a)。EL4细胞用对照siRNA或RORα/γsiRNA混合物处理,然后用载体或SR1001处理。通过定量PCR测量,RORα和RORγt表达的减少显著降低了IL-17A mRNA的表达(图2a)。更重要的是,用SR1001处理的细胞抑制了Il17a mRNA的表达,而用RORα/γ耗竭的细胞处理的反应明显减弱,表明SR1001对Il17a mRNA表达的抑制是RORα/RORγ依赖性的(图2a)。此外,SR1001抑制了人肝细胞癌细胞系HepG2细胞中RORα和RORγ靶基因G6Pase的表达,进一步证明SR1001的作用是由RORα、RORγ介导的。[1] 我们假设,当这些受体占据Il17启动子时,SR1001会抑制辅激活子SRC2与RORα或RORγ的结合。我们进行了连续染色质免疫沉淀分析(ChIP-reChIP),评估了EL4细胞中与驻留在Il17启动子上的RORα或RORγ相关的SRC2的相对量。SR1001抑制了SRC2在Il17启动子处与RORα和RORγ结合的能力,并增加了核心加压子NCoR的募集(图2b,泳道3和4,图2c,泳道3与4)。因此,SR1001通过直接抑制辅激活子结合和促进辅抑制子对RORα和RORγ的募集来抑制Il17a的表达。[1] 为了了解配体如何介导RORγ的转录激活,我们在存在和不存在SR1001的情况下对RORγLBD进行了全面的差示氢氘交换质谱(HDX)分析。这种方法提供了受体构象系综中局部配体诱导的扰动的测量。测量了源自RORγLBD的消化肽的HDX动力学,并在补充图3中显示了apo RORγLB和SR1001结合的RORγLBS之间掺入氘百分比的平均差异。与apo相比,负值表示与配体结合时LBD该区域的交换保护增加(更稳定,更不动态),而正值表示交换保护减少(不稳定,更动态)。HDX动力学对氢键网络很敏感,配体结合时这些网络中的扰动可以使用微分HDX来确定。SR1001结合RORγ诱导的差异HDX与RORγ与甾醇配体25-羟基胆固醇25-OHC(PDB:3LOL)复合的共晶结构相关(补充图4)。在RORγ/25-OHC结构中,C25羟基尾部朝向螺旋11(H11),A环朝向H1/H2。从PDB:3LOL可以推断,25-OHC C1位的羟基与Qln-286(H1)氢键结合,25-羟基与His-479(H11)氢键结合。RORγLBD内结合SR1001后对交换的保护作用增强的区域包括H1和H11的部分。为了强调这一点,补充图3中的HDX数据通过叠加到PDB上以图形方式表示:SR1001对接的3LOL(图2d)。与差异HDX数据一致,SR1001与PDB的对接:3LOL表明SR1001与RORγ的结合模式相似(补充图4)。[1] 为了研究SR1001在调节SRC2和RORγ之间相互作用中的作用,我们在SRC2受体相互作用结构域(RID)存在和不存在的情况下对RORγLBD进行了差异HDX(图2d和补充图3),其中包含三个NR盒(~18kDa)。在SRC2-RID存在的情况下,LBD的几个区域表现出HDX动力学降低,表明两种蛋白质之间存在相互作用。一个稳定的区域是H12,它含有受体的AF2结构域,这已被证明对NR与辅激活子的相互作用很重要。此外,在SR1001存在和不存在的情况下,RORγ:SRC2复合物的差异HDX分析清楚地表明,配体破坏了受体与SRC2 RID的相互作用(图2d)。这些数据为SR1001等反向激动剂如何抑制RORγ靶基因的转录输出提供了强有力的机制见解。[1] 由于RORα和RORγt活性是TH17细胞最佳发育所必需的,我们探讨了SR1001是否会抑制TH17细胞分化。脾细胞在TH17极化条件下(TGF-β和IL-6)与SR1001或载体对照一起培养5天。TGF-β和IL-6的组合增加了载体处理细胞中Il17a、Il17f、Il21和Il22的mRNA表达,而SR1001处理的细胞未能显著上调这些细胞因子(图3)。碘化丙啶染色表明SR1001无毒,不会诱导细胞死亡(补充图5)。TH17细胞和诱导型T调节细胞(iTreg)都依赖于TGFβ进行分化。我们评估了Treg特异性转录因子Foxp3的表达是否受到SR1001治疗的影响。与载体对照相似,Foxp3 mRNA表达不受SR1001处理的影响,这表明SR1001对TH17细胞分化的抑制不会使细胞进入iTreg表型(补充图6)。此外,如Tbx21(T-bet)和Gata3 mRNA表达的分别降低所示,SR1001处理对TH17细胞发育的抑制不会将脾细胞培养物驱入任何其他T辅助细胞系TH1或TH2。[1] 最后,我们探讨了SR1001是否会抑制IL-17蛋白的产生和分泌。在TH17极化条件下培养脾细胞,并通过细胞内流式细胞术分析IL-17的表达。SR1001治疗在第4、5和6天抑制了CD4+T细胞中IL-17的表达(图4a)。与脾细胞培养类似,细胞内流式细胞术表明,SR1001显著抑制了纯化的分化小鼠CD4+T细胞(CD4+CD25-CD62HiCD44lo)中IL-17的表达(图4b)。接下来,我们通过ELISA评估了SR1001对脾细胞培养物分泌IL-17的影响。当SR1001在TH17细胞分化开始时(起始)或分化开始后48小时加入时(后),SR1001治疗在三天内抑制了IL-17的分泌(图4c)。SR1001也能有效抑制人外周血单核细胞(hPBMCs)中细胞内IL-17的表达(图4d)。最后,我们研究了SR1001对其他T辅助细胞谱系的影响。TH1、TH2和iTreg细胞的分化不受SR1001治疗的影响,因为与载体对照组相比,IFNγ、IL-4或Foxp3的表达量相似,表明SR1001特异性靶向TH17细胞(补充图7)[1]。 |
| 体内研究 (In Vivo) |
在大鼠模型中,SR1001 成功地从基因角度诱发了自身免疫的临床严重程度。 Cyp7b1、Rev-erbα 和丝氨酸 1 是肝脏 ROR 靶标,当 SR1001 应用于 C57BL/6 小鼠时,其表达会受到抑制 [1]。内部柠檬酸合酶 mRNA 表达模式被 SR1001a RORα 反调节器消除 [2]。
鉴于RORα和RORγt是TH17介导的自身免疫性疾病发展所必需的,并且SR1001抑制这两种受体的活性,导致TH17细胞在体外发育受到抑制,我们在多发性硬化症动物模型、实验性自身免疫性脑脊髓炎(EAE)(一种特征明显的TS17细胞介导的自体免疫性疾病模型)中评估了SR1001治疗的效果。在第0天进行髓鞘少突胶质细胞糖蛋白(MOG35-55)免疫接种后,在研究期间,小鼠每天腹腔注射25mg kg-1的SR1001。如图4e所示,SR1001治疗延迟了EAE的发作和临床严重程度。对免疫后第18天收获的小鼠脊髓的进一步分析表明,SR1001将Il17a mRNA表达抑制了约60%,并降低了Il21和Il22 mRNA表达(图4f)。脾细胞的细胞内细胞因子分析表明,IL-17表达显著降低,CD4+T细胞总数减少,对CD8+T细胞没有影响。脾脏和脊髓中IL-4和IFNγ的mRNA表达不受影响(补充图8)。这些数据与我们的解释一致,即SR1001通过在体内影响TH17细胞功能来抑制EAE。SR1001的进一步优化可以产生具有更高活性的化合物。 虽然RORα和RORγt的表达和活性对TH17细胞的完全发育至关重要,但值得注意的是,RORα与RORγ在免疫系统之外也有作用,是肝脏代谢的关键调节因子。对C57BL/6小鼠施用SR1001抑制了肝脏ROR靶基因Cyp7b1、Rev-erbα和Serpine 1(Pai-1)的表达,表明这类化合物可能具有代谢作用;然而,我们注意到用SR1001治疗的动物没有明显的毒性[1]。 |
| 酶活实验 |
放射性配体结合分析。[1]
如前所述进行放射性配体结合分析。对于竞争试验,在3 nM[3H]-25羟基胆固醇的存在下,将不同浓度的SR1001与受体一起孵育。使用GraphPad Prism软件分析结果,并使用Cheng-Prusoff方程确定Ki。 阿尔法屏幕。[1] ALPHA筛选试验如前所述进行。在室温下,在绿光条件下(<100勒克斯),在白色不透明384孔板上进行三次检测。最终测定体积为20μL。所有稀释液均在测定缓冲液(100 mM NaCl,25 mM Hepes,0.1%BSA,pH 7.4)中制备。DMSO的最终浓度为0.25%。12μL GST-RORγ-LBD(10 nM)、珠子(每个供体和受体12.5μg ml-1)和4μL浓度递增(210 nM-50M) 将化合物SR1001加入孔中,密封平板并孵育1小时。在此预孵育步骤后,加入4μL生物素TRAP220-2肽(50 nM),密封平板并进一步孵育2小时。在PerkinElmer Envision 2104上读取平板,并使用GraphPad Prism软件分析数据。 氢/氘交换质谱。[1] 使用与Orbitrap质谱仪连接的LEAP Technologies Twin HTS PAL液体处理机器人进行了微分溶液相HDX实验。通过在25℃下将4μL 10μM蛋白复合物(有或没有SR1001和SRC2 RID)与20μL D2O蛋白缓冲液孵育预定时间(1s、30s、60s、900s和3600s)来启动每个交换反应。通过在1℃下与50L 3M尿素、0.1%TFA混合来淬灭交换反应。将混合物以50μl min-1的速度通过内部包装的胃蛋白酶柱(2mm×2cm),将消化的肽捕获到2mm×1cm的C8捕集柱上并脱盐(消化和脱盐的总时间为2.5分钟)。然后在2.1mm×5cm C18柱(1.9μHypersil Gold)上分离肽,线性梯度为4%-40%CH3CN,0.3%甲酸,持续5分钟。在2℃的热室中进行蛋白质消化和肽分离,以减少D/H反向交换。在225ºC的毛细管温度下进行质谱分析,在m/z 400下以65000的测量分辨率获取数据。每个交换时间点进行三次重复。 |
| 细胞实验 |
RNA介导的干扰。[1]
首先使用GenePulserXcell电穿孔器用100nM总siRNA电穿孔EL4细胞,使用针对小鼠ROR和ROR的siRNA,然后根据Dharma FECT 1转染试剂的说明使用50nM siRNA反向电穿孔,并接种到12孔板上。转染后24小时,用载体(DMSO)或SR1001(10μM)处理细胞24小时。收获细胞并分离总RNA。定量逆转录酶PCR用于分析小鼠RORα的mRNA水平,RORt、Gapdh和Il17a采用SYBR绿色技术。小鼠RORα的引物序列,RORt、Il17a和Gapdh,之前已经描述过5,6,7。HepG2细胞的处理方式与EL4细胞相似,但有以下例外:根据DharmaFECT 1转染试剂的说明,用针对人RORα和ROR的siRNA以50nM转染HepG2细胞。进行定量逆转录酶PCR以分析人RORRORA᠄的mRNA水平,RORRORC᠄,使用SYBR绿色技术制备CYPHILIN和G6Pase。引物序列之前已经描述过。 ChIP/ReChIP。[1] EL4细胞用平板结合的抗CD3(5μg ml-1)和可溶性抗CD28(1μg ml-1)处理24小时,然后用载体(DMSO)或SR1001(10μM)处理另外24小时。所有样本均使用抗ROR或抗ROR抗体进行第一次免疫沉淀。第二次免疫沉淀是通过使用RORα的抗兔IgG进行的,ROR的抗仓鼠IgG,抗RNA Pol II、抗SRC2或抗NCoR(圣克鲁斯)。之前已经描述了PCR中使用的IL-17引物。 |
| 动物实验 |
Mice.[1]
C57BL/6J mice were used for all in vitro experiments unless otherwise noted. EAE was induced in 8 week-old male wild-type C57BL/6J mice. Male DIO mice, 22 weeks of age, were purchased from Jackson Laboratories and fed a high fat diet (HFD) (60%kCal % fat) for the duration of the study. Induction and clinical evaluation of EAE. [1] EAE was induced in C57BL/6 wild-type mice by s.c. injection over four sites in the flank with 200 µg per mouse MOG35–55 peptide in an emulsion with IFA supplemented with 2.25 mg ml -1 Mycobacterium tuberculosis, strain H37Ra. Pertussis toxin dissolved in PBS was injected i.p. at 200 ng pre mouse at the time of immunization (Day 0) and 48 h later. Mice were scored daily on a scale of 0–6, as described previously: 0, no clinical disease; 1, limp/flaccid tail; 2, moderate hind-limb weakness; 3, severe hind-limb weakness; 4, complete hind-limb paralysis; 5, quadriplegia or pre-moribund state; 6, death. All mice were 7–10 weeks of age when experiments were performed. The SR1001 was dissolved in DMSO at 25 mg ml -1 and the mice were treated (i.p.) with 25 mg kg -1 SR1001 (1 µl g -1 body weight of mouse) or vehicle (DMSO, 1 µl g -1 body weight of mouse) twice per day. The treatment was started 2 days before immunization and continued until the end of experiment. Where indicated in the figure legends, mice were anesthetized with halothane and transcardially perfused with PBS, and spinal cords were removed for RNA and protein isolation Mouse Experiments [2] The livers from staggerer mice, a naturally occurring RORα mutant were purchased from Jackson laboratories. Liver was homogenized on ice. mRNA was prepared by the Trizol method. For the qPCR, cyclophilin B was the control gene. qPCR was performed using the following primers: mCycB_F: 5′-GCAAGTTCCATCGTGTCATCAAG-3′, mCycB_R: 5′-CCATAGATGCTCTTTCCTCCTG-3′, mCS_F: 5′-GGACAATTTTCCAACCAATCTGC-3′, and mCS_R: 5′-TCGGTTCATTCCCTCTGCATA-3′. For CS assays liver was homogenized on ice using CelLytic MT buffer with added protease inhibitor (1∶100 concentration). Protein quantity was determined using a Bradford assay. The assay contained 4 µg protein per well (12 µg total in the master mix, which was aliquoted into 3 wells). Enzymatic activity was determined using the CS assay kit, as described above. For circadian gene expression experiments male C57BL6 mice (8–10 weeks of age) were either maintained on a L:D (12h∶12h) cycle or on constant darkness (1 day). At circadian time (CT) 0 animals were administered a single dose of 25 mg/kg SR1001 (i.p.) and groups of animals (n = 6) were sacrificed at CT0, CT6, CT12 and CT18. Gene expression was determined by real time QPCR. Gene expression was normalized to Cyclophin b in all experiments. |
| 参考文献 | |
| 其他信息 |
SR 1001 is a sulfonamide.
T-helper cells that produce interleukin-17 (T(H)17 cells) are a recently identified CD4(+) T-cell subset with characterized pathological roles in autoimmune diseases. The nuclear receptors retinoic-acid-receptor-related orphan receptors α and γt (RORα and RORγt, respectively) have indispensible roles in the development of this cell type. Here we present SR1001, a high-affinity synthetic ligand-the first in a new class of compound-that is specific to both RORα and RORγt and which inhibits T(H)17 cell differentiation and function. SR1001 binds specifically to the ligand-binding domains of RORα and RORγt, inducing a conformational change within the ligand-binding domain that encompasses the repositioning of helix 12 and leads to diminished affinity for co-activators and increased affinity for co-repressors, resulting in suppression of the receptors' transcriptional activity. SR1001 inhibited the development of murine T(H)17 cells, as demonstrated by inhibition of interleukin-17A gene expression and protein production. Furthermore, SR1001 inhibited the expression of cytokines when added to differentiated murine or human T(H)17 cells. Finally, SR1001 effectively suppressed the clinical severity of autoimmune disease in mice. Our data demonstrate the feasibility of targeting the orphan receptors RORα and RORγt to inhibit specifically T(H)17 cell differentiation and function, and indicate that this novel class of compound has potential utility in the treatment of autoimmune diseases.[1] In summary, we describe a novel, first-in-class, highly selective drug targeting the orphan NRs RORα and RORγ that effectively suppresses TH17 cell differentiation and cytokine expression and reduces the severity of disease in an animal model of multiple sclerosis. Our data indicates that the targeting of TH17 cells, by blocking RORα/γ function with a synthetic ligand, is a tractable approach for potential therapeutic intervention. Current treatments for TH17-mediated autoimmune diseases, including multiple sclerosis, utilize agents that are general immunosuppressant’s and thus the side effect profile is significant. Clearly, our data demonstrates that by targeting RORα and RORγ one can specifically inhibit TH17 cells without affecting other T helper cell lineages thereby providing a more focused therapy that will not be a general immunosuppressant. Therefore, SR1001 and derivatives of this compound may represent a novel class of superior drugs to not only treat TH17-mediated autoimmune disorders, but ROR-mediated metabolic disorders as well.[1] The retinoic acid receptor-related orphan receptor α (RORα) is a member of the nuclear receptor superfamily of transcription factors that plays an important role in regulation of the circadian rhythm and metabolism. Mice lacking a functional RORα display a range of metabolic abnormalities including decreased serum cholesterol and plasma triglycerides. Citrate synthase (CS) is a key enzyme of the citric acid cycle that provides energy for cellular function. Additionally, CS plays a critical role in providing citrate derived acetyl-CoA for lipogenesis and cholesterologenesis. Here, we identified a functional RORα response element (RORE) in the promoter of the CS gene. ChIP analysis demonstrates RORα occupancy of the CS promoter and a putative RORE binds to RORα effectively in an electrophoretic mobility shift assay and confers RORα responsiveness to a reporter gene in a cotransfection assay. We also observed a decrease in CS gene expression and CS enzymatic activity in the staggerer mouse, which has a mutation of in the Rora gene resulting in nonfunctional RORα protein. Furthermore, we found that SR1001 a RORα inverse agonist eliminated the circadian pattern of expression of CS mRNA in mice. These data suggest that CS is a direct RORα target gene and one mechanism by which RORα regulates lipid metabolism is via regulation of CS expression.[2] |
| 分子式 |
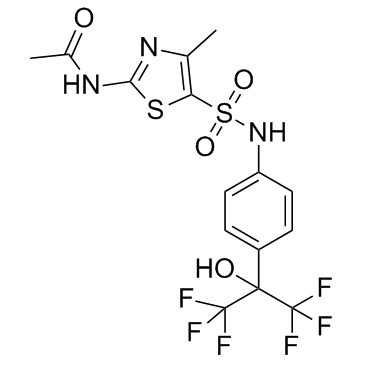
C15H13F6N3O4S2
|
|---|---|
| 分子量 |
477.401841878891
|
| 精确质量 |
477.025
|
| 元素分析 |
C, 37.74; H, 2.74; F, 23.88; N, 8.80; O, 13.41; S, 13.43
|
| CAS号 |
1335106-03-0
|
| PubChem CID |
44241473
|
| 外观&性状 |
White to yellow solid powder
|
| 密度 |
1.6±0.1 g/cm3
|
| 折射率 |
1.557
|
| LogP |
3.15
|
| tPSA |
148.5
|
| 氢键供体(HBD)数目 |
3
|
| 氢键受体(HBA)数目 |
13
|
| 可旋转键数目(RBC) |
5
|
| 重原子数目 |
30
|
| 分子复杂度/Complexity |
718
|
| 定义原子立体中心数目 |
0
|
| SMILES |
S(C1=C(C)N=C(NC(C)=O)S1)(NC1C=CC(=CC=1)C(C(F)(F)F)(C(F)(F)F)O)(=O)=O
|
| InChi Key |
OZBSSKGBKHOLGA-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C15H13F6N3O4S2/c1-7-11(29-12(22-7)23-8(2)25)30(27,28)24-10-5-3-9(4-6-10)13(26,14(16,17)18)15(19,20)21/h3-6,24,26H,1-2H3,(H,22,23,25)
|
| 化学名 |
N-[5-[[4-(1,1,1,3,3,3-hexafluoro-2-hydroxypropan-2-yl)phenyl]sulfamoyl]-4-methyl-1,3-thiazol-2-yl]acetamide
|
| 别名 |
1335106-03-0; SR1001; SR 1001; SR-1001; N-[5-[[4-(1,1,1,3,3,3-hexafluoro-2-hydroxypropan-2-yl)phenyl]sulfamoyl]-4-methyl-1,3-thiazol-2-yl]acetamide; N-(5-(N-(4-(1,1,1,3,3,3-hexafluoro-2-hydroxypropan-2-yl)phenyl)sulfamoyl)-4-methylthiazol-2-yl)acetamide; CHEMBL3094388; OZBSSKGBKHOLGA-UHFFFAOYSA-N;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : ≥ 39 mg/mL (~81.69 mM)
|
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.08 mg/mL (4.36 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 20.8 mg/mL澄清DMSO储备液加入400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: 2.08 mg/mL (4.36 mM) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 悬浊液; 超声助溶。 例如,若需制备1 mL的工作液,可将 100 μL 20.8 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.08 mg/mL (4.36 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.0947 mL | 10.4734 mL | 20.9468 mL | |
| 5 mM | 0.4189 mL | 2.0947 mL | 4.1894 mL | |
| 10 mM | 0.2095 mL | 1.0473 mL | 2.0947 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。