| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| Other Sizes |
|
| 靶点 |
p38α (IC50 = 9 nM); p38β (IC50 = 90 nM)
|
|---|---|
| 体外研究 (In Vitro) |
Talmapimod (SCIO-469) 以 100–200 nM 的浓度抑制 MM 细胞中 p38 MAPK 磷酸化一小时[1]。 Talmapimod 可减少 LPS 导致人全血中产生的 TNF-a 的量[2]。 Talmapimod 降低 5T2MM 和 5T33MM 细胞 p38alpha MAPK 的组成型磷酸化[3]。
虽然PS-341(硼替佐米)是一种有希望改善多发性骨髓瘤(MM)患者预后的药物,但65%的复发和难治性疾病患者没有反应。我们之前的研究表明,热休克蛋白(Hsp)27在PS-341处理后上调,Hsp27的过表达赋予PS-341抗性,抑制Hsp27克服PS-341抗性。由于Hsp27是p38丝裂原活化蛋白激酶(MAPK)/MAPK-丝裂原活化蛋白激酶-2 (MAPKAPK2)的下游靶点,我们假设抑制p38 MAPK活性可能通过下调Hsp27来增强PS-341的细胞毒性。虽然p38 MAPK抑制剂Talmapimod/SCIO-469 单独使用不会诱导显著的生长抑制,但它阻断了基线和ps -341触发的p38 MAPK磷酸化以及Hsp27的上调,这与增强MM.1S细胞的细胞毒性有关。重要的是,SCIO-469增强了c-Jun nh2末端激酶(JNK)的磷酸化,增强了caspase-8和聚(ADP)核糖聚合酶的裂解。此外,SCIO-469下调ps -341诱导的G2/ m期细胞中p21Cip1表达的上调。重要的是,SCIO-469治疗增强了PS-341的细胞毒性,甚至对PS-341耐药细胞系和患者MM细胞也是如此。因此,这些研究为SCIO-469的临床试验提供了框架,以增强对PS-341的敏感性并克服耐药性,从而改善MM.患者的预后 。[1] 我们之前的研究表明,p38 MAPK在MDS造血祖细胞中过度激活,这导致了目前在该疾病中选择性p38 α抑制剂Talmapimod/SCIO-469的临床研究。我们现在证明骨髓抑制细胞因子TNFalpha和il -1 β以p38 mapk依赖的方式由骨髓细胞分泌。在炎症模拟的体外骨髓微环境中,细胞因子的诱导与CD34+干细胞凋亡相关,它们的分泌受骨髓基质和单核细胞旁分泌相互作用的刺激。用SCIO-469治疗可抑制原发性MDS骨髓细胞中TNF的分泌,并保护细胞遗传学正常的祖细胞免于体外凋亡。[2] 在本研究中,我们在5T2MM和5T33MM模型中确定了p38alpha MAPK选择性抑制剂Talmapimod/SCIO-469是否抑制多发性骨髓瘤生长并预防骨病。SCIO-469降低5T2MM和5T33MM细胞的p38alpha MAPK组成磷酸化。当细胞与骨髓基质细胞一起培养时,这与DNA合成减少和诱导细胞凋亡有关。携带5T33MM细胞的C57Bl/KaLwRij小鼠与SCIO-469治疗抑制p38alpha MAPK磷酸化,并与血清副蛋白显著降低、骨髓肿瘤细胞几乎完全减少、血管生成减少和无病生存期显著增加相关。[3] |
| 体内研究 (In Vivo) |
Talmapimod (SCIO-469) 可减轻骨髓瘤的负担,同时还可预防骨髓瘤骨病的出现[2]。在 5T2MM 和 5T33MM 模型中,Talmapimod可抑制多发性骨髓瘤细胞增殖并预防骨疾病[3]。他马匹莫德(10-90 mg/kg;口服;每日两次口服,持续 14 天)可在终止时降低肿瘤重量,并以剂量依赖性方式降低肿瘤生长[4]。
为了评估体内阻断p38α MAPK通路对多发性骨髓瘤疾病发展的影响,从肿瘤细胞注射时起,用Talmapimod/SCIO-469 治疗5T33MM小鼠。对这些小鼠血清样品进行药代动力学分析,结果分别为1 μmol/L和3 μmol/L,与患者的值相似。治疗与p38α MAPK磷酸化的降低有关,在治疗动物的骨髓样本中进行了评估(图2)。这也与血清副蛋白(8.8±1.4 g/dL)下降有关(150mg /kg组降至0.04±0.03 g/dL, 450mg /kg组降至0.0±0.0 g/dL;P < 0.001),骨髓中肿瘤细胞比例降低(150 mg/kg组为67.2±8.1%至1.09±0.5%,450 mg/kg组为0.0±0.0%);P < 0.001;表1)。150 mg/kg组和450 mg/kg组微血管密度分别从25.4±1.2下降到19.2±0.7和19.2±0.5 (P < 0.001),与naïve对照组相似。这种减少可能是对血管生成的直接影响或通过减少肿瘤负担的间接影响的结果。Kaplan-Meier分析显示,用SCIO-469治疗小鼠后,无病生存期增加(对照物27.5天,SCIO-469 96天;P < 0.0001;图2)。[3] 为了研究抑制p38α MAPK通路是否也影响骨髓瘤骨病的发展,我们在5T2MM模型中进行了研究。向C57Bl/KaLwRij小鼠注射5T2MM小鼠骨髓瘤细胞后,骨髓瘤细胞在骨髓中生长,骨病发生,表现为破骨细胞表面增加(P < 0.05),松质骨减少(P < 0.01), x线上出现溶骨病变(P < 0.01);图3)。Talmapimod/SCIO-469治疗5t2mm小鼠,血清副蛋白降低40% (P < 0.1, 150 mg/kg组和450 mg/kg组)。微血管密度由对照组的25.5±0.8降至唑来onic acid组的18.8±0.7,Talmapimod/SCIO-469 150 mg/kg组的20.3±0.7,450 mg/kg组的18.7±0.5(均P < 0.001),与naïve对照组相似。150和450 mg/kg的SCIO-469治疗也能阻止骨溶解病变的发生(P < 0.01;图3)。双膦酸唑来膦酸作为阳性对照,也出现了这种情况(P < 0.01)。组织学分析显示,唑来膦酸处理显著降低5T2MM细胞覆盖骨表面的增加(P < 0.01)。这与我们之前的报告一致,在该模型中,重复给药可有效减少破骨细胞的形成和溶解性骨病变的发展。相比之下,SCIO-469对小鼠破骨细胞表面无明显影响。事实上,与唑来膦酸处理的小鼠相比,破骨细胞周长仍显着增加(P < 0.05)。对溶解性病变有很强的抑制作用,但对破骨细胞覆盖的骨表面比例没有影响,这与SCIO-469抑制破骨细胞活性和功能而不是抑制破骨细胞形成是一致的。[3] 多发性骨髓瘤(MM)是一种克隆性浆细胞恶性肿瘤,目前无法治愈。因此,迫切需要在早期和晚期MM的新的单一或联合治疗方案来对抗这种疾病。最近,p38丝裂原活化蛋白激酶(MAPK)被认为在MM中起重要作用。因此,p38 α -选择性MAPK抑制剂Talmapimod/SCIO-469(吲哚-5-羧基酰胺,atp竞争抑制剂)或其结构类似物SD-282(吲哚-5-羧基酰胺,atp竞争抑制剂)在小鼠MM异种移植模型中使用人rpm -8226或H-929浆细胞瘤疫苗进行了研究。在rpm -8226起源的可触及肿瘤的小鼠中,开始口服SCIO-469(10、30、90 mg/kg),每天两次,这种情况类似于早期人类骨髓瘤疾病。在可触及肿瘤的小鼠中,14天的SCIO-469治疗以剂量依赖的方式显著降低RPMI-8226肿瘤生长。研究还发现,在具有明显大小肿瘤的小鼠中,采用SCIO-469口服治疗,剂量分别为10、30和90 mg/kg,每日两次,可显著降低RPMI-8226肿瘤生长,这种情况类似于人类晚期骨髓瘤疾病。在另一组使用SCIO-469类似物SD-282口服90 mg/kg/bid的类似研究中,研究结束时的组织学评估显示RPMI-8226肿瘤生长和血管生成显著减少。SD-282还显著降低了肿瘤细胞中热休克蛋白27 (HSP-27)和磷酸化p38的表达。此外,SCIO-469与地塞米松联合给药在地塞米松敏感的H-929肿瘤中激发了抗肿瘤特性,其剂量远低于地塞米松的典型有效剂量,表明其联合治疗的潜力。综上所述,p38抑制剂在疾病的早期和晚期都能降低人骨髓瘤细胞的体内生长。目前的研究也提供了与地塞米松联合治疗的可能性的证据。[4] |
| 酶活实验 |
MAPKAP激酶测定[1]
使用MAPKAPK2激酶检测试剂盒进行MAPKAPK2激酶检测。简单地说,将MM.1S细胞用Talmapimod/SCIO469预孵育30 min,然后用PS-341处理1 h。根据制造商的方案,全细胞裂解物(1mg)进行MAPKAPK2免疫沉淀激酶测定。 |
| 细胞实验 |
Talmapimod (SCIO-469) 在添加到 Transwell 系统的下室之前,用 5TMM 细胞 (0.5 × 106/mL) 在无血清培养基中进行预处理。在 Transwell 本身中,接种了来自合成骨髓的基质细胞。根据制造商的说明,18 小时后从下室取出 5TMM 细胞,并使用 FITC 标记的抗体对活性 caspase-3 进行染色。
BMSC培养和ELISA [1] 从MM患者身上获得BM标本。采用Ficoll-Hypaque密度沉淀法分离的单核细胞(MNCs)建立长期BM培养,如先前所述(Uchiyama et al., 1993)。当贴壁细胞单层形成时,细胞在含有0.25%胰蛋白酶和0.02% EDTA的Hank缓冲盐水溶液中收获,洗涤并离心收集。按照之前的描述,用ELISA法测定培养24小时的骨髓间充质干细胞上清液中IL-6的水平,无论是否存在Talmapimod/SCIO-469。 生长抑制试验[1] Talmapimod/SCIO-469抑制剂对MM细胞系生长的抑制作用通过测量3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四钠染料吸光度来评估,如先前所述(Hideshima等,2000)。 细胞周期分析[1] MM.1S细胞分别用200 nM Talmapimod或DMSO对照处理,然后用40 nM PS-341培养12 h。与先前的研究一样,进行了细胞周期分析(Hideshima等人,2003c, 2003d)。 免疫印迹[1] MM.1S细胞经Talmapimod处理12 h后,用40 nM PS-341培养;与先前的研究一样,收集细胞,洗涤并裂解(Hideshima et al., 2000,2001c)。细胞裂解物经SDS-PAGE处理,转移到PVDF膜上,用抗磷酸p38 MAPK、磷酸jnk、p38 MAPK、磷酸Hsp27、Hsp27、p53和聚adp核糖聚合酶(PARP)抗体,以及抗jnk1、hsp70、p21Cip1、p27Kip1和肌动蛋白抗体进行免疫印迹。 cDNA芯片分析[2] 微阵列和数据分析的细节已在前面描述过,数据使用Bioconductor 1.5.8版本的阵列包中的maNorm函数进行归一化。差异表达值表示为实验RNA的背景减去荧光强度中值与对照RNA的背景减去荧光强度中值的比值。使用RNeasy试剂盒从细胞中提取BMSC总RNA。共对16个杂交序列进行四次重复检测:对照与TNF□(24小时)、TNFα与 / Talmapimod/SCIO-469 + TNFα(24小时)、对照与IL-1β(24小时)、IL-1β与SCIO-469 + IL-1β(24小时)。 荧光原位杂交[2] 将原代MDS骨髓抽吸细胞在Talmapimod/SCIO-469 (500uM)存在和不存在的情况下处理48小时,然后在载玻片上进行细胞自旋。荧光原位杂交分析(FISH)对甲醇-乙酸固定间期细胞核使用制造商的方案进行轻微修改。载玻片在70%甲酰胺/2X SSC中72°C变性5分钟,在冷乙醇系列中脱水。利用5q31染色体上的EGR1探针和着丝粒对照检测5q染色体缺失细胞。将探针与适当体积的缓冲液/蒸馏水混合,在72℃下变性5分钟。将探针混合物涂在变性染色体上,置于37°C的潮湿室中过夜。杂交后所有探针在0.4X SSC/0.3% NP-40溶液中在73℃下洗涤2分钟,然后在2X SSC/0.1% NP-40溶液中在室温下洗涤。然后用DAPI反染风干的载玻片。利用计算机图像分析系统捕获、增强和存储鱼类图像。 Western blot评价p38α MAPK抑制作用。[3] 从患病小鼠胫骨中分离5T33MM和5T2MM细胞,并按先前描述的方法裂解。为了评估Talmapimod/SCIO-469对体外p38α磷酸化的影响,5T2MM和5T33MM细胞在0.5 μmol/L SCIO-469中预孵育1 h后裂解。为评估SCIO-469对体内p38α磷酸化的影响,5T33MM小鼠每天2次,每次给药90 mg/kg SCIO-469 p.o,末次给药2小时后采集骨髓进行Western blotting。 然后通过离心(5分钟,13000 × g)去除细胞碎片,并加入样品缓冲液。煮沸后,样品在10% SDS-PAGE上分离,并转移到聚偏二氟乙烯膜(Bio-Rad)上。用含有5%低脂牛奶和0.1% Tween 20的PBS阻断膜,用抗磷酸化thr180 /Tyr182 p38探针。为了测量总蛋白水平,印迹被剥离并用总p38抗体进行修饰。利用增强化学发光系统对条带进行可视化。 / Talmapimod/SCIO-469对胸苷结合的影响。[3] 5TMM细胞(1 × 106/mL)分别用不同浓度的SCIO-469在无血清培养基或10%胎克隆I中预处理(FCI) 1小时,然后将无血清培养基中的细胞与辐照的(1,500 rad)同基因骨髓基质细胞孵育。收获前16小时,细胞用1 μCi[甲基- 3h]胸腺嘧啶脉冲。使用细胞收割机在玻璃纤维过滤器上收集细胞。过滤器在60°C的烤箱中干燥1小时,密封在含有4ml Optiscint闪烁液的样品袋中。使用1450 Microbeta液体闪烁计数器计算放射性。结果表示为与未处理细胞的相对DNA合成。 Talmapimod/SCIO-469对caspase-3活性的影响[3] 5TMM细胞(0.5 × 106/mL)在无血清培养基中用不同浓度的SCIO-469预处理,然后置于Transwell系统的下室。同源骨髓基质细胞被植入Transwell体内。18h后,从下室收集5TMM细胞,根据制造商的说明,用fitc标记的抗体染色活性caspase-3。 |
| 动物实验 |
Six-week-old male triple immune-deficient BNX mice (RPMI-8226 MM palpable tumors)[4]
P.o.; twice daily orally for 14 days 10, 30, 90 mg/kg Assessment of the effects of Talmapimod/SCIO-469 on the development of myeloma disease in vivo. For studies of the effect of SCIO-469 on myeloma development, three groups of male mice (n = 12) were injected i.v. with 0.5 × 106 5T33MM cells. Mice were left untreated (naive) or, if injected with tumor cells, treated from the time of tumor cells injection with either SCIO-469 (150 or 450 mg/kg powder diet continuously available for the mice) or a vehicle (PBS) until the first mice showed signs of morbidity (at 3.7 weeks). Serum paraprotein concentration was assessed using standard electrophoretic techniques (9), bone marrow tumor burden was assessed by determining plasmacytosis on cytosmears, and bone marrow angiogenesis was assessed by determining microvessel density (see below). To determine the effect of Talmapimod/SCIO-469 on survival, an identical experiment to that described above was done, with the exception that treatment continued until each animal showed signs of morbidity (i.e., hind limb paralysis), at which point they were sacrificed. Kaplan-Meier analysis was done to determine the effect on time to morbidity. Tumor load was confirmed on bone marrow samples. To determine the effect of Talmapimod/SCIO-469 on the development of myeloma-bone disease, studies were done in the 5T2MM model, which develops a characteristic myeloma bone disease (8, 10, 11). Mice were divided into the following groups: group 1 (n = 10) remained without tumor cells (naïve group) and groups 2 to 4 (n = 10 each) were injected via the tail vein with 2 × 106 5T2MM cells. At the time of tumor cell injection, mice were treated with either zoledronic acid (120 μg/kg, s.c., single dose at week 7) or SCIO-469 [150 or 450 mg/kg given in the diet throughout the experimental period (11 weeks)]. At 11 weeks, all mice were sacrificed and the effects of SCIO-469 and zoledronic acid on tumor burden, development of myeloma bone disease, and angiogenesis were assessed (see below). [3] |
| 参考文献 |
|
| 其他信息 |
Talmapimod is an indolecarboxamide obtained by formal condensation of the carboxy group of 6-chloro-3-[(dimethylamino)(oxo)acetyl]-1-methylindole-5-carboxylic acid with the secondary amino group of (2S,5R)-1-[(4-fluorophenyl)methyl]-2,5-dimethylpiperazine. It is a potent inhibitor of MAPK and exhibits anti-cancer properties. It has a role as an EC 2.7.11.24 (mitogen-activated protein kinase) inhibitor, an apoptosis inducer and an antineoplastic agent. It is a N-acylpiperazine, a N-alkylpiperazine, an aromatic amide, a member of monofluorobenzenes, a chloroindole, an indolecarboxamide, a dicarboxylic acid diamide and an aromatic ketone.
Talmapimod is the first-generation oral p38 MAP kinase inhibitor developed by Scios. It has shown to be effective to cure inflammatory diseases such as Rheumatoid Arthritis. Talmapimod is an orally bioavailable, small-molecule, p38 mitogen-activated protein kinase (MAPK) inhibitor with potential immunomodulating, anti-inflammatory, and antineoplastic activities. Talmapimod specifically binds to and inhibits the phosphorylation of p38 MAPK, which may result in the induction of tumor cell apoptosis, the inhibition of tumor cell proliferation, and the inhibition of tumor angiogenesis. This agent may also enhance proteasome inhibitor-induced apoptosis. p38 MAPK is a serine/threonine protein kinase involved in a MAPK signaling cascade that controls cellular responses to various environmental stresses, cytokines, and endotoxins. Drug Indication Investigated for use/treatment in pain (acute or chronic) and rheumatoid arthritis. Mechanism of Action SCIO-469 inhibits p38 kinase, a stimulatory modulator of pro-inflammatory factors including tumor necrosis factor-alpha (TNFa), interleukin-1 (IL-1), and cyclooxygenase-2 (COX-2), all of which are known to contribute to both symptoms and disease progression in patients with Rheumatoid Arthritis (RA). Existing protein-based products that antagonize TNFa have been shown to markedly relieve the symptoms and retard the progression of RA. It also has the potential for additional benefits associated with its inhibition of IL-1 and COX-2. We further studied whether SCIO-469 could also augment cytotoxicity of PS-341 in DHL-4 cells, which overexpress Hsp27 and are resistant to PS-341 (Chauhan et al., 2003c). Consistent with our previous studies, SCIO-469 enhanced cytotoxicity of PS-341 in DHL-4 cells, associated with inhibition of PS-341-triggered phosphorylation of Hsp27. Finally, we also examined the cytotoxicity of combined treatment with SCIO-469 and PS-341 in patient MM cells resistant to PS-341. SCIO-469 significantly augments cytotoxicity of PS-341 in these cells, and its effect on Hsp27 expression in patient cells is under investigation. Our results therefore provide the preclinical rationale for clinical trials for SCIO-469 in combination with PS-341 to either enhance the sensitivity or overcome resistance to PS-341, thereby improving patient outcome. [1] Altogether, our results demonstrate that in addition to its direct anti-apoptotic effects on CD34+ stem cells, SCIO-469 also inhibits the expression of various proinflammatory factors in the bone marrow and disrupts the inflammatory loop that leads to the pleiotropic production of such factors. SCIO-469 is presently being used in a Phase I/II clinical trial in low grade cases of MDS. Early results have shown some efficacy in this disease. Due to the multiple cytokine pathways implicated in MDS pathogenesis, strategies to selectively inhibit individual cytokines and their receptors have not yielded much success in this disease. Our data demonstrates that p38 MAPK may represent a common signaling pathway used by multiple cytokine pathways in MDS and thus may be an attractive therapeutic target in this disease. [2] Our results suggest that, in addition to the previous published role of SCIO-469 on suppression of soluble factors within the bone marrow microenvironment in vitro (2), SCIO-469 also reduces p38α phosphorylation in multiple myeloma cells, both in vitro and in vivo, resulting in a decreased tumor burden, angiogenesis, and bone disease, and therefore targets the multiple myeloma disease at multiple levels. This raises the possibility that targeting p38α MAPK may offer a novel therapeutic approach in the treatment of multiple myeloma. [3] |
| 分子式 |
C27H30N4O3FCL
|
|---|---|
| 分子量 |
513.0035
|
| 精确质量 |
512.199
|
| 元素分析 |
C, 63.21; H, 5.89; Cl, 6.91; F, 3.70; N, 10.92; O, 9.36
|
| CAS号 |
309913-83-5
|
| 相关CAS号 |
Talmapimod hydrochloride;309915-12-6
|
| PubChem CID |
9871074
|
| 外观&性状 |
white solid powder
|
| 密度 |
1.3±0.1 g/cm3
|
| 沸点 |
658.0±65.0 °C at 760 mmHg
|
| 闪点 |
351.7±34.3 °C
|
| 蒸汽压 |
0.0±2.0 mmHg at 25°C
|
| 折射率 |
1.619
|
| LogP |
2.73
|
| tPSA |
65.86
|
| 氢键供体(HBD)数目 |
0
|
| 氢键受体(HBA)数目 |
5
|
| 可旋转键数目(RBC) |
5
|
| 重原子数目 |
36
|
| 分子复杂度/Complexity |
836
|
| 定义原子立体中心数目 |
2
|
| SMILES |
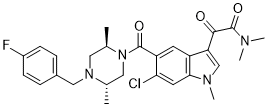
O=C(N(C)C)C(C1=CN(C)C2=C1C=C(C(N3[C@H](C)CN(CC4=CC=C(F)C=C4)[C@@H](C)C3)=O)C(Cl)=C2)=O
|
| InChi Key |
ZMELOYOKMZBMRB-DLBZAZTESA-N
|
| InChi Code |
InChI=1S/C27H30ClFN4O3/c1-16-13-33(17(2)12-32(16)14-18-6-8-19(29)9-7-18)26(35)21-10-20-22(25(34)27(36)30(3)4)15-31(5)24(20)11-23(21)28/h6-11,15-17H,12-14H2,1-5H3/t16-,17+/m0/s1
|
| 化学名 |
2-[6-chloro-5-[(2R,5S)-4-[(4-fluorophenyl)methyl]-2,5-dimethylpiperazine-1-carbonyl]-1-methylindol-3-yl]-N,N-dimethyl-2-oxoacetamide
|
| 别名 |
Talmapimod; SD282; SD 282; SD-282; 309913-83-5; SCIO-469; SCIO 469; Scios 469; Talmapimod [USAN]; SCIO 469 hydrochloride; Talmapimod [USAN:INN]; SCI O282; SCI-O282; SCIO282
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO: ≥ 100 mg/mL (~194.9 mM)
|
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: 2.5 mg/mL (4.87 mM) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 悬浮液;超声助溶。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (4.87 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.5 mg/mL (4.87 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.9493 mL | 9.7466 mL | 19.4932 mL | |
| 5 mM | 0.3899 mL | 1.9493 mL | 3.8986 mL | |
| 10 mM | 0.1949 mL | 0.9747 mL | 1.9493 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
| NCT Number | Recruitment | interventions | Conditions | Sponsor/Collaborators | Start Date | Phases |
| NCT00043732 | Completed | Drug: SCIO-469 | Rheumatoid Arthritis | Scios, Inc. | Phase 2 | |
| NCT00095680 | Completed | Drug: SCIO-469 and bortezomib Drug: SCIO-469 |
Multiple Myeloma | Scios, Inc. | November 2004 | Phase 2 |
| NCT00087867 | Completed | Drug: SCIO-469 and bortezomib Drug: SCIO-469 |
Multiple Myeloma | Scios, Inc. | June 2004 | Phase 2 |
| NCT00113893 | Completed | Drug: SCIO-469 | Bone Marrow Diseases Hematologic Diseases |
Scios, Inc. | May 2005 | Phase 2 |
| NCT00089921 | Completed | Drug: SCIO-469 Drug: Placebo |
Arthritis, Rheumatoid | Scios, Inc. | July 2004 | Phase 2 |
|
|
|
|