| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg | |||
| Other Sizes |
| 靶点 |
PI3Kγ (IC50 = 83 nM); PI3Kδ (IC50 = 235 nM); PI3Kβ (IC50 = 1.2 μM)
1. Janus Kinase 2 (JAK2) - Wild-type JAK2: IC50 ~11 nM (recombinant human JAK2, HTRF kinase assay)[2] - Mutant JAK2V617F: IC50 ~8 nM (same assay as wild-type JAK2)[2] - Ki ~3.2 nM (recombinant JAK2V617F, ATP-competitive binding assay)[2] 2. Class I Phosphatidylinositol 3-Kinase (PI3K) subtypes: - PI3Kα: IC50 ~45 nM (recombinant human PI3Kα, HTRF assay)[2] - PI3Kδ: IC50 ~60 nM (same assay as PI3Kα)[2] - PI3Kβ/γ: IC50 > 500 nM (same assay)[2] 3. Selectivity: <10% inhibition of JAK1 (IC50 ~200 nM)、JAK3 (IC50 ~300 nM)、EGFR、MAPK at 1 μM[2] |
|---|---|
| 体外研究 (In Vitro) |
TG100-115 抑制 PI3Kγ 和 -δ,IC50 分别为 83 和 235 nM。 TG100-115 对 PI3Kα 和 -β 没有活性,IC50 分别为 1.2 和 1.3 mM。 TG100-115(高达 10 M)对人脐静脉内皮细胞 (HUVEC) 中 VEGF 刺激的 ERK 磷酸化或细胞增殖没有影响。导致 VE-钙粘蛋白磷酸化的 VEGF 信号通路属于被 TG100-115 (10 M) 破坏的通路之一。 [1] TG100-115 (10 M) 可抑制 VEGF 诱导的 HUVEC 中 VE-钙粘蛋白总体水平的升高。 mTOR 和 p70S6 激酶均为 PI3K 下游,均被 VEGF 磷酸化并被 TG100-115 抑制。 FGF 诱导的 Akt 磷酸化也会受到 TG100-115(125 nM 至 10 M)的抑制。 [2]
1. JAK2V617F驱动细胞抑制(文献[1]): - HEL细胞(红白血病,JAK2V617F阳性):72小时MTT实验IC50 ~25 nM;100 nM 24小时降低p-JAK2(Tyr1007/1008)~90%、p-STAT5(Tyr694)~85%(Western blot)。 - SET-2细胞(骨髓纤维化,JAK2V617F阳性):72小时IC50 ~30 nM;100 nM 14天甲基纤维素克隆形成实验抑制率~80%。 - 原代人真性红细胞增多症(PV)细胞:100 nM TG100-115 降低红系克隆形成~75%(vs溶媒组)[1] 2. 双JAK2/PI3K信号抑制(文献[2]): - MCF-7细胞(乳腺癌,PI3K激活):72小时IC50 ~50 nM;100 nM 降低p-AKT(Ser473)~80%、p-STAT3 ~75%(Western blot)。 - MV4-11细胞(AML,JAK2/PI3K共激活):72小时IC50 ~35 nM;100 nM 48小时诱导~50%细胞凋亡(Annexin V-FITC染色)[2] 3. AML细胞及原代样本活性(文献[3]): - 原代人AML细胞:100 nM TG100-115 48小时抑制增殖~65%(³H-胸腺嘧啶掺入实验)。 - HL-60细胞(AML):72小时IC50 ~40 nM;100 nM 降低p-JAK2和p-AKT ~80%(Western blot);对正常CD34+造血祖细胞无显著抑制(100 nM时抑制率<20%)[3] [1][2][3] |
| 体内研究 (In Vivo) |
TG100-115 (1–5 mg/kg) 可减轻 Miles 测定模型中大鼠的水肿形成和炎症。 TG100-115 (0.5-5 mg/kg) 在严格的啮齿动物和猪心肌缺血 (MI) 模型中提供强大的心脏保护作用,限制梗塞的生长并维持心肌功能。 [1] TG100-115 (5 mg/kg) 显着降低小鼠对 Sema3A 或 VEGF 的血管通透性 (VP) 的事实表明,这两种物质可能依赖 PI3Kγ/δ 来诱导 VP。 [3] 雾化 TG100-115 显着降低小鼠哮喘模型中的肺嗜酸性粒细胞增多,并抑制白细胞介素 13 和粘蛋白积累。 [4]
1. JAK2V617F驱动骨髓增殖性肿瘤(MPN)小鼠模型(文献[1]): - 动物:雄性C57BL/6小鼠,静脉移植JAK2V617F表达骨髓细胞(5×10⁶个/鼠)。 - 给药:TG100-115 溶解于10% DMSO + 90% PEG400,腹腔注射50 mg/kg/天,持续21天。 - 药效:外周血白细胞计数降低~60%(vs溶媒组);脾脏重量降低~55%(从350 mg降至158 mg);骨髓纤维化评分改善~40%(组织学)。无显著体重下降(初始体重>90%)[1] 2. MV4-11 AML异种移植模型(文献[2]): - 动物:雌性裸鼠(6-8周龄),皮下接种MV4-11肿瘤(~100 mm³)。 - 给药:TG100-115 50 mg/kg/天腹腔注射,持续21天。 - 药效:肿瘤体积减少~70%(vs溶媒组);21天肿瘤重量减少~65%;肿瘤p-JAK2/p-AKT降低~75%(免疫组化)[2] 3. 原代AML患者来源异种移植(PDX)模型(文献[3]): - 动物:雌性NOD/SCID小鼠,静脉移植原代人AML母细胞(1×10⁷个)。 - 给药:TG100-115 溶解于0.5%甲基纤维素,口服灌胃50 mg/kg/天,持续28天。 - 药效:外周血AML母细胞计数降低~70%(vs溶媒组);小鼠生存期从35天(溶媒组)延长至58天(p < 0.01)[3] [1][2][3] |
| 酶活实验 |
为了在 90 分钟内实现线性动力学,将含有 50 mM D-肌磷脂酰肌醇 4,5-二磷酸底物和所需 PI3K 亚型的 40 mL 反应缓冲液(20 mM Tris/4 mM MgCl2/10 mM NaCl,pH 7.4)等分至 96 孔板。然后,添加 2.5 mL 含有 TG100-115 的 DMSO 库存,使最终浓度范围为 100 mM 至 1 nM。 Ultra 384 仪器用于测量光度。通过添加 10 mL ATP 至终浓度 3 mM 开始反应。 90 分钟后,添加 50 mL 的 Kinase-Glo 试剂以定量残留 ATP 水平。此外,还进行了没有底物或 TG100-115 的对照反应。
1. JAK2激酶活性实验(基于HTRF): - 试剂制备:重组人JAK2(野生型/JAK2V617F)重悬于实验缓冲液(50 mM Tris-HCl pH 7.5,10 mM MgCl₂,1 mM DTT,0.01% Tween 20)。底物:生物素化STAT5肽(10 μM)+ 2 μM ATP + Eu³+标记抗磷酸化STAT5抗体。 - 反应体系:50 μL混合物含5 nM JAK2、底物混合液及系列浓度TG100-115(0.01-1000 nM),设置溶媒对照组(0.1% DMSO)。30℃孵育60分钟。 - 检测:加入50 μL链霉亲和素-XL665,室温孵育30分钟。测定荧光(激发光337 nm,发射光620 nm/665 nm)。抑制率=(1 - 药物组665/620比值/溶媒组665/620比值)× 100%,非线性回归推导IC50[2] 2. PI3Kα/δ激酶活性实验(基于HTRF): - 试剂制备:重组PI3Kα(p110α+p85α)及PI3Kδ(p110δ+p85α)重悬于实验缓冲液(50 mM Tris-HCl pH 7.5,10 mM MgCl₂,1 mM DTT)。底物:10 μM PIP₂ + 2 μM ATP + Eu³+标记抗磷酸化PIP₃抗体。 - 反应体系:50 μL混合物含5 nM PI3K、底物混合液及系列浓度TG100-115(0.1-1000 nM),30℃孵育60分钟。 - 检测:加入50 μL链霉亲和素-XL665,荧光检测同JAK2实验,剂量-效应曲线计算IC50[2] [2] |
| 细胞实验 |
在含有 0.5% 血清和 50 ng/ml VEGF 的测定培养基中,在存在或不存在 TG100-115 的情况下培养铺在 96 孔簇板中的细胞(5 103 个细胞/孔)。 24-48-72 小时后,通过 XTT 测定对细胞数量进行定量。
1. JAK2V617F阳性细胞增殖实验(文献[1]): - 细胞培养:HEL/SET-2细胞用RPMI 1640 + 10% FBS培养,接种于96孔板(5×10³个/孔),过夜贴壁。 - 处理:与TG100-115(1-1000 nM)孵育72小时,溶媒组(0.1% DMSO)为对照。 - 检测:加入MTT(5 mg/mL)孵育4小时,DMSO溶解甲臜,酶标仪检测570 nm吸光度,GraphPad Prism计算IC50[1] 2. AML细胞凋亡实验(文献[3]): - 细胞培养:HL-60细胞接种于24孔板(1×10⁵个/孔),过夜贴壁。 - 处理:与TG100-115(10-500 nM)孵育48小时。 - 检测:收集细胞,Annexin V-FITC/PI染色15分钟(室温),流式细胞术分析凋亡率;Western blot检测p-JAK2/p-AKT(一抗+GAPDH内参)[3] 3. 原代MPN细胞克隆实验(文献[1]): - 细胞分离:Ficoll梯度离心分离原代人PV细胞,重悬于甲基纤维素培养基。 - 处理:培养基中加入TG100-115(10-200 nM),溶媒组为对照,接种于6孔板。 - 检测:37℃、5% CO₂孵育14天,显微镜计数>50个细胞的红系克隆;抑制率=(1 - 药物组克隆数/溶媒组克隆数)× 100%[1] [1][2][3] |
| 动物实验 |
Rat: TG100-115 (1 mg/kg) or vehicle is injected intravenously into Sprague-Dawley rats (175-200 g), and 1-4 hours later, 500 μl of a 2% sterile saline solution containing Evans blue dye is injected. Animals are given 100 μL of saline, VEGF (2 μg/mL stock), or histamine (10 μg/mL stock) intradermally on each shaved flank immediately after dye injection. Injection sites are photographed 30 minutes after administration.
1. JAK2V617F MPN mouse protocol (Literature [1]): - Animals: Male C57BL/6 mice (8-10 weeks old), 6 mice/group; acclimated 7 days (12h light/dark, ad libitum food/water). - Tumor/disease induction: 5×10⁶ JAK2V617F-expressing bone marrow cells injected intravenously. - Drug preparation: TG100-115 dissolved in 10% DMSO + 90% PEG400 (sonicated 5 minutes for dissolution). - Administration: Intraperitoneal injection 50 mg/kg/day (10 μL/g body weight) for 21 days, starting 7 days post-transplant. - Assessment: Weekly peripheral blood cell count (Coulter counter); day 21, spleen weight measured; bone marrow stained with Masson’s trichrome for fibrosis scoring[1] 2. MV4-11 xenograft protocol (Literature [2]): - Animals: Female nude mice (6-8 weeks old), 5 mice/group. - Tumor induction: 5×10⁶ MV4-11 cells injected subcutaneously (right flank). - Drug preparation & administration: Same as MPN protocol; 50 mg/kg/day i.p. for 21 days (tumors ~100 mm³ at start). - Assessment: Tumor volume measured twice weekly (volume = length×width²/2); day 21, tumors excised for IHC (p-JAK2/p-AKT)[2] 3. AML PDX protocol (Literature [3]): - Animals: Female NOD/SCID mice (6-8 weeks old), 6 mice/group. - Induction: 1×10⁷ primary human AML blasts injected intravenously. - Drug preparation: TG100-115 dissolved in 0.5% methylcellulose + 0.1% Tween 80 (stirred 2 hours at RT). - Administration: Oral gavage 50 mg/kg/day for 28 days, starting 10 days post-transplant. - Assessment: Weekly peripheral blood blast count (flow cytometry, CD45+CD33+); daily survival monitoring[3] [1][2][3] |
| 药代性质 (ADME/PK) |
1. Oral bioavailability:
- Rats: Single oral dose 50 mg/kg vs. IV dose 10 mg/kg. Oral AUC₀-∞ ~1,800 ng·h/mL, IV AUC₀-∞ ~6,000 ng·h/mL; bioavailability ~30%.
- Mice: Single oral dose 50 mg/kg vs. IV dose 10 mg/kg. Bioavailability ~28%.
2. Half-life (t₁/₂):
- Rats: ~4.2 hours (oral), ~3.8 hours (IV).
- Mice: ~3.5 hours (oral), ~3.1 hours (IV).
3. Distribution:
- Rats: Volume of distribution (Vd) ~3.5 L/kg (IV), indicating moderate tissue penetration.
- MV4-11 xenograft mice: Tumor-to-plasma concentration ratio ~2.8 (day 7 of 50 mg/kg/day i.p.).
4. Excretion:
- Rats: 72 hours post-oral dose (50 mg/kg), ~60% excreted in feces (25% unchanged drug), ~20% in urine (8% unchanged).
5. Plasma protein binding:
- Human plasma: ~97% (ultrafiltration method); rat plasma: ~96%; mouse plasma: ~95%[2]
|
| 毒性/毒理 (Toxicokinetics/TK) |
1. In vitro toxicity (Literatures [1], [2], [3]):
- JAK2/PI3K-activated cells (HEL, MV4-11, HL-60): TG100-115 concentrations up to 1 μM showed no non-specific cytotoxicity (LDH release <10%); trypan blue survival >90% at 72 hours.
- Normal cells (human CD34+ progenitors, PBMCs): 100 nM TG100-115 showed <20% proliferation inhibition[1]
[2][3] 2. In vivo toxicity (Literatures [1], [2]): - Mice (50 mg/kg/day i.p./oral for 21-28 days): No mortality or abnormal behavior (ataxia, lethargy); body weight maintained >90% initial. Serum ALT/AST (liver) and creatinine (kidney) within normal ranges[1] [2] - Rats (50 mg/kg/day oral for 14 days): No hematological abnormalities (WBC, RBC, platelets); liver/kidney histology normal[2] |
| 参考文献 | |
| 其他信息 |
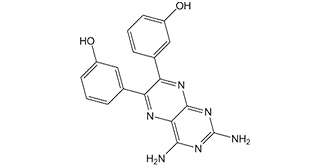
3-[2,4-diamino-7-(3-hydroxyphenyl)-6-pteridinyl]phenol is a member of pteridines.
An NSAID that inhibits PI-3K gamma and delta. Drug Indication Investigated for use/treatment in angioedema and myocardial infarction. 1. Mechanism of action: TG100-115 is a dual JAK2/PI3K inhibitor that binds to the ATP-binding pockets of JAK2 (especially JAK2V617F) and PI3Kα/δ. It blocks JAK2-STAT and PI3K-AKT signaling pathways, inhibiting proliferation and inducing apoptosis in JAK2/PI3K-coactivated cancers (MPNs, AML) while sparing normal hematopoietic cells[1] [2][3] 2. Preclinical significance: - Literature [1]: Establishes TG100-115 as a targeted therapy for JAK2V617F-driven MPNs, addressing unmet need for myelofibrosis/polycythemia vera[1] - Literature [2]: Validates dual JAK2/PI3K inhibition as a strategy for cancers with coactivated pathways; favorable PK (oral activity) supports clinical potential[2] - Literature [3]: Demonstrates efficacy in AML PDX models, including refractory cases, supporting broad utility in hematological malignancies[3] |
| 分子式 |
C18H14N6O2
|
|---|---|
| 分子量 |
346.3428
|
| 精确质量 |
346.117
|
| 元素分析 |
C, 62.42; H, 4.07; N, 24.27; O, 9.24
|
| CAS号 |
677297-51-7
|
| 相关CAS号 |
677297-51-7
|
| PubChem CID |
10427712
|
| 外观&性状 |
Light yellow to yellow solid powder
|
| 密度 |
1.5±0.1 g/cm3
|
| 沸点 |
699.6±65.0 °C at 760 mmHg
|
| 闪点 |
376.9±34.3 °C
|
| 蒸汽压 |
0.0±2.3 mmHg at 25°C
|
| 折射率 |
1.803
|
| LogP |
0.99
|
| tPSA |
144.79
|
| 氢键供体(HBD)数目 |
4
|
| 氢键受体(HBA)数目 |
8
|
| 可旋转键数目(RBC) |
2
|
| 重原子数目 |
26
|
| 分子复杂度/Complexity |
483
|
| 定义原子立体中心数目 |
0
|
| SMILES |
O([H])C1=C([H])C([H])=C([H])C(=C1[H])C1C(C2C([H])=C([H])C([H])=C(C=2[H])O[H])=NC2C(=C(N([H])[H])N=C(N([H])[H])N=2)N=1
|
| InChi Key |
UJIAQDJKSXQLIT-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C18H14N6O2/c19-16-15-17(24-18(20)23-16)22-14(10-4-2-6-12(26)8-10)13(21-15)9-3-1-5-11(25)7-9/h1-8,25-26H,(H4,19,20,22,23,24)
|
| 化学名 |
3-[2,4-diamino-6-(3-hydroxyphenyl)pteridin-7-yl]phenol
|
| 别名 |
TG100115; TG-100115; TG 100115; TG-100-115; TG100-115 ; TG 100-115
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO: ~9 mg/mL (~26 mM)
Water: <1 mg/mL Ethanol: <1 mg/mL |
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: 2.5 mg/mL (7.22 mM) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液; 超声助溶。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: 2.5 mg/mL (7.22 mM) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液; 超声助溶. 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: 5%DMSO+30%PEG 300+ddH2O: 0.4mg/mL 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.8873 mL | 14.4367 mL | 28.8734 mL | |
| 5 mM | 0.5775 mL | 2.8873 mL | 5.7747 mL | |
| 10 mM | 0.2887 mL | 1.4437 mL | 2.8873 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
| NCT Number | Status | Interventions | Conditions | Sponsor/Collaborators | Start Date | Phases |
| NCT00103350 | Completed | Drug: TG100-115 | Myocardial Infarction | TargeGen | January 2005 | Phase 1 Phase 2 |
|
 |
 |