| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 250mg |
|
||
| Other Sizes |
|
| 靶点 |
|
|
|---|---|---|
| 体外研究 (In Vitro) |
使用从阿尔茨海默病患者获得的细胞系,TPPB (compound 5e)(化合物 5e)在 1 μM 剂量下显着增加 sAPPα 分泌 [1]。在 PC12 细胞中,TPPB 通过抗 Aβ25-35 引起神经毒性。在1μM的剂量下,TPPB可以抵消Aβ25-35引起的细胞损伤。 Aβ25-35 治疗可抑制 Akt、PKC、MARCKS 和 MAPK 的磷酸化; TPPB 增加了这种磷酸化。 Aβ25-35 诱导的 caspase-3 激活被 TPPB 抑制 [2]。
通过对来源于AD患者的细胞系的研究,大多数化合物在1 μM浓度下显著增强了sAPPα的分泌,而在0.1 μM浓度下,TPPB(化合物5e)和化合物5f均显著增强了sAPPα分泌。在1 μM时,化合物5c−h对sAPPα分泌的促进作用高于对照化合物8-(1-癸炔基)苯内酰胺(BL)。令人感兴趣的是高亲脂性配体5i的活性缺失,其分子量为11nm。另一方面,它的饱和对应物5j,具有类似的Ki和ClogP,在分泌酶试验中保持活性。在增生研究中,5f在100 μg时表现出适度的反应,5e在300 μg时表现出适度的反应,这表明5f的效力比PKC激活剂mezerein低约30倍,比TPA低100倍。5e的活性大约比5f低3倍。基于对其他强效PKC配体不饱和的影响,我们可以预测5e在大多数试验中保留生物活性,但会显示出明显的促肿瘤活性丧失。因此,化合物5e成为了一种可行的候选化合物,用于寻找能够调节淀粉样蛋白加工的阿尔茨海默病治疗药物。 在之前的研究中,研究者报道了蛋白激酶C (PKC)激活因子TPPB可以通过增加α-分泌酶活性来调节APP加工。在这项研究中,他们进一步研究了TPPB对Aβ(25-35)诱导的PC12细胞神经毒性的潜在神经保护作用。结果表明,浓度为1 μM的TPPB可拮抗Aβ(25-35)诱导的细胞损伤。此外,PKC、Akt和MAPK抑制剂可阻断细胞活力的神经保护作用。实验还表明,TPPB可以增加Akt、PKC、MARCKS和MAPK的磷酸化,而这些磷酸化被Aβ(25-35)抑制。最后,TPPB抑制了Aβ诱导的caspase-3的激活(25-35)。综上所述,本实验提示TPPB对a β(25-35)诱导的PC12细胞神经毒性具有一定作用,并可能提示其治疗AD的潜力。[2] |
|
| 体内研究 (In Vivo) |
增生实验。[1]
TPPB (compound 5e)和5f局部应用于外种Sencar小鼠剃毛后的背部后,评估其诱导增生的作用。根据表皮细胞层数估计增生程度(表2)。将5e和5f的效力与TPA和mezerein的效力进行比较。单次应用1 μg TPA或单次应用3 μg mezerein后观察到可检测到的增生。5f和5e分别在100 μg和300 μg下表现出适度的反应,表明5f的效力比甲泽林低约30倍,比TPA低约100倍。5e的活性大约比5f低3倍。在四次应用后观察到类似的关系,尽管增生的程度更明显。 对远交 Sencar 小鼠的剃光背部进行局部给药后,评估 TPPB 是否会诱导增生,并在 300 μg 剂量下显示出中等反应 [1]。 |
|
| 酶活实验 |
酸式焦磷酸钠α测试。[1]
分泌的sAPPα的浓度使用常规免疫印迹技术测量,随后对其他地方描述的方案进行轻微修改。每个培养皿/处理中沉淀的蛋白提取物装入新鲜制备的8%丙烯酰胺Tris-HCl微型容器中,用SDS - PAGE分离。样品的体积被校正为每皿的总细胞蛋白。然后电泳将蛋白质转移到PVDF膜上。膜用5%脱脂牛奶饱和,以阻止非特异性结合。阻断膜与市售抗体6E10(1:500)在4°C下孵育过夜,该抗体在条件培养基 中识别sAPPα。 清洗后,用辣根过氧化物酶偶联抗小鼠IgG二抗室温孵育。然后使用增强的化学发光检测信号,随后使用超膜ECL曝光。使用BioRad GS-800校准扫描密度计和Multianalyst软件,通过密度测定定量波段强度。 |
|
| 细胞实验 |
将2×104个嗜铬细胞瘤PC12细胞接种到96孔板的每个孔中24小时后,将细胞与一系列浓度(0.1、0.5、1、5、10、20μM)的TPPB一起孵育。 12至24小时后,用含有终浓度0.5g/L的MTT的培养基替换原始培养基4小时。通过 MTT 测定评估细胞活力[2]。
当进行细胞活性,LDH和caspase-3实验时,细胞使用1μM TPPB(溶解在DMSO)或车辆与20μMβ1 h然后24 h。蛋白质磷酸化检测时,细胞使用1μM TPPB 1 h,然后用20μM的β2 h。各种激酶抑制剂使用时,他们说TPPB治疗前30分钟然后暴露于一个β的侮辱。 对于磷酸激酶检测,在药物治疗前24小时用含有0.5% FBS的DMEM代替原培养基。[2] MTT测定[2] 用MTT法测定细胞活力。简单地说,在96孔板的每孔中分别镀2 × 104个细胞24 h后,细胞与一系列浓度的药物孵育。12 ~ 24 h后,将原培养基替换为含MTT的培养基,终浓度为0.5 g/L,培养4 h。然后丢弃培养基,加入DMSO进行比色测定。在自动减去背景信号后,在Tecan Sunrise Eliza-Reader上测定λ = 570/630 nm处的吸收。结果以对照组细胞的百分比表示。 乳酸脱氢酶(LDH)释放测定[2] 根据制造商提供的方案,检测从受损细胞中释放的LDH。简单地说,在药物处理后的指定时间点,收集细胞,250 g离心10分钟,然后将100 μL上清小心地转移到光学透明的96孔板的相应孔中。每孔加入100 μL反应液,室温孵育30 min(避光)。500 nm处的吸光度用微滴板阅读器测量。自动减去背景信号后计算细胞毒性百分比。结果以对照组的百分比表示。 Western Blotting分析[2] 20微克蛋白质与5倍上样缓冲液(0.313 M Tris-HCl (pH 6.8), 25°C, 10% SDS, 0.05%溴酚蓝,50%甘油)和20倍还原剂(2 M DTT)混合煮沸5分钟,上样于7.5% SDS -聚丙烯酰胺电泳凝胶上。电泳后,蛋白质电泳转移到聚偏二氟乙烯(PVDF)膜上。膜用5%脱脂乳饱和,用一抗(β-actin: 1:10 000, phospho-PKC: 1:10 000, phospho-MARCKS: 1:10 000, phospho-Akt: 1:10 000, phospho-MAPK: 1:10 000, phospho-MAPK: 1:10 000, caspase-3: 1:10 000)在4℃下孵育过夜。在tris-buffered saline (TBS)中温和搅拌洗涤30分钟后,将膜与辣根过氧化物酶偶联抗小鼠/兔IgG二抗在脱脂乳中室温孵育1小时。使用ECL Western Blotting检测试剂盒开发信号。 夹心ELISA [2] 采用夹心ELISA法检测磷酸化Akt、Akt和cleaved caspase-3的活性。简单地说,在药物治疗后,收集细胞并用裂解缓冲液处理。超声和离心后,上清液转移到新的微管中,在- 70°C保存以备将来使用。检测前,将样品在- 160°C冻干20 h,并在样品缓冲液中重悬。然后按照生产商的说明书添加检测抗体、二抗和底物。在450 nm处用微滴板阅读器测定信号,结果以对照组的百分比表示。 |
|
| 动物实验 |
Hyperplasia Studies.[1]
Mice were 7 weeks old at the beginning of the treatments and were in the resting phase of the hair cycle. Compounds were dissolved in 0.2 mL of acetone and either were applied once or else were applied twice weekly for a total of four applications. Two animals were treated at each dose of compound, and 72 h after the last application, the animals were euthanized. Two portions of treated skin were removed from each animal, fixed in neutral buffered formalin, and stained with hematoxylin and eosin for histological analysis (staining of sections was performed by American Histolabs, Gaithersburg, MD). TPA (12-O-tetradecanoylphorbol 13-acetate) and mezerein were used. |
|
| 参考文献 |
|
|
| 其他信息 |
Protein kinase C (PKC) is known to participate in the processing of the amyloid precursor protein (APP). Abnormal processing of APP through the action of the beta- and gamma-secretases leads to the production of the 39-43 amino acid Abeta fragment, which is neurotoxic and which is believed to play an important role in the etiology of Alzheimer's disease. PKC activation enhances alpha-secretase activity, which results in a decrease of the amyloidogenic products of beta-secretase. In this article, we describe the synthesis of 10 new benzolactam V8 based PKC activators having side chains of varied saturation and lipophilicity linked to the aromatic ring through an amide group. The K(i) values measured for the inhibition of phorbol ester binding to PKCalpha are in the nanomolar range and show some correlation with their lipophilicity. Compounds 5g and 5h show the best binding affinity among the 10 benzolactams that were synthesized. By use of a cell line derived from an AD patient, significant enhancement of sAPPalpha secretion was achieved at 1 microM concentration for most of the compounds studied and at 0.1 microM for compounds 5e (TPPB) and 5f. At 1 microM the enhancement of sAPPalpha secretion for compounds 5c-h is higher than that observed for the control compound 8-(1-decynyl)benzolactam (BL). Of interest is the absence of activity found for the highly lipophilic ligand 5i, which has a K(i) of 11 nM. On the other hand, its saturated counterpart 5j, which possesses a comparable K(i) and ClogP, retains activity in the secretase assay. In the hyperplasia studies, 5f showed a modest response at 100 microg and 5e at 300 microg, suggesting that 5f was approximately 30-fold less potent than the PKC activator mezerein and 100-fold less potent than TPA. 5e was approximately 3-fold less active than 5f. On the basis of the effect of unsaturation for other potent PKC ligands, we would predict that 5e would retain biological activity in most assays but would show a marked loss of tumor-promoting activity. Compound 5e thus becomes a viable candidate compound in the search for Alzheimer's therapeutics capable of modulating amyloid processing.[1]
In light of the present findings, we believe that compounds such as 5e (TPPB) that are capable of enhancing sAPPα secretion are worth exploring further as possible therapeutics in the treatment of Alzheimer's disease. Such compounds could be used alone or in combination with β-secretase inhibitors to decrease the formation of the neurotoxic β-amyloid peptide, thereby slowing the progression of the disease process [1]. Alzheimer's disease (AD) is pathologically characterized by presence of senile plaques in the hippocampus, which are composed mainly of extracellular deposition of a polypeptide known as the beta amyloid, the Aβ. It has been demonstrated on numerous occasions that it was the deposition and aggregation of this Aβ peptide that cause neuronal dysfunction and even finally, the dementia. Lowering the deposition of Aβ or decreasing its neurotoxicity has long been one of the purposes of AD therapy.[2] Collectively, the experiments here showed that the new PKC activator TPPB could protect PC12 cells from Aβ25–35 insult as indicated by cell viability detection and morphological changes. TPPB corrected Aβ25–35-attenuated Akt, PKC, MARCKS and MAPK phosphorylation and inhibit Aβ-induced caspase-3 activation through PKC-mediated signaling pathways. Activation of PKC with other PKC agonists such as PMA has been shown to increase sAPPα release and to reduce secretion of the Aβ peptide. But the carcinogenicity of PMA limits its clinical application. Other PKC agonists such as bryostatin 1 and methylazoxymethanol acetate all could increase sAPPα, but the precise mechanism how they activate α-secretase is unclear. TPPB could regulate APP processing by increasing α-secretase activity and decreasing Aβ secretion; here the data showed it could inhibit Aβ25–35-induced neurotoxicity. Considering the different roles of sAPPα and Aβ and the possible neuroprotective roles of above-mentioned kinases in AD pathophysiology, we speculate that TPPB may have therapeutic potential in AD, but further research is needed.[2] |
| 分子式 |
C27H30N3O3F3
|
|---|---|
| 分子量 |
501.5406
|
| 精确质量 |
501.223
|
| 元素分析 |
C, 64.66; H, 6.03; F, 11.36; N, 8.38; O, 9.57
|
| CAS号 |
497259-23-1
|
| PubChem CID |
9935767
|
| 外观&性状 |
Light yellow to yellow solid powder
|
| 密度 |
1.2±0.1 g/cm3
|
| 沸点 |
728.8±60.0 °C at 760 mmHg
|
| 闪点 |
394.6±32.9 °C
|
| 蒸汽压 |
0.0±2.5 mmHg at 25°C
|
| 折射率 |
1.572
|
| LogP |
3.09
|
| tPSA |
85.16
|
| 氢键供体(HBD)数目 |
3
|
| 氢键受体(HBA)数目 |
7
|
| 可旋转键数目(RBC) |
6
|
| 重原子数目 |
36
|
| 分子复杂度/Complexity |
806
|
| 定义原子立体中心数目 |
2
|
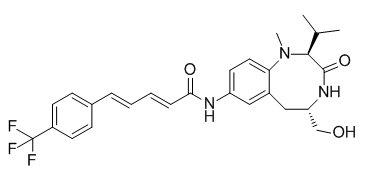
| SMILES |
CC(C)[C@H]1C(=O)N[C@@H](CC2=C(N1C)C=CC(=C2)NC(=O)/C=C/C=C/C3=CC=C(C=C3)C(F)(F)F)CO
|
| InChi Key |
WOLVEMPZUIFSII-IHHOKICGSA-N
|
| InChi Code |
InChI=1S/C27H30F3N3O3/c1-17(2)25-26(36)32-22(16-34)15-19-14-21(12-13-23(19)33(25)3)31-24(35)7-5-4-6-18-8-10-20(11-9-18)27(28,29)30/h4-14,17,22,25,34H,15-16H2,1-3H3,(H,31,35)(H,32,36)/b6-4+,7-5+/t22-,25-/m0/s1
|
| 化学名 |
(2E,4E)-N-[(2S,5S)-5-(hydroxymethyl)-1-methyl-3-oxo-2-propan-2-yl-2,4,5,6-tetrahydro-1,4-benzodiazocin-8-yl]-5-[4-(trifluoromethyl)phenyl]penta-2,4-dienamide
|
| 别名 |
tppb; 497259-23-1; alpha-APP Modulator; (2S,5S)-(E,E)-8-(5-(4-(Trifluoromethyl)phenyl)-2,4-pentadienoylamino)benzolactam; CHEMBL331344; (2E,4E)-N-((2S,5S)-5-(hydroxymethyl)-2-isopropyl-1-methyl-3-oxo-1,2,3,4,5,6-hexahydrobenzo[e][1,4]diazocin-8-yl)-5-(4-(trifluoromethyl)phenyl)penta-2,4-dienamide; (2E,4E)-N-[(2S,5S)-5-(hydroxymethyl)-1-methyl-3-oxo-2-propan-2-yl-2,4,5,6-tetrahydro-1,4-benzodiazocin-8-yl]-5-[4-(trifluoromethyl)phenyl]penta-2,4-dienamide; PKC Activator V;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : ~125 mg/mL (~249.23 mM)
|
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.25 mg/mL (4.49 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 22.5 mg/mL澄清的DMSO储备液加入到400 μL PEG300中,混匀;再向上述溶液中加入50 μL Tween-80,混匀;然后加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.25 mg/mL (4.49 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 22.5 mg/mL 澄清 DMSO 储备液加入到 900 μL 玉米油中并混合均匀。 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.9939 mL | 9.9693 mL | 19.9386 mL | |
| 5 mM | 0.3988 mL | 1.9939 mL | 3.9877 mL | |
| 10 mM | 0.1994 mL | 0.9969 mL | 1.9939 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。