| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg | |||
| Other Sizes |
| 靶点 |
Fatty Acid Amide Hydrolase (FAAH) (recombinant human FAAH IC50 = 2.4 nM; rat FAAH IC50 = 1.8 nM; mouse FAAH IC50 = 2.1 nM);
No significant inhibition of other esterases (e.g., monoacylglycerol lipase, cholinesterase) with IC50 > 1000 nM [2][3] |
|---|---|
| 体外研究 (In Vitro) |
CNS 的 ATP 结合盒 (ABC) 膜转运蛋白 Abcg2 主动挤出 URB937 [3]。
URB937 在底物水解实验中对重组人、大鼠和小鼠FAAH活性具有强效抑制作用,IC50值分别为2.4 nM、1.8 nM和2.1 nM [2][3] - 在大鼠脑膜匀浆中,URB937(0.1-10 nM)呈剂量依赖性抑制FAAH介导的花生四烯酸乙醇胺(anandamide)水解,10 nM时达到最大抑制率(95%)[3] - 在人肝癌细胞(HepG2)和大鼠胎盘滋养层细胞中,URB937(1-10 μM)不影响细胞活力,但10 μM时可抑制细胞内FAAH活性70%-85% [3] - 在脂多糖(LPS)刺激的小鼠巨噬细胞中,URB937(10 nM-1 μM)呈剂量依赖性减少TNF-α和IL-6分泌,1 μM时最大减少率分别为60%(TNF-α)和55%(IL-6)[4] - URB937(1-10 μM)在体外对Abcg2转运体具有高亲和性,抑制Abcg2介导的底物外排的IC50为3.2 μM [3] |
| 体内研究 (In Vivo) |
给予URB937(1 mg/kg,腹腔注射)的小鼠外周器官中的花生四烯乙醇胺水平升高,但前脑或下丘脑中的大麻素水平没有升高[1]。腹腔注射乙酸(URB937,1 mg/kg,皮下注射)可降低疼痛反应[1]。口服剂量(3 mg/kg,F = 36%)一小时后,雄性大鼠以中等速率吸收URB937,并达到其峰值血浆浓度(Cmax)159.47 ng/ml。口服时,URB937 在 3 mg/kg 剂量下的 T1/2 为 60 分钟 [2]。在内脏痛和炎性痛模型中,URB937对雌性小鼠和大鼠具有很强的镇痛作用。此外,该物质仅部分渗透妊娠大鼠和小鼠的胎盘和胎儿组织[3]。 URB937(每 2 天 1 mg/kg,持续 30 天)的两个作用是增加肺组织中的内源性大麻素浓度和减少辐射引起的肺损伤[4]。
大鼠口服URB937(1 mg/kg、3 mg/kg、10 mg/kg)呈剂量依赖性抑制脑FAAH活性,抑制率分别为45%、72%和90%,同时使血浆花生四烯酸乙醇胺水平分别升高2.3倍、4.1倍和6.8倍 [2] - 大鼠福尔马林诱导的疼痛模型中,URB937(3 mg/kg、10 mg/kg,口服)显著减少早期间(神经病理性疼痛,0-5分钟)和晚期间(炎症性疼痛,15-60分钟)的疼痛相关行为,10 mg/kg剂量下舔咬时间分别减少58%(早期)和65%(晚期)[2] - 小鼠辐射诱导的肺损伤模型中,URB937(5 mg/kg,腹腔注射,每日1次,连续21天)减轻肺部炎症,肺组织中TNF-α mRNA表达降低42%,IL-6 mRNA表达降低38% [4] - URB937(5 mg/kg,腹腔注射)减轻辐射诱导的肺纤维化,胶原蛋白沉积(通过羟脯氨酸含量测定)减少35% [4] - 妊娠雌性小鼠静脉注射URB937(10 mg/kg)后,胎儿/血浆浓度比仅为0.12,这是由于胎盘Abcg2转运体的外排作用 [3] - 旷场实验和转棒实验显示,URB937(10 mg/kg,口服)对大鼠无镇静或运动功能损伤作用 [2] |
| 酶活实验 |
FAAH活性抑制实验:将重组FAAH(人/大鼠/小鼠)与不同浓度的URB937及底物[3H]-花生四烯酸乙醇胺在反应缓冲液中于37°C孵育30分钟。加入酸化乙酸乙酯终止反应后,提取未水解的[3H]-花生四烯酸乙醇胺,通过液体闪烁计数法定量,采用非线性回归分析计算IC50值 [2][3]
- 酯酶选择性实验:对单酰基甘油脂肪酶、胆碱酯酶和羧酸酯酶采用相同实验方案,使用特异性底物。在1 μM URB937浓度下测定抑制率,对抑制率>20%的靶点计算IC50值 [2] |
| 细胞实验 |
细胞内FAAH抑制实验:将HepG2细胞或大鼠胎盘滋养层细胞接种于24孔板,培养24小时。用URB937(0.1 μM-10 μM)处理细胞1小时,随后加入[3H]-花生四烯酸乙醇胺孵育30分钟。裂解细胞后,通过闪烁计数法定量[3H]-花生四烯酸乙醇胺的水解情况,评估FAAH抑制效果 [3]
- 细胞因子分泌实验:将小鼠巨噬细胞接种于24孔板,用LPS(1 μg/mL)刺激1小时。加入URB937(10 nM-1 μM),孵育24小时后收集培养上清液,通过ELISA法定量TNF-α/IL-6浓度 [4] - Abcg2转运体相互作用实验:将表达Abcg2的细胞接种于96孔板,负载荧光Abcg2底物。加入URB937(0.1 μM-10 μM),1小时后测定荧光强度,评估底物外排抑制情况,通过剂量-反应曲线拟合计算IC50值 [3] |
| 动物实验 |
Animal/Disease Models: Swiss Webster mouse[1].
Doses: 1 mg/kg. Route of Administration: SC Experimental Results: Inhibition of pain response induced by intraperitoneal (ip) injection of acetic acid. Animal/Disease Models: Adult Sprague Dawley male and female rats (250-300 g) [2]. Doses: 0.3, 1, 3, 10 mg/kg (pharmacokinetic/PK/PK analysis). Route of Administration: Single oral dose. Experimental Results: Inhibited liver FAAH activity, the half effective dose (ED50) was 0.9 mg/kg. Inhibit FAAH in peripheral tissues and identify possible biomarkers of target engagement. |
| 药代性质 (ADME/PK) |
In rats, oral administration of URB937 (10 mg/kg) showed absolute bioavailability of 68%, with Tmax of 1.5 hours and Cmax of 890 ng/mL [2]
- Terminal half-life (t1/2) was 3.8 hours in rats (iv, 2 mg/kg) and 4.2 hours in mice (iv, 5 mg/kg) [2][4] - Volume of distribution (Vdss) was 2.6 L/kg in rats and 3.1 L/kg in mice, indicating extensive tissue distribution [2][3] - Plasma protein binding rate of URB937 was 92% in humans, 90% in rats, and 88% in mice (concentration range: 0.1-10 μM) [2] - URB937 showed limited blood-brain barrier penetration, with brain/plasma concentration ratio of 0.15 in rats 2 hours post-oral administration (10 mg/kg) [2] - In rats, 75% of URB937 was excreted in feces and 20% in urine within 72 hours, mostly as metabolites [2] - In vitro metabolism studies using human liver microsomes showed URB937 was metabolized via oxidation, with no inhibition of CYP450 isoforms (CYP1A2, 2C9, 2C19, 2D6, 3A4) at concentrations up to 10 μM [2] |
| 毒性/毒理 (Toxicokinetics/TK) |
Acute toxicity: Oral administration of URB937 up to 300 mg/kg in rats and 200 mg/kg in mice did not cause mortality or obvious toxic signs (e.g., lethargy, diarrhea, ataxia) within 14 days [2]
- Subchronic toxicity (28 days, rat): Oral doses of 10 mg/kg, 30 mg/kg, and 100 mg/kg/day showed no significant changes in body weight, food consumption, hematological parameters, or organ weights (liver, kidney, brain, heart) [2] - No significant hepatotoxicity or nephrotoxicity was observed: serum ALT, AST, BUN, and creatinine levels were within normal ranges [2][4] - URB937 did not affect reproductive parameters (fetal viability, litter size) in pregnant mice at doses up to 10 mg/kg [3] - No drug-drug interaction potential was identified based on CYP450 inhibition profiles [2] |
| 参考文献 |
|
| 其他信息 |
URB937 is a peripherally restricted, potent, and selective FAAH inhibitor [2][3][4]
- Its mechanism of action involves inhibiting FAAH-mediated hydrolysis of endocannabinoids (e.g., anandamide), increasing peripheral endocannabinoid levels to exert analgesic, anti-inflammatory, and organ-protective effects [1][2][4] - Peripheral restriction is mediated by efflux via the Abcg2 transporter at the blood-brain barrier and blood-placenta barrier, reducing central nervous system and fetal exposure [3] - Preclinical data support its potential for the treatment of pain (neurogenic/inflammatory), radiation-induced lung injury, and inflammatory disorders [2][4] - URB937 has a favorable safety profile with no sedative or motor-impairing effects at therapeutic doses [2] |
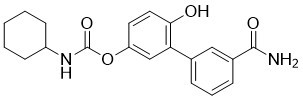
| 分子式 |
C20H22N2O4
|
|---|---|
| 分子量 |
354.406
|
| 精确质量 |
354.157
|
| 元素分析 |
C, 67.78; H, 6.26; N, 7.90; O, 18.06
|
| CAS号 |
1357160-72-5
|
| PubChem CID |
53394762
|
| 外观&性状 |
Off-white to light yellow solid powder
|
| 密度 |
1.3±0.1 g/cm3
|
| 沸点 |
562.8±50.0 °C at 760 mmHg
|
| 闪点 |
294.2±30.1 °C
|
| 蒸汽压 |
0.0±1.6 mmHg at 25°C
|
| 折射率 |
1.639
|
| LogP |
2.38
|
| tPSA |
101.65
|
| 氢键供体(HBD)数目 |
3
|
| 氢键受体(HBA)数目 |
4
|
| 可旋转键数目(RBC) |
5
|
| 重原子数目 |
26
|
| 分子复杂度/Complexity |
492
|
| 定义原子立体中心数目 |
0
|
| InChi Key |
CMEQHOXCIGFZNJ-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C20H22N2O4/c21-19(24)14-6-4-5-13(11-14)17-12-16(9-10-18(17)23)26-20(25)22-15-7-2-1-3-8-15/h4-6,9-12,15,23H,1-3,7-8H2,(H2,21,24)(H,22,25)
|
| 化学名 |
3'-carbamoyl-6-hydroxy-[1,1'-biphenyl]-3-yl cyclohexylcarbamate
|
| 别名 |
URB937 URB-937 URB 937
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : ~250 mg/mL (~705.42 mM)
|
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.08 mg/mL (5.87 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 20.8 mg/mL澄清DMSO储备液加入400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.08 mg/mL (5.87 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 20.8 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.08 mg/mL (5.87 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.8216 mL | 14.1080 mL | 28.2159 mL | |
| 5 mM | 0.5643 mL | 2.8216 mL | 5.6432 mL | |
| 10 mM | 0.2822 mL | 1.4108 mL | 2.8216 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。