| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 1mg |
|
||
| 2mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| Other Sizes |
|
| 靶点 |
PTHR1/parathyroid hormone receptor 1
|
|---|---|
| 体外研究 (In Vitro) |
Abaloparatide(0-100 nM;40 分钟)可增加 MC3T3-E1 细胞中 β-arrestin 募集和 Gs/cAMP 信号传导[1]。 Abaloparatide (0-100 nM) 可有效且剂量依赖性地诱导 U2OS 细胞中的 PTHR1 内化,EC50 值为 0.8 nM[1]。
|
| 体内研究 (In Vivo) |
在小鼠中,Abaloparatide(20–80 µg/kg;皮下注射;每日一次,持续 30 天)可改善皮质结构和骨形成[1]。
特利帕肽和Abaloparatide/阿巴帕肽是甲状旁腺激素受体1 (PTHR1)类似物,治疗骨质疏松症的疗效差异不明。因此,我们比较了Abaloparatide/阿巴帕肽和特立帕肽对骨结构、代谢、核因子- κ B配体受体激活剂(RANKL)和骨保护素(OPG)水平的影响。野生型(WT)雌性小鼠每天注射载药或20-80µg/kg/天的特立帕肽或阿巴帕肽,持续30天。采用微计算机断层扫描检测股骨和脊柱,ELISA检测血清骨转换标志物RANKL和OPG水平。在20-80µg/kg/天的剂量下,这两种类似物同样增加了股骨远端分数小梁骨的体积、连通性和数量,并降低了结构模型指数(SMI)。然而,当剂量为20µg/kg/天时,只有Abaloparatide/阿巴帕肽的小梁厚度显著增加(13%)。股骨皮质评估显示Abaloparatide/阿巴帕肽比特立帕肽引起更大的剂量依赖性皮质厚度增加。特立帕肽和Abaloparatide/阿巴帕肽都增加了腰椎小梁连通性,但对其他指标没有影响或影响不大。生化分析表明,Abaloparatide/阿巴帕肽可促进前胶原1型完整n端前肽(骨形成标志物)和抗酒石酸酸性磷酸酶5b(骨吸收标志物)水平的升高,并降低RANKL/OPG比值。此外,PTHR1信号在0-100 nmol/L类似物处理的细胞中比较。有趣的是,Abaloparatide/阿巴帕肽的cAMP形成(2.3倍)和β-阻滞蛋白募集(1.6倍)的EC50明显低于特立帕肽。因此,Abaloparatide/阿巴帕肽肽改善的疗效可归因于增强骨形成和皮质结构,降低RANKL/OPG比率,增强Gs-cAMP和β-阻滞素信号[1]。
Abaloparatide是一种新型的34个氨基酸的肽,被认为是甲状旁腺激素受体(PTH1R)信号通路的有效和选择性激活剂,与PTH(1-34)同源性为41%,与PTHrP(1-34)同源性为76%。对去卵巢成骨减少(OVX)大鼠进行了一项为期12个月的治疗研究,以表征Abaloparatide/阿巴帕肽增加骨量的机制。SD (Sprague-Dawley)大鼠在6月龄时接受OVX或假手术治疗,并不治疗3个月,以允许OVX引起的骨质流失。10只OVX大鼠在骨衰竭期后被安乐死,其余OVX大鼠每天皮下注射1、5或25 μg/kg/d (n = 18/剂量水平)的运载体(n = 18)或阿巴巴拉肽,持续12个月。假对照组(n = 18)每天接受车辆。纵向评估骨密度测定和骨形成和骨吸收生化指标,尸检时采集L3椎和胫骨进行组织形态学测定。鲍巴总苷增加生化骨形成标志物,但不增加骨吸收标志物或引起高钙血症。鲍巴肽增加骨小梁、皮质内和骨膜表面骨形成的组织形态学指标,而不增加破骨细胞或侵蚀表面。Abaloparatide/阿巴帕肽诱导骨小梁体积和密度的显著增加以及骨小梁微结构的改善。鲍巴肽刺激骨膜扩张和胫骨骨干皮质内骨移位,导致皮质骨体积和密度显著增加。服用Abaloparatide/阿巴帕肽(25 μg/kg) 12个月后,OVX-Vehicle对照组的全身骨密度(BMD)保持稳定,增加25%。组织形态学和生物标志物数据表明,皮质和小梁骨量的增加可归因于阿巴巴拉肽的选择性合成代谢作用,而没有证据表明刺激骨吸收。©2016美国骨与矿物研究协会。[2] |
| 酶活实验 |
PathHunter®eXpress PTHR1 CHO‐K1 β‐抑制素GPCR检测[1]
为了评估Abaloparatide和teriparatide刺激PTHR1对β -抑制素向细胞膜募集的影响,采用PathHunter eXpress PTHR1中国仓鼠卵巢- K1 (CHO - K1) β -抑制素GPCR检测。该分析利用了酶片段互补技术。PTHR1与一个小的酶供体片段ProLink™(PK)融合在框架中,并在CHO - K1细胞中共表达,稳定地表达β -阻滞蛋白和较大的N端缺失β -半乳糖苷酶突变体(称为酶受体或EA)的融合蛋白。PTHR1的激活刺激β -阻滞蛋白与PK -标记的GPCR结合,并迫使两个酶片段互补,从而形成活性β -半乳糖苷酶。然后使用化学发光PathHunter检测试剂测量酶活性的增加。细胞播种、孵育和检测按照制造商的指示进行。简单地说,将细胞接种于透明底白色96孔板中,在37°C CO2培养箱中培养48小时。在37°C的CO2培养箱中,用对照物、特立帕肽或阿巴帕肽处理细胞60分钟。在孵育结束时,在室温下黑暗中添加β - gal酶底物60分钟。利用BMG Labtech PHERAstar FS发光平板阅读器测量β -半胱氨酸酶片段互补和β -抑制素/ PTHR1相互作用的光产生(相对光单位,RLU) [1]。 PathHunter®eXpress PTHR1激活GPCR内化试验[1] 为了确定PTHR1的内化,我们使用了PathHunter eXpress PTHR1 U2OS激活GPCR内化实验。PTHR1激活的GPCR内化U2OS细胞系被设计为共表达一个未标记的PTHR1,一个EA标记的β -阻滞蛋白和一个定位于核内体的PK标记。激活未标记的PTHR1诱导β -抑制素募集,随后在PK -标记的内体中内化GPCR - β -抑制素- EA复合物。类似于β -抑制素分析格式,这种内化迫使两个β -半乳糖酶片段互补,形成水解底物以产生化学发光信号的功能酶。U2OS成骨细胞系播种、孵育和检测按照制造商的指示进行。在37°C的CO2培养箱中,用对照物、特立帕肽或阿巴帕肽处理细胞60分钟。在孵育结束时,在室温下黑暗中添加β - gal酶底物60分钟。利用BMG Labtech PHERAstar FS发光平板阅读器测量β - gal酶片段互补和β -抑制素/内体/PTHR1形成的光产生(RLU)。 |
| 细胞实验 |
细胞内cAMP生成的测定[1]
将MC3T3‐E1细胞以40000个细胞/孔的速度接种于含有500 μ L α‐MEM的24孔板上,其中α‐MEM中添加10%胎牛血清和1% PS。培养1周后,将培养基取出,并用250 μ L刺激培养基(α‐MEM中含有0.05%胎牛血清、0.1%牛血清sa、5 mmol/L hepes缓冲液和0.5 mmol/L IBMX)替换15分钟。IBMX是一种磷酸二酯酶抑制剂,可防止生成的cAMP降解。然后在250µL刺激培养基中加入载体、Abaloparatide和特立帕肽,最终浓度分别为0、0.01、0.1、1、10和100 nmol/L/孔。37°C孵育40分钟,然后取出培养基,在N3液体中快速冷冻,保存在- 80°C。细胞内cAMP的提取,加入100 mmol/L的Hcl,细胞在室温下孵育1小时。使用cAMP竞争性ELISA试剂盒,按照制造商的方案和说明检测细胞内cAMP。 |
| 动物实验 |
16-week-old wild-type (WT) female C57BL/6J mice[1]
20-80 µg/kg S.c.; daily for 30 days All experiments were conducted on 16‐week‐old wild‐type (WT) female C57BL/6J mice (Stock number 664). Vehicle (0.9% NaCl/10 mmol/L acetic acid) or 20–80 µg/kg/day teriparatide or abaloparatide was injected subcutaneously (SC) daily (except Sunday) and continued for 30 days. No peptide injection was performed on the day of animal sacrifice.[1] A total of 13 rats were euthanized or found dead between study days 117 to 358 before study termination: 6 in the sham control group, 2 in the OVX-Veh group, 3 in the OVX + abaloparatide 1 μg/kg/d group, 1 in the OVX + abaloparatide 5 μg/kg/d group, and 1 in the OVX + abaloparatide 25 μg/kg/d group. For these animals’ data, absolute values were reported if collected, and data based on % change from baseline were censored as required. Five deaths were likely secondary to complications from blood collection, whereas the remaining deaths were attributed to incidental age-related pathologies.[1] Study design and dose selection[1] After a 13-week postsurgical bone depletion period, one group of untreated OVX rats was euthanized as a pretreatment baseline group for histomorphometry data. The remaining groups were given daily s.c. injections of vehicle (Vehicle; 0.9% sodium chloride) or one of three dose levels of abaloparatide in a 0.1 mL/kg volume. Abaloparatide dose levels were 1 μg/kg/d (OVX-ABL1), 5 μg/kg/d (OVX-ABL5), and 25 μg/kg/d (OVX-ABL25), with dosing guided by weekly body weight measurements. Preliminary results from another rat study indicated that 6 weeks of abaloparatide at 1.25 μg/kg/d completely reversed OVX-induced bone loss (Radius Health, Inc., Waltham, MA, USA). This led to selection of 1 μg/kg as the low dose, and also 5- and 25-fold multiples of this dose to provide safety margins.[1] |
| 药代性质 (ADME/PK) |
Absorption, Distribution and Excretion
The absolute bioavailability of abaloparatide in healthy women after subcutaneous administration of an 80 mcg dose was 36%. Following subcutaneous administration of 80 mcg abaloparatide in postmenopausal women with osteoporosis for seven days, the mean (SD) Cmax was 812 (118) pg/mL and the AUC0-24 was 1622 (641) pgxhr/mL. The median Tmax was 0.51 hours, with a range from 0.25 to 0.52 hours. The peptide fragments of abaloparatide are primarily eliminated through renal excretion. The volume of distribution was approximately 50 L. The mean apparent total plasma clearance for subcutaneous administration is 168 L/h in healthy subjects. Metabolism / Metabolites Abaloparatide is metabolized into smaller peptide fragments via non-specific proteolytic degradation. Biological Half-Life The mean half-life of abaloparatide is approximately one hour. |
| 毒性/毒理 (Toxicokinetics/TK) |
Protein Binding
_In vitro_, abaloparatide was approximately 70% bound to plasma proteins. |
| 参考文献 |
|
| 其他信息 |
Pharmacodynamics
Abaloparatide stimulates bone formation on periosteal, trabecular, and cortical bone surfaces. It increases bone mineral density and bone formation markers in a dose-dependent manner. Abaloparatide causes transient and limited increases in osteoclast bone resorption and increases bone density. In rats and monkeys, abaloparatide exerted anabolic effects, increasing bone mineral density and mineral content correlating with increases in bone strength at vertebral and nonvertebral sites. |
| 分子式 |
C174H300N56O49
|
|---|---|
| 分子量 |
3960.58963775635
|
| 精确质量 |
3959.273
|
| 元素分析 |
C, 52.58; H, 7.62; N, 19.51; O, 20.29
|
| CAS号 |
247062-33-5
|
| 相关CAS号 |
Abaloparatide TFA
|
| PubChem CID |
145705876
|
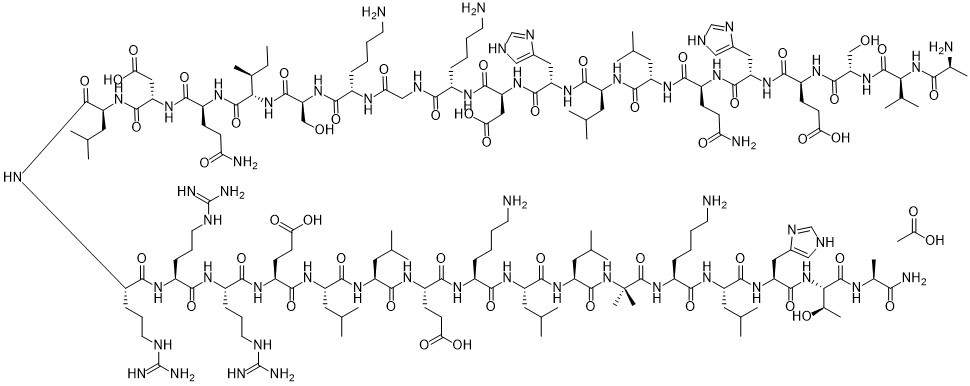
| 序列 |
H-DL-Ala-DL-Val-DL-Ser-DL-Glu-DL-His-DL-Gln-DL-Leu-DL-Leu-DL-His-DL-Asp-DL-Lys-Gly-DL-Lys-DL-Ser-DL-xiIle-DL-Gln-DL-Asp-DL-Leu-DL-Arg-DL-Arg-DL-Arg-DL-Glu-DL-Leu-DL-Leu-DL-Glu-DL-Lys-DL-Leu-DL-Leu-Aib-DL-Lys-DL-Leu-DL-His-DL-xiThr-DL-Ala-NH2
|
| 短序列 |
AVSEHQLLHDKGKSXQDLRRRELLEKLLXKLHXA; AVSEHQLLHDKGKSIQDLRRRELLEKLL-{Aib}-KLHTA-NH2
|
| 外观&性状 |
White to off-white solid powder
|
| LogP |
-20.9
|
| tPSA |
1740
|
| 氢键供体(HBD)数目 |
61
|
| 氢键受体(HBA)数目 |
60
|
| 可旋转键数目(RBC) |
145
|
| 重原子数目 |
279
|
| 分子复杂度/Complexity |
9310
|
| 定义原子立体中心数目 |
0
|
| InChi Key |
BVISQZFBLRSESR-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C174H300N56O49/c1-26-93(20)136(228-165(274)126(80-232)224-141(250)101(39-28-32-56-176)200-129(236)78-195-140(249)100(38-27-31-55-175)201-161(270)123(73-133(243)244)223-160(269)121(71-98-76-190-82-197-98)220-158(267)118(68-90(14)15)216-155(264)114(64-86(6)7)213-148(257)107(45-50-127(180)234)207-159(268)120(70-97-75-189-81-196-97)219-151(260)111(49-54-132(241)242)209-164(273)125(79-231)225-167(276)135(92(18)19)227-139(248)94(21)179)168(277)210-108(46-51-128(181)235)149(258)222-124(74-134(245)246)162(271)217-112(62-84(2)3)152(261)205-105(44-37-61-194-173(187)188)143(252)203-103(42-35-59-192-171(183)184)142(251)204-104(43-36-60-193-172(185)186)144(253)206-110(48-53-131(239)240)150(259)214-115(65-87(8)9)154(263)215-113(63-85(4)5)153(262)208-109(47-52-130(237)238)147(256)202-102(40-29-33-57-177)145(254)211-116(66-88(10)11)156(265)218-119(69-91(16)17)166(275)230-174(24,25)170(279)226-106(41-30-34-58-178)146(255)212-117(67-89(12)13)157(266)221-122(72-99-77-191-83-198-99)163(272)229-137(96(23)233)169(278)199-95(22)138(182)247/h75-77,81-96,100-126,135-137,231-233H,26-74,78-80,175-179H2,1-25H3,(H2,180,234)(H2,181,235)(H2,182,247)(H,189,196)(H,190,197)(H,191,198)(H,195,249)(H,199,278)(H,200,236)(H,201,270)(H,202,256)(H,203,252)(H,204,251)(H,205,261)(H,206,253)(H,207,268)(H,208,262)(H,209,273)(H,210,277)(H,211,254)(H,212,255)(H,213,257)(H,214,259)(H,215,263)(H,216,264)(H,217,271)(H,218,265)(H,219,260)(H,220,267)(H,221,266)(H,222,258)(H,223,269)(H,224,250)(H,225,276)(H,226,279)(H,227,248)(H,228,274)(H,229,272)(H,230,275)(H,237,238)(H,239,240)(H,241,242)(H,243,244)(H,245,246)(H4,183,184,192)(H4,185,186,193)(H4,187,188,194)
|
| 化学名 |
Ala-Val-Ser-Glu-His-Gln-Leu-Leu-His-Asp-Lys-Gly-Lys-Ser-Ile-Gln-Asp-Leu-Arg-ArgArg-Glu-Leu-Leu-Glu-Lys-Leu-Leu-Aib-Lys-Leu-His-Thr-Ala-NH2
|
| 别名 |
BIM-44058; Abaloparatide acetate; BA-058; ITM-058; BIM 44058; BA 058;ITM 058; BIM44058; BA058;ITM058; H-DL-Ala-DL-Val-DL-Ser-DL-Glu-DL-His-DL-Gln-DL-Leu-DL-Leu-DL-His-DL-Asp-DL-Lys-Gly-DL-Lys-DL-Ser-DL-xiIle-DL-Gln-DL-Asp-DL-Leu-DL-Arg-DL-Arg-DL-Arg-DL-Glu-DL-Leu-DL-Leu-DL-Glu-DL-Lys-DL-Leu-DL-Leu-Aib-DL-Lys-DL-Leu-DL-His-DL-xiThr-DL-Ala-NH2; trade name: Tymlos
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 请将本产品存放在密封且受保护的环境中(例如氮气保护),避免吸湿/受潮和光照。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
如何溶解多肽,详情请参考右上角《产品说明书》第3页:“多肽溶解指南”。
配方 1 中的溶解度: ≥ 2.5 mg/mL (0.63 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (0.63 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.5 mg/mL (0.63 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 0.2525 mL | 1.2624 mL | 2.5249 mL | |
| 5 mM | 0.0505 mL | 0.2525 mL | 0.5050 mL | |
| 10 mM | 0.0252 mL | 0.1262 mL | 0.2525 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
| NCT Number | Recruitment | interventions | Conditions | Sponsor/Collaborators | Start Date | Phases |
| NCT03841058 | Recruiting | Drug: Abaloparatide Drug: Placebo |
Spinal Fusion | Hospital for Special Surgery, New York |
August 14, 2019 | Phase 2 |
| NCT04626141 | Not yet recruiting | Drug: Abaloparatide Drug: Placebo |
Femoral Fractures | Daniel Horwitz | September 2023 | Phase 4 |
| NCT04167163 | Recruiting | Drug: Abaloparatide | Osteoporosis Arthroplasties, Knee Replacement |
University of Wisconsin, Madison | January 10, 2020 | Phase 4 |
| NCT04760782 | Recruiting | Drug: Abaloparatide Device: Hard collar immobilization |
Odontoid Fracture | David Lunardini | May 18, 2022 | Phase 2 |
| NCT03710889 | Completed | Drug: Abaloparatide | Osteoporosis Osteoporosis Risk |
Radius Health, Inc. | September 20, 2018 | Phase 3 |
|
|
|