| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 2mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
Mutant isocitrate dehydrogenase 2 (IDH2) (Ki = 0.07 μM for IDH2 R140Q; Ki = 0.16 μM for IDH2 R172K; negligible affinity for wild-type IDH2) [1]
|
|---|---|
| 体外研究 (In Vitro) |
对表达 IDH2R140Q 的人胶质母细胞瘤 U87 和 TF-1 细胞进行 AGI-6780 测试,孵育 48 小时后,IC50 值分别为 11±2.6 nM、18±0.51 nM 和 >1 mM。当 AGI-6780 以将 2HG 降低至接近正常生理水平的浓度给予 TF-1R140Q 细胞时,HBG 和 KLF1 基因的表达以及分化相关的颜色变化都会恢复。在 TF-1 细胞中,AGI-6780 可以消除 IDH2R140Q 引起的分化阻断。在进行 EPO 诱导分化之前,通过 AGI-6780(0.2 μM 和 1 μM)预处理,TF1R140Q 细胞的 (R)-2-羟基戊二酸细胞内浓度显着降低[1]。
在表达IDH2 R140Q(TF-1细胞系)或IDH2 R172K(Kasumi-1细胞系)的白血病细胞中,AGI-6780可抑制致癌代谢物2-羟基戊二酸(2-HG)的生成,IC50约为0.3 μM[1] AGI-6780处理后诱导髓系分化,流式细胞术检测显示分化标志物CD11b表达升高,干细胞标志物CD34表达降低[1] 药物抑制白血病细胞增殖(CCK-8法、Brdu掺入法)并促进凋亡(Annexin V/PI染色),1 μM浓度处理72小时后细胞活力下降50%[1] Western blot结果显示HIF-1α蛋白表达下调,分化相关蛋白(如CEBPA)表达上调;PCR检测显示髓系分化基因(如PU.1)的mRNA水平升高[1] 在浓度高达10 μM时,未观察到对野生型IDH2或IDH1活性的显著抑制,表现出高靶点选择性[1] |
| 体内研究 (In Vivo) |
在携带IDH2 R140Q突变白血病细胞的异种移植小鼠模型中,腹腔注射AGI-6780(50 mg/kg,每日两次,连续21天),可使骨髓和脾脏中的2-HG水平显著降低(较溶媒对照组下降约70%)[1]
药物降低外周血、骨髓和脾脏中的白血病细胞负荷(流式细胞术及组织病理学分析),骨髓中原始细胞比例减少约60%[1] AGI-6780延长异种移植小鼠的总生存期,较溶媒对照组中位生存期延长12天[1] 主要器官(肝、肾、心、肺)的组织学检查未发现明显毒性损伤,小鼠骨髓中白血病细胞的分化表型得到证实[1] |
| 酶活实验 |
将重组野生型或突变型IDH2(R140Q/R172K)与底物(异柠檬酸、NADPH)及系列浓度的AGI-6780在37°C下孵育30分钟[1]
通过分光光度法检测340 nm处吸光度变化,监测NADPH的消耗以测定IDH2酶活性,根据吸光度变化计算酶抑制率[1] 采用竞争性结合模型拟合抑制数据以确定Ki值,设置空白对照组(仅含溶媒的反应体系)和阳性对照组(非选择性IDH抑制剂)验证实验特异性[1] |
| 细胞实验 |
白血病细胞系(TF-1 IDH2 R140Q、Kasumi-1 IDH2 R172K)在含血清培养基中培养,以5×10^4个细胞/孔的密度接种到96孔板中[1]
用浓度范围为0.01–10 μM的AGI-6780处理细胞,以二甲基亚砜(DMSO)为溶媒对照,在37°C、5% CO2培养箱中孵育24–72小时[1] 细胞裂解液经蛋白沉淀后,采用液相色谱-质谱联用(LC-MS)法定量检测2-HG水平[1] 流式细胞术分析分化标志物(CD11b、CD34);CCK-8法(450 nm吸光度检测)或Brdu掺入法(免疫荧光染色)评估细胞增殖;Annexin V/PI双染色结合流式细胞术检测凋亡[1] 采用特异性一抗和辣根过氧化物酶标记的二抗,通过Western blot检测HIF-1α、CEBPA等蛋白表达;实时定量PCR检测分化相关基因的mRNA水平[1] |
| 动物实验 |
Immunodeficient NSG mice (6–8 weeks old) were intravenously injected with 1×10^6 IDH2 R140Q-expressing leukemia cells to establish the xenograft model [1]
Seven days after cell inoculation, mice were randomly divided into treatment and control groups (n=8 per group); the treatment group received intraperitoneal injections of AGI-6780 dissolved in 5% DMSO + 30% PEG400 + 65% normal saline at 50 mg/kg, twice daily for 21 days [1] The control group received equal volumes of the vehicle solution on the same schedule [1] During the experiment, mice were monitored for body weight, activity, and survival status; peripheral blood samples were collected weekly to analyze leukemia cell proportions via flow cytometry [1] At the end of treatment or when mice reached humane endpoints, bone marrow, spleen, liver, and kidney tissues were harvested for 2-HG quantification (LC-MS), flow cytometric analysis of leukemia cell burden, and histopathological examination (H&E staining) [1] |
| 毒性/毒理 (Toxicokinetics/TK) |
In xenograft mice treated with AGI-6780 (50 mg/kg, twice daily for 21 days), no significant changes in body weight were observed compared to the vehicle group [1]
Serum biochemical analysis showed normal levels of alanine transaminase (ALT), aspartate transaminase (AST), creatinine, and urea nitrogen, indicating no obvious hepatotoxicity or nephrotoxicity [1] Histopathological examination of major organs (liver, kidney, heart, lung, spleen) revealed no abnormal lesions or inflammatory responses [1] |
| 参考文献 | |
| 其他信息 |
AGI-6780 is a first-in-class selective small-molecule inhibitor of mutant IDH2, with no cross-reactivity to wild-type IDH2 or IDH1 [1]
Its anti-leukemia mechanism involves binding to the active site of mutant IDH2, inhibiting its enzymatic activity to reduce 2-HG production, which reverses the differentiation block in leukemia cells and restores normal myeloid differentiation [1] The drug was developed for the treatment of acute myeloid leukemia (AML) harboring IDH2 mutations, a subset of AML with poor prognosis and limited therapeutic options [1] At the time of publication (2013), AGI-6780 was in preclinical development, providing a foundational basis for subsequent clinical trials of mutant IDH2 inhibitors [1] |
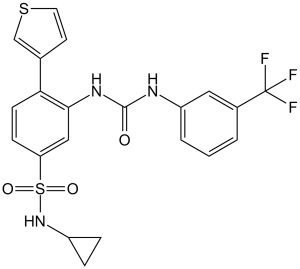
| 分子式 |
C21H18F3N3O3S2
|
|
|---|---|---|
| 分子量 |
481.51
|
|
| 精确质量 |
481.074
|
|
| CAS号 |
1432660-47-3
|
|
| 相关CAS号 |
|
|
| PubChem CID |
71299339
|
|
| 外观&性状 |
White to off-white solid powder
|
|
| 密度 |
1.5±0.1 g/cm3
|
|
| 折射率 |
1.652
|
|
| LogP |
4.42
|
|
| tPSA |
127.41
|
|
| 氢键供体(HBD)数目 |
3
|
|
| 氢键受体(HBA)数目 |
8
|
|
| 可旋转键数目(RBC) |
6
|
|
| 重原子数目 |
32
|
|
| 分子复杂度/Complexity |
771
|
|
| 定义原子立体中心数目 |
0
|
|
| InChi Key |
CCAWRGNYALGPQH-UHFFFAOYSA-N
|
|
| InChi Code |
InChI=1S/C21H18F3N3O3S2/c22-21(23,24)14-2-1-3-16(10-14)25-20(28)26-19-11-17(32(29,30)27-15-4-5-15)6-7-18(19)13-8-9-31-12-13/h1-3,6-12,15,27H,4-5H2,(H2,25,26,28)
|
|
| 化学名 |
1-[5-(cyclopropylsulfamoyl)-2-thiophen-3-ylphenyl]-3-[3-(trifluoromethyl)phenyl]urea
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (5.19 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (5.19 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL 澄清 DMSO 储备液加入到 900 μL 玉米油中并混合均匀。 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.0768 mL | 10.3840 mL | 20.7680 mL | |
| 5 mM | 0.4154 mL | 2.0768 mL | 4.1536 mL | |
| 10 mM | 0.2077 mL | 1.0384 mL | 2.0768 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。