| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg | |||
| Other Sizes |
| 靶点 |
Glutaminase GLS1 (IC50 = 0.16 μM)
BPTES targets glutaminase (GLS, also known as kidney-type glutaminase, KGA) (IC50 = 3 μM for recombinant GLS enzymatic inhibition; Ki = 2.5 μM) [1][2] BPTES selectively inhibits GLS1 isoform, with no significant activity against GLS2 (IC50 > 100 μM) [3] |
|---|---|
| 体外研究 (In Vitro) |
BPTES 抑制人肾细胞中表达的谷氨酰胺酶活性,IC50 为 0.18 μM,并抑制小胶质细胞的谷氨酸流出,IC50 为 80-120 nM。 BPTES 优先减缓具有突变 IDH1 的 D54 细胞的细胞生长。 BPTES 还抑制谷氨酰胺酶活性,降低谷氨酸和 α-KG 水平,并增加糖酵解中间体。 BPTES (10 μM) 抑制源自 LAP/MYC 肿瘤的 mHCC 3-4 细胞的生长。 BPTES 还通过阻断 DNA 复制来抑制 MYC 依赖性 P493 细胞的生长,导致细胞死亡和断裂。激酶测定:制备测定板,每孔含有 2 μL 测试化合物的 DMSO 溶液。将酶在谷氨酰胺酶测定缓冲液中稀释至 1 单位(肝脏)或 0.8 单位(肾脏)/100 μL,并通过 Multidrop 将 100 μL 稀释酶添加到测定板的每个孔中。通过在 TiterMix 100 上全速摇动 1 分钟来混合内容物。将板在室温 (RT) 下预孵育 20 分钟,以使测试化合物与谷氨酰胺酶和 50 μL 谷氨酰胺溶液(测定缓冲液中的浓度为 7 mM)结合。通过 Multidrop 添加到每个孔中。将内容物在 TiterMix 100 上全速摇动 30 秒,然后将板在 RT 下孵育 60 分钟(肝脏)或 90 分钟(肾脏)。为了停止反应,通过 Multidrop 将 20 μL HCl (0.3 N) 添加到每个孔中,并立即在 TiterMix 100 上摇动 30 秒进行混合。为了定量,谷氨酸(由谷氨酰胺酶催化谷氨酰胺水解形成)被氧化为 2-第二种酶谷氨酸脱氢酶 (GDH) 产生氧化戊二酸,同时产生还原形式的烟酰胺腺嘌呤二核苷酸 (NADH)。在吩嗪硫酸甲酯 (PMS) 的催化下,NADH 还原测定溶液中的硝基蓝四唑 (NBT),从而形成蓝紫色甲臜。甲臜在 540 nm 处的吸光度与谷氨酸浓度(最高 200 μM)成线性比例。通过 Multidrop 将 NBT/GDH 试剂 (50 μL) 添加到每个孔中,并在 TiterMix 100 上摇动 30 秒进行混合,并将板在 RT 下孵育 20 分钟,以便通过 GDH 反应形成颜色。谷氨酸浓度由甲臜浓度确定,甲臜浓度通过在 SpectraMax 340 上读取 OD540 nm 来确定。 细胞测定:使用具有异柠檬酸脱氢酶 1 和 2 (IDH1/2) 突变的细胞系。在所有 IDH1 突变的 AML 细胞中,与 DMSO 相比,暴露于 20 µmol/L BPTES 在第 4 天使细胞生长减少约 50%。20 µmol/L BPTES 与 40 µmol/L BPTES 的减少效果没有显着差异。在细胞生长方面,无药物处理与DMSO处理没有显着差异。 BPTES 并没有显着影响野生型 AML 细胞的细胞生长 [3]。在肿瘤细胞中,BPTES 抑制谷氨酰胺转化为谷氨酸。
BPTES 以浓度依赖方式抑制重组GLS酶活性,10 μM浓度下可减少90%的谷氨酰胺向谷氨酸的转化 [1][2] BPTES 对谷氨酰胺依赖型癌细胞系具有抗增殖活性:HeLa宫颈癌细胞IC50 = 5 μM,PC-3前列腺癌细胞IC50 = 4 μM,A549肺癌细胞IC50 = 6 μM,MDA-MB-231乳腺癌细胞IC50 = 3.5 μM [2][3] BPTES 以10 μM浓度处理HeLa细胞24小时,使细胞内谷氨酰胺水平降低75%,ATP生成减少60%,导致细胞阻滞于G1期(G1期细胞占比从40%升至65%)[2] BPTES 以8 μM浓度处理PC-3细胞48小时,诱导细胞凋亡,膜联蛋白V阳性细胞比例达48%,caspase-3/7活性升高3.2倍 [2] BPTES 以5 μM浓度抑制A549细胞中mTORC1信号通路,蛋白质印迹检测显示p-S6K1(Thr389)和p-4EBP1(Ser65)水平降低 [3] BPTES 对正常人成纤维细胞毒性极低(IC50 > 50 μM)[2] |
| 体内研究 (In Vivo) |
在 LAP/MYC 小鼠中,BPTES(12.5 mg/kg,腹腔注射)可延长生存期,且对 MYC、GLS 或 GLS2 水平没有显着影响。 BPTES(200 μg/小鼠,腹膜内注射)还可抑制携带 P493 肿瘤异种移植物的小鼠中的肿瘤细胞生长。
BPTES延长癌症基因工程小鼠模型的存活时间。[3] 基于Gls缺失1个拷贝可以延缓肿瘤发生的观察,我们试图确定用BPTES对Gls进行药理学抑制是否可以延长免疫活性转基因小鼠的存活时间。我们首先确定了BPTES(10μM)对LAP/MYC衍生的小鼠HCC细胞系(mHCC 3-4细胞)生长的体外影响,该细胞系显示Gls mRNA和蛋白质的MYC依赖性表达(图3A和补充图3,a和B)。我们发现,BPTES以剂量依赖的方式抑制mHCC 3-4细胞的生长,临床候选药物CB-839(参考文献16和图3,A和B)也是如此(补充图3C)。虽然约300 nM的BPTES(307 nM)不影响生长,但类似浓度的CB-839(333 nM)显著抑制了生长,表明CB-839是比BPTES更有效的GLS抑制剂。 BPTES 以100 mg/kg/天的剂量腹腔注射裸鼠,持续14天,抑制PC-3前列腺癌异种移植瘤生长62%,且无显著体重下降(变化<4%)[2] BPTES 以75 mg/kg的剂量每日两次灌胃BALB/c裸鼠,持续21天,使HeLa宫颈癌异种移植瘤体积减少55%,肿瘤组织中谷氨酸水平降低 [3] BPTES 以50 mg/kg/天的剂量腹腔注射C57BL/6裸鼠,持续10天,抑制A549肺癌异种移植瘤中mTORC1活性,肿瘤裂解液中p-S6K1表达降低 [3] |
| 酶活实验 |
测定板由每孔 2 微升测试化合物的 DMSO 溶液制成。将酶在谷氨酰胺酶测定缓冲液中稀释至 1 单位(肝脏)或 0.8 单位(肾脏)/100 μL,然后 Multidrop 将 100 μL 稀释酶添加到测定板的每个孔中。在 TiterMix 100 上,通过剧烈摇动一分钟来混合内容物。在室温 (RT) 下将板预孵育 20 分钟以促进测试化合物与谷氨酰胺酶的结合后,Multidrop 向每个孔中添加 50 μL 谷氨酰胺溶液(测定缓冲液中 7 mM)。在 TiterMix 100 上剧烈摇动内容物 30 秒后,将板在室温下孵育肝脏 60 分钟或肾脏 90 分钟。为了停止反应,Multidrop 在每个孔中添加 20 μL HCl (0.3 N),然后在 TiterMix 100 上摇动混合物 30 秒。为了定量谷氨酸盐,谷氨酸盐是谷氨酰胺酶催化谷氨酰胺水解时产生的,谷氨酸脱氢酶 (GDH) 将化合物氧化为 2-酮戊二酸,同时产生还原形式的烟酰胺腺嘌呤二核苷酸 (NADH)。当测定溶液中的硝基蓝四唑 (NBT) 被吩嗪硫酸甲酯 (PMS) 催化的 NADH 还原时,会形成蓝紫色甲臜。在 540 nm 处,甲臜吸收与高达 200 μM 的谷氨酸浓度直接相关。为了使 GDH 反应形成颜色,使用 Multidrop 将 50 μL NBT/GDH 试剂添加到每个孔中,并在 TiterMix 100 上摇动 30 秒。然后将板在室温下孵育 20 分钟或更长时间。通过测量甲臜浓度并使用 SpectraMax 340 读取 OD540 nm,可以计算出谷氨酸浓度。
GLS酶活性实验:重组GLS蛋白与BPTES(0.1–50 μM)及L-谷氨酰胺(底物)在反应缓冲液中37°C孵育1小时;通过谷氨酸脱氢酶比色法定量谷氨酸生成量,经剂量-反应曲线计算IC50/Ki值 [1][2] GLS亚型选择性实验:重组GLS1和GLS2蛋白分别与BPTES(1–100 μM)及L-谷氨酰胺孵育;按上述方法检测谷氨酸水平,确定亚型特异性抑制效果 [3] |
| 细胞实验 |
在 96 孔黑色透明底板中,细胞以 500 个细胞/孔的密度铺板。 24小时后,更换合适的培养基(含有4 mM谷氨酰胺、10% FBS、4.5 g/L、1.5 g/L或0.1 g/L葡萄糖的DMEM)。电镀后 48 小时添加化合物或 DMSO。每个孔接收 200 µL 培养基并添加 alamarBlue。 Victor3 酶标仪用于测量 48 或 72 小时的荧光 (EGCG)。
按照DMSO或BPTES处理后的描述,使用alamarBlue进行细胞生长测定。通过用[3H]-谷氨酰胺孵育细胞提取物,在用DMSO或BPTES处理后测量谷氨酰胺酶活性。使用阴离子交换从反应混合物中分离[3H]-谷氨酸盐,并使用闪烁计数器进行测量。治疗48小时后测定BPTES的所有效果。数据采用双尾学生t检验进行评估。p值≤0.05被认为具有显著性。详细的材料和方法可作为补充信息[1]。 原代人类T细胞增殖分析。[2] 原代人T淋巴细胞在补充了10%FBS(HyClone)、10 mM HEPES、2 mM l-谷氨酰胺、10 U/ml青霉素G和100μG/ml链霉素的RPMI 1640中培养。T细胞用4.5μm的微珠激活,微珠含有固定的抗人CD3和抗人CD28,比例为3个微珠比1个细胞。在DMSO或BPTES(10μM)存在下刺激72小时后,使用CountBright Beads、Via Probe和针对人CD4/CD8的单克隆抗体通过流式细胞术对T细胞进行计数。使用Multisizer III颗粒计数器测定细胞体积。 用Abs间接涂覆组织培养表面以刺激T细胞。[2] 12个孔组织培养板在4°C下用10μg/ml山羊抗小鼠IgG处理过夜。然后用PBS冲洗板3次,并施加含有5%BSA的PBS封闭缓冲液1小时。经过一系列洗涤后,将平板与5μg/ml的Okt3一起孵育2小时。在最后一系列洗涤后,以1×106个细胞/孔的速度接种T细胞,并补充可溶性9.3。此外,T细胞用DMSO或BPTES(10μM)处理。72小时后,使用CountBright Beads和Viaprobe 通过流式细胞术对T细胞进行计数。使用Multisizer III颗粒计数器测定细胞体积。 流式细胞术。[2] P493细胞用Tet处理24小时。然后将它们暴露于BPTES或DMSO中,并从Tet中释放出来以诱导MYC。在不同时间点收集细胞用于细胞周期和BrdU掺入研究。对于细胞周期分布,用BPTES或DMSO处理后,通过离心收集P493细胞,并用PBS洗涤。在4°C下用70%乙醇固定过夜后,用碘化丙啶对细胞进行染色。用PBS洗涤标记的细胞,然后在BD FACSCalibur平台上进行分析。CellQuest Pro软件用于数据采集和评估。对于细胞增殖测定,遵循BD Biosciences-Pharmingen BrdU Flow Kits说明书中的染色方案。P493细胞用BPTES或DMSO处理,并用BrdU脉冲1小时;随后用抗BrdU-FITC和7-AAD染色。在Mac上使用BD CellQuest Pro软件生成了不同细胞周期阶段的BrdU FITC-A与DNA 7-AAD点图,并带有门。FlowJo软件用于数据的再分析。对于每个实验,每个样本记录了100000个事件。 抗增殖实验:癌细胞和正常人成纤维细胞接种于96孔板(5×10³细胞/孔),用BPTES(0.5–100 μM)处理72小时;通过MTT实验(570 nm处吸光度)评估细胞活力,计算IC50值 [2][3] 谷氨酰胺/ATP检测实验:HeLa细胞接种于24孔板(2×10⁵细胞/孔),用BPTES(2–20 μM)处理24小时;HPLC检测细胞内谷氨酰胺水平,化学发光法检测ATP生成量 [2] 细胞周期实验:PC-3细胞用BPTES(5–15 μM)处理24小时,乙醇固定后PI染色,流式细胞术分析细胞周期分布 [2] 凋亡实验:MDA-MB-231细胞用BPTES(4–12 μM)处理48小时,经膜联蛋白V-FITC/PI染色后,流式细胞术分析凋亡细胞;用特异性底物通过发光法检测caspase-3/7活性 [2] 蛋白质印迹实验:A549细胞用BPTES(3–10 μM)处理18小时,裂解后经SDS-PAGE分离蛋白;印迹膜与p-S6K1、S6K1、p-4EBP1、4EBP1及GAPDH(内参)抗体孵育检测 [3] |
| 动物实验 |
For the test, four-week-old female Foxn1nuathymic nude mice are utilized. Living tumor banks are created by propagating freshly excised pancreatic tumor samples from patients at the time of surgery from mouse to mouse. After four weeks postimplantation, mice are given the following treatments: 12.5 mg/kg BPTES intraperitoneally, 200 mg/kg CB-839 twice daily by oral gavage, 54 mg/kg BPTES-NPs (1.2 mg BPTES in 100 µL nanoparticles per mouse) by intravenous injection, blank-NPs (100 µL per mouse) by intravenous injection, 25 mg/kg LY 188011 intraperitoneally, or a combination of BPTES-NPs and LY 188011). For a total of six injections spread over 16 days, BPTES-NPs are administered once every three days.
BPTES treatment of mouse HCC model.[2] MYC expression was induced in LAP/MYC mice by doxycycline removal on the day of birth. LAP/MYC mice were randomly assigned to the BPTES or vehicle treatment group. Intraperitoneal injections (12.5 mg/kg body weight every 3 days) of BPTES or vehicle control (10% DMSO in 200 μl of PBS every 3 days) were initiated 3 weeks after birth. BPTES treatment of tumor xenografts.[2] P493 cells (2 × 107) were injected subcutaneously into the flank of athymic nude mice. When the tumor volumes reached approximately 100 mm3, intraperitoneal 0.2 ml injections of BPTES (200 μg) or vehicle control (10% DMSO in PBS) were initiated and carried out every 3 days for 10 days. The tumor volumes were measured using digital calipers every 3 days and calculated using the following formula: length (mm) × width (mm) × width (mm) × 0.52. Toxicity study.[2] After a 14-day quarantine period, BALB/c mice were assigned at random to 2 groups. The study included a treatment group (12.5 mg/kg body weight every 3 days) and a control group (10% DMSO in 200 μl of PBS every 3 days). Mice were treated for 10 days (4 injections on days 1, 4, 7, and 10). Observations were made twice daily for clinical signs of pharmacologic and toxicologic effects of the BPTES. Histopathologic evaluation of brain, heart, skeletal muscle, lung, and kidney was done by a pathologist without any animal group information. Prostate cancer xenograft model: Nude mice (6–8 weeks old) were subcutaneously injected with 2×10⁶ PC-3 cells; when tumors reached 100 mm³, mice were randomly divided into control and treatment groups; treatment group received BPTES (100 mg/kg/day, dissolved in 10% DMSO + 90% corn oil) via intraperitoneal injection for 14 days, control group received vehicle; tumor volume and body weight were measured every 2 days [2] Cervical cancer xenograft model: BALB/c nude mice were subcutaneously implanted with 1×10⁷ HeLa cells; tumors were allowed to grow to 120 mm³, then mice were administered BPTES (75 mg/kg, dissolved in 0.5% carboxymethylcellulose sodium) via oral gavage twice daily for 21 days; tumor tissues were collected for glutamate level detection [3] Lung cancer xenograft model: C57BL/6 nude mice were subcutaneously injected with 1.5×10⁶ A549 cells; when tumors reached 90 mm³, mice were treated with BPTES (50 mg/kg/day, dissolved in 5% DMSO + 95% saline) via intraperitoneal injection for 10 days; tumor lysates were prepared for western blot analysis [3] |
| 药代性质 (ADME/PK) |
Oral administration of BPTES (75 mg/kg) in mice resulted in peak plasma concentration (Cmax) of 2.8 μg/mL at 2 hours (Tmax), with an elimination half-life (t1/2) of 4.5 hours [3]
BPTES had an oral bioavailability of approximately 20% in mice due to poor aqueous solubility and first-pass metabolism [3] BPTES distributed preferentially to tumor tissues (tumor/plasma ratio = 3.6 at 4 hours post-administration), liver, and kidneys, with low brain penetration (brain/plasma ratio = 0.15) [3] BPTES is metabolized in the liver via glucuronidation and sulfation, with 60% of the drug excreted in feces and 25% in urine within 48 hours [3] |
| 毒性/毒理 (Toxicokinetics/TK) |
BPTES showed low acute toxicity in mice: LD50 = 450 mg/kg (intraperitoneal), LD50 = 800 mg/kg (oral) [2]
Chronic administration (100 mg/kg/day for 28 days) in mice caused no significant changes in serum ALT, AST, BUN, or creatinine levels, indicating no obvious hepatotoxicity or nephrotoxicity [2][3] Plasma protein binding rate of BPTES was 91% in human plasma and 88% in mouse plasma [3] No significant drug-drug interactions were observed with CYP450 enzymes (CYP3A4, CYP2C9, CYP2D6) in vitro [3] |
| 参考文献 | |
| 其他信息 |
Mutation at the R132 residue of isocitrate dehydrogenase 1 (IDH1), frequently found in gliomas and acute myelogenous leukemia, creates a neoenzyme that produces 2-hydroxyglutarate (2-HG) from α-ketoglutarate (α-KG). We sought to therapeutically exploit this neoreaction in mutant IDH1 cells that require α-KG derived from glutamine. Glutamine is converted to glutamate by glutaminase and further metabolized to α-KG. Therefore, we inhibited glutaminase with siRNA or the small molecule inhibitor bis-2-(5-phenylacetamido-1,2,4-thiadiazol-2-yl)ethyl sulfide (BPTES) and found slowed growth of glioblastoma cells expressing mutant IDH1 compared with those expressing wild-type IDH1. Growth suppression of mutant IDH1 cells by BPTES was rescued by adding exogenous α-KG. BPTES inhibited glutaminase activity, lowered glutamate and α-KG levels, and increased glycolytic intermediates while leaving total 2-HG levels unaffected. The ability to selectively slow growth in cells with IDH1 mutations by inhibiting glutaminase suggests a unique reprogramming of intermediary metabolism and a potential therapeutic strategy.[2]
Glutaminase (GLS), which converts glutamine to glutamate, plays a key role in cancer cell metabolism, growth, and proliferation. GLS is being explored as a cancer therapeutic target, but whether GLS inhibitors affect cancer cell-autonomous growth or the host microenvironment or have off-target effects is unknown. Here, we report that loss of one copy of Gls blunted tumor progression in an immune-competent MYC-mediated mouse model of hepatocellular carcinoma. Compared with results in untreated animals with MYC-induced hepatocellular carcinoma, administration of the GLS-specific inhibitor bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl)ethyl sulfide (BPTES) prolonged survival without any apparent toxicities. BPTES also inhibited growth of a MYC-dependent human B cell lymphoma cell line (P493) by blocking DNA replication, leading to cell death and fragmentation. In mice harboring P493 tumor xenografts, BPTES treatment inhibited tumor cell growth; however, P493 xenografts expressing a BPTES-resistant GLS mutant (GLS-K325A) or overexpressing GLS were not affected by BPTES treatment. Moreover, a customized Vivo-Morpholino that targets human GLS mRNA markedly inhibited P493 xenograft growth without affecting mouse Gls expression. Conversely, a Vivo-Morpholino directed at mouse Gls had no antitumor activity in vivo. Collectively, our studies demonstrate that GLS is required for tumorigenesis and support small molecule and genetic inhibition of GLS as potential approaches for targeting the tumor cell-autonomous dependence on GLS for cancer therapy.[3] BPTES is a first-in-class selective small-molecule inhibitor of glutaminase (GLS1) [1][2][3] It exerts antitumor effects by inhibiting GLS1-mediated glutamine hydrolysis to glutamate, blocking glutamine-dependent metabolic pathways critical for cancer cell proliferation, energy production, and biosynthesis [2][3] BPTES was first disclosed in U.S. Patent 6,451,828 B1 as a glutaminase inhibitor with potential anticancer activity [1] Cancer cells relying on glutamine metabolism (e.g., triple-negative breast cancer, prostate cancer, lung cancer) are highly sensitive to BPTES [2][3] The poor aqueous solubility of BPTES limits its clinical development, prompting efforts to develop more soluble analogs [3] |
| 分子式 |
C24H24N6O2S3
|
|
|---|---|---|
| 分子量 |
524.68
|
|
| 精确质量 |
524.112
|
|
| 元素分析 |
C, 54.94; H, 4.61; N, 16.02; O, 6.10; S, 18.33
|
|
| CAS号 |
314045-39-1
|
|
| 相关CAS号 |
|
|
| PubChem CID |
3372016
|
|
| 外观&性状 |
White to off-white solid powder
|
|
| 密度 |
1.4±0.1 g/cm3
|
|
| 折射率 |
1.709
|
|
| LogP |
3.97
|
|
| tPSA |
198.52
|
|
| 氢键供体(HBD)数目 |
2
|
|
| 氢键受体(HBA)数目 |
9
|
|
| 可旋转键数目(RBC) |
12
|
|
| 重原子数目 |
35
|
|
| 分子复杂度/Complexity |
609
|
|
| 定义原子立体中心数目 |
0
|
|
| SMILES |
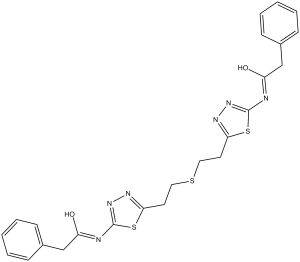
S(C([H])([H])C([H])([H])C1=NN=C(N([H])C(C([H])([H])C2C([H])=C([H])C([H])=C([H])C=2[H])=O)S1)C([H])([H])C([H])([H])C1=NN=C(N([H])C(C([H])([H])C2C([H])=C([H])C([H])=C([H])C=2[H])=O)S1
|
|
| InChi Key |
MDJIPXYRSZHCFS-UHFFFAOYSA-N
|
|
| InChi Code |
InChI=1S/C24H24N6O2S3/c31-19(15-17-7-3-1-4-8-17)25-23-29-27-21(34-23)11-13-33-14-12-22-28-30-24(35-22)26-20(32)16-18-9-5-2-6-10-18/h1-10H,11-16H2,(H,25,29,31)(H,26,30,32)
|
|
| 化学名 |
2-phenyl-N-[5-[2-[2-[5-[(2-phenylacetyl)amino]-1,3,4-thiadiazol-2-yl]ethylsulfanyl]ethyl]-1,3,4-thiadiazol-2-yl]acetamide
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: 2.5 mg/mL (4.76 mM) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 悬浮液;超声助溶。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.08 mg/mL (3.96 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 20.8 mg/mL 澄清 DMSO 储备液加入到 900 μL 玉米油中并混合均匀。 View More
配方 3 中的溶解度: 2 mg/mL (3.81 mM) in 2% DMSO + 40% PEG300 + 5% Tween80 + 53% Saline (这些助溶剂从左到右依次添加,逐一添加), 悬浊液; 超声助溶。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.9059 mL | 9.5296 mL | 19.0592 mL | |
| 5 mM | 0.3812 mL | 1.9059 mL | 3.8118 mL | |
| 10 mM | 0.1906 mL | 0.9530 mL | 1.9059 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
 (A–D) Metabolic effects of metformin on patient-derived orthotopic pancreatic tumors.Proc Natl Acad Sci U S A.2016 Sep 6;113(36):E5328-36. |
|---|
 Effect of glutamate supplement on the proliferation ofKRAS-mutant human-derived pancreatic cancer cells (P198).Proc Natl Acad Sci U S A.2016 Sep 6;113(36):E5328-36. |
 BPTES-NPs selectively target the cycling tumor cell subpopulation.Proc Natl Acad Sci U S A.2016 Sep 6;113(36):E5328-36. |