| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| Other Sizes |
|
| 靶点 |
GPR55
G protein-coupled receptor 55 (GPR55) antagonist [1] |
|---|---|
| 体外研究 (In Vitro) |
CID 16020046对胎儿胆碱酯酶的阻断作用较弱(pIC50=4.4),m-阿片受体的拮抗作用(pIC50=4.6),对KCNH2的阻断作用,人胚肾(HEK)-G蛋白偶联受CID 16020046 (2.5 μM;≥25分钟)显着抑制溶血磷脂酰肌醇(LPI;2.5 μM)诱导的ERK1/2磷酸化。体55 (GPR55)细胞中的hERG通道(pIC50=4.6)[1]。 CID 16020046单独不能诱导HEK-GPR55、HEKCB1细胞中的细胞内Ca2+释放,并且没有显示ERK1/2磷酸化[1]。用CID16020046 (0.01、0.1、1、10 μM)重组会导致GPR55介导的NFAT 激活、NF-kB 激活和 SRE 诱导浓度依赖降低,以响应 HEKGPR55 中的 1 μM LPI 或 GSK319197A 和 HEK-CB1[1]。 CID16020046 (2.5 μM) 紧密抗 GPR55 介导的信号因子激活和核转裁CID16020046 (1 μM) 消除了LPI感应的HMVEC-Ls伤口创伤刺激[1]。 Western Blot分析细胞系: HEK-CB1和HEK-,但对CB1导介的CREB激活没有影响[1]。 CB2 细胞[1] 浓度:2.5 μM 孵育时间:≥25 分钟 结果:显着抑制 LPI (2.5 μM) 诱导的 ERK1/2 磷酸化。单独治疗显示没有 ERK1/2 磷酸化,并且没有改变 WIN55,212-2 (2.5 μM) 在 HEK-CB1 和 HEK-CB2 细胞中诱导的 ERK1/2 磷酸化。
在J774A.1小鼠巨噬细胞中,CID16020046 能浓度依赖性地减少C5a (5 nM)诱导的细胞迁移。与溶剂对照组相比,用1和5 μM CID16020046 孵育可显著减少迁移。 在相同的J774A.1细胞系中,MCP-1 (1 nM)诱导的活化标志物CD11b的表达可被CID16020046 (1, 5, 10 μM)浓度依赖性地降低,几乎恢复到对照水平。 CID16020046 (1 和 2.5 μM) 能强烈抑制由趋化剂fMLP (100 nM)诱导的分离的人中性粒细胞的迁移。 在这些体外实验中使用的CID16020046浓度 (1, 5, 10 μM) 不影响细胞活力。 |
| 体内研究 (In Vivo) |
CID16020046 减少模型生物体中的促炎细胞因子并改善肠道炎症。在健康小鼠中,CID16020046 对运动活动或焦虑水平没有影响[1]。
每天服用CID16020046(20 mg kg−1)可显著降低炎症评分和髓过氧化物酶(MPO)活性。在DSS结肠炎模型中,结肠组织中TNF-α和IL-1β的水平以及环氧化酶(Cox)-2和STAT-3的表达降低,而在TNBS诱导的结肠炎中,Cox-2、IL-1β和IL-6的水平显著降低。流式细胞术对白细胞募集的评估表明,在DSS诱导的结肠炎中,GPR55抑制后,结肠中淋巴细胞和巨噬细胞的存在减少。在J774A.1小鼠巨噬细胞中,抑制GPR55显示巨噬细胞的迁移减少,CD11b表达降低,表明CID16020046对巨噬细胞的直接作用可能有助于改善结肠炎。与DSS模型中的野生型小鼠相比,GPR55−/−敲除小鼠的炎症评分降低,表明其在肠道炎症中具有促炎作用[1]。 在C57BL/6小鼠的DSS诱导结肠炎模型中,每日皮下注射CID16020046 (20 mg/kg),连续7天,与溶剂处理组相比,能显著降低结肠的宏观炎症评分和髓过氧化物酶(MPO)活性。结肠长度缩短也有所改善。 在TNBS诱导的结肠炎模型中,每日皮下注射CID16020046 (20 mg/kg),连续3天,同样能显著降低宏观炎症评分和MPO活性。 对DSS和TNBS模型结肠切片的组织学检查显示,与溶剂处理组相比,CID16020046处理组的结肠隐窝结构保存更好,固有层白细胞浸润减少。 在DSS模型中,CID16020046处理降低了结肠组织中促炎细胞因子TNF-α和IL-1β的水平,而IL-6水平未改变。 在TNBS模型中,CID16020046处理显著降低了结肠组织中IL-1β和IL-6的水平,TNF-α水平也有所降低但不显著。 CID16020046处理显著降低了DSS和TNBS模型中结肠组织的环氧合酶-2 (Cox-2)蛋白表达。 STAT3磷酸化(pSTAT3)受到差异性调节:在DSS模型中,CID16020046处理后pSTAT3降低;而在TNBS模型中,pSTAT3增加。 对DSS模型中白细胞募集的流式细胞术分析显示,CID16020046处理导致结肠固有层中浸润的巨噬细胞和淋巴细胞数量减少近50%,而单核细胞和嗜酸性粒细胞数量无明显变化。中性粒细胞数量增加。 对DSS模型结肠切片的CD3 (T淋巴细胞)和F4/80 (巨噬细胞)免疫组化染色证实,CID16020046处理后黏膜下层的免疫反应性降低。 经受DSS诱导结肠炎的GPR55基因敲除小鼠,与野生型同窝仔相比,表现出显著降低的炎症评分和MPO活性,这支持了GPR55的促炎作用。 在健康C57BL/6小鼠的旷场实验中,每日皮下注射CID16020046 (20 mg/kg),连续6天,与溶剂处理组相比,未改变小鼠的运动活动(总移动距离)或焦虑样行为(在中心区域停留的时间)。体重和体温也未受影响。 |
| 酶活实验 |
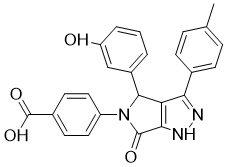
化合物CID16020046(4-[4-(3-羟基苯基)-3-(4-甲基苯基)-6-氧代-1H,4H,5H,6H-吡咯并[3,4-c]吡唑-5-基]苯甲酸)是一种选择性GPR55拮抗剂。在表达人GPR55的酵母细胞中,CID16020046拮抗激动剂诱导的受体激活。在稳定表达人GPR55的人胚胎肾(HEK293)细胞中,该化合物表现为LPI介导的Ca 2⁺释放和细胞外信号调节激酶激活的拮抗剂,但在表达大麻素受体1或2(CB₁或CB₂)的HEK293细胞中则不然。CID16020046浓度依赖性地抑制了LPI诱导的活化T细胞核因子(NFAT)、活化B细胞核因子κ(NF-κB)和血清反应元件的活化、NFAT和NF-κB的易位以及GPR55的内化。它减少了LPI诱导的原代人肺微血管内皮细胞的伤口愈合,并逆转了LPI抑制的血小板聚集,表明GPR55在血小板和内皮细胞功能中起着新的作用。因此,CID16020046是研究原代细胞和组织中GPR55介导机制的有价值的工具[2]。
|
| 细胞实验 |
在 500 μL PBS 中复溶后,将 2 × 106 细胞与 1、5 和 10 μM CID16020046 或 DMSO 预孵育 30 分钟。然后使用 1 nM 单核细胞趋化蛋白 1 (MCP-1) 在 37°C 下再刺激细胞半小时。在潜伏期结束前 15 分钟,添加 Alexa Fluor 647 抗小鼠 CD11b。添加固定液后,在 FACSCalibur 流式细胞仪上对细胞进行计数。数据以媒介物处理的百分比变化形式报告,实验一式三份进行。
迁移实验 (J774A.1巨噬细胞): J774A.1小鼠巨噬细胞在含0.5% FBS的培养基中饥饿过夜。然后用CID16020046 (1, 5 μM)或溶剂处理细胞。将3 x 10^5个细胞的悬浮液加入Transwell小室的上室(膜孔径8 μm)。趋化剂C5a (5 nM)加入下室的培养基中。细胞在37°C、5% CO2的加湿培养箱中迁移2小时。迁移结束后,去除滤膜上室未迁移的细胞。滤膜干燥后,用甲醛固定并封片。在荧光显微镜下对迁移的细胞核进行计数。 CD11b表达实验 (J774A.1巨噬细胞): 将J774A.1细胞 (2 x 10^6)转移至PBS中,与CID16020046 (1, 5, 10 μM)或溶剂预孵育30分钟。然后用MCP-1 (1 nM)在37°C下再刺激30分钟。在孵育结束前15分钟,加入Alexa Fluor 647标记的抗小鼠CD11b抗体。加入固定液后,用流式细胞仪分析细胞的CD11b表达。 迁移实验 (人中性粒细胞): 从健康供体血液中分离人中性粒细胞。将细胞重悬于PBS中,密度为2 x 10^6个细胞/mL。将趋化剂fMLP (100 nM)加入48孔微Boyden小室的下室(聚碳酸酯膜孔径5 μm)。将中性粒细胞悬液与不同浓度的CID16020046 (1, 2.5 μM)或溶剂一起加入上室。小室在37°C孵育1小时。孵育后,去除上室中剩余的细胞。将迁移到下室的细胞转移至试管中,固定后用流式细胞仪分析。 |
| 动物实验 |
CID16020046 (or vehicle) was injected subcutaneously (s.c.) 30 min prior to onset of the colitis models at a dose of 20 mg kg−1 and given once daily for 7 days in the DSS or for 3 days in the TNBS model. [1]
Colitis was induced by either 2.5% dextran sulfate sodium (DSS) supplemented in the drinking water of C57BL/6 mice or by a single intrarectal application of trinitrobenzene sulfonic acid (TNBS).[1] DSS-induced Colitis Model: Male C57BL/6N mice (5-6 weeks old) received 2.5% dextran sulfate sodium (DSS) in their drinking water for 5 days to induce colitis. CID16020046 (20 mg/kg) or vehicle (DMSO) was administered subcutaneously once daily, starting 30 minutes before DSS exposure and continuing for a total of 7 days. Mice were euthanized on day 7, and colons were collected for analysis. TNBS-induced Colitis Model: Male C57BL/6N mice were lightly anesthetized. Trinitrobenzene sulfonic acid (TNBS; 4 mg in 100 μL of 30% ethanol) was administered intrarectally via a gavage needle to induce colitis. CID16020046 (20 mg/kg) or vehicle (DMSO) was administered subcutaneously once daily, starting 30 minutes before TNBS administration and continuing for a total of 3 days. Mice were euthanized on day 3, and colons were collected for analysis. GPR55 Knockout Mouse Model: GPR55 knockout mice and wild-type littermates were subjected to the DSS-induced colitis protocol as described above. Inflammation was assessed macroscopically and by MPO activity. Open Field Test (Behavioral Study): Healthy C57BL/6N mice received daily subcutaneous injections of CID16020046 (20 mg/kg) or vehicle (DMSO) for 6 consecutive days. On day 6, 30 minutes after the last injection, each mouse was placed in the center of an open field arena. Their behavior was recorded for 5 minutes using a video tracking system to assess locomotor activity and anxiety-like behavior. |
| 毒性/毒理 (Toxicokinetics/TK) |
In the open field test with healthy mice, daily subcutaneous administration of CID16020046 (20 mg/kg) for 6 days did not induce signs of sickness, alter locomotor activity, or change anxiety-like behavior. Body weights and body temperatures remained unchanged compared to vehicle-treated animals.
The concentrations of CID16020046 used in in vitro assays (up to 10 μM) did not affect cell viability. |
| 参考文献 | |
| 其他信息 |
Background
G protein-coupled receptor 55 (GPR55) is a lysophospholipid receptor responsive to certain cannabinoids. The role of GPR55 in inflammatory processes of the gut is largely unknown. Using the recently characterized GPR55 inhibitor CID16020046, we determined the role of GPR55 in experimental intestinal inflammation and explored possible mechanisms of action. Conclusions and inferences Pharmacological blockade of GPR55 reduces experimental intestinal inflammation by reducing leukocyte migration and activation, in particular that of macrophages. Therefore, CID16020046 represents a possible drug for the treatment of bowel inflammation.[1] G protein-coupled receptor 55 (GPR55) possesses pro-oncogenic activity and its function can be competitively inhibited with (R,R')-4'-methoxy-1-naphthylfenoterol (MNF) through poorly defined signaling pathways. Here, the anti-tumorigenic effect of MNF was investigated in the human pancreatic cancer cell line, PANC-1, by focusing on the expression of known cancer biomarkers and the expression and function of multidrug resistance (MDR) exporters such as P-glycoprotein (Pgp) and breast cancer resistance protein (BCRP). Incubation of PANC1 cells with MNF (1μM) for 24h significantly decreased EGF receptor, pyruvate kinase M2 (PKM2), and β-catenin protein levels and was accompanied by significant reduction in nuclear accumulation of HIF-1α and the phospho-active forms of PKM2 and β-catenin. Inhibition of GPR55 with either MNF or the GPR55 antagonist CID 16020046 lowered the amount of MDR proteins in total cellular extracts while diminishing the nuclear expression of Pgp and BCRP. There was significant nuclear accumulation of doxorubicin in PANC-1 cells treated with MNF and the pre-incubation with MNF increased the cytotoxicity of doxorubicin and gemcitabine in these cells. Potentiation of doxorubicin cytotoxicity by MNF was also observed in MDA-MB-231 breast cancer cells and U87MG glioblastoma cells, which express high levels of GPR55. The data suggest that inhibition of GPR55 activity produces antitumor effects via attenuation of the MEK/ERK and PI3K-AKT pathways leading to a reduction in the expression and function of MDR proteins. Pharmacol Res. 2016 Sep:111:757-766. CID16020046 is a novel, highly selective antagonist of the G protein-coupled receptor 55 (GPR55). GPR55 is an atypical cannabinoid receptor that can be activated by lysophosphatidylinositol (LPI) and modulated by certain cannabinoids. This study demonstrates that pharmacological inhibition of GPR55 with CID16020046 protects against intestinal inflammation in mouse models of colitis (DSS and TNBS). The protective effect is associated with reduced leukocyte (especially macrophage and lymphocyte) recruitment to the colon, decreased pro-inflammatory cytokine levels, and reduced Cox-2 expression. Genetic ablation of GPR55 also reduces susceptibility to DSS-induced colitis, confirming a pro-inflammatory role for this receptor in intestinal inflammation. CID16020046 exerts direct effects on macrophages, inhibiting their migration and activation marker (CD11b) expression in vitro. The antagonist did not exhibit central nervous system activity or induce sickness behavior in healthy mice at the tested dose, suggesting a favorable safety profile regarding these aspects. CID16020046 represents a potential therapeutic agent for the treatment of inflammatory bowel diseases. |
| 分子式 |
C25H19N3O4
|
|---|---|
| 分子量 |
425.436065912247
|
| 精确质量 |
425.138
|
| 元素分析 |
C, 70.58; H, 4.50; N, 9.88; O, 15.04
|
| CAS号 |
834903-43-4
|
| PubChem CID |
16020046
|
| 外观&性状 |
White to off-white solid powder
|
| LogP |
4.603
|
| tPSA |
106.52
|
| 氢键供体(HBD)数目 |
3
|
| 氢键受体(HBA)数目 |
5
|
| 可旋转键数目(RBC) |
4
|
| 重原子数目 |
32
|
| 分子复杂度/Complexity |
701
|
| 定义原子立体中心数目 |
0
|
| SMILES |
O=C(C1C=CC(N2C(C3C=C(O)C=CC=3)C3=C(NN=C3C3C=CC(C)=CC=3)C2=O)=CC=1)O
|
| InChi Key |
VGUQVYZXABOXCX-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C25H19N3O4/c1-14-5-7-15(8-6-14)21-20-22(27-26-21)24(30)28(18-11-9-16(10-12-18)25(31)32)23(20)17-3-2-4-19(29)13-17/h2-13,23,29H,1H3,(H,26,27)(H,31,32)
|
| 化学名 |
4-[4-(3-hydroxyphenyl)-3-(4-methylphenyl)-6-oxo-1,4-dihydropyrrolo[3,4-c]pyrazol-5-yl]benzoic acid
|
| 别名 |
CID-16020046; CID16020046; 834903-43-4; CID-16020046; CID16020046; 4-[4-(3-hydroxyphenyl)-3-(4-methylphenyl)-6-oxo-1,4-dihydropyrrolo[3,4-d]pyrazol-5-yl]benzoic acid; 5AUY4Y2UPU; MLS000675307; SMR000314029; CID 16020046
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO: ~100 mg/mL (~235.1 mM)
|
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: 25 mg/mL (58.76 mM) in 20%PEG300 80% Saline (这些助溶剂从左到右依次添加,逐一添加), 悬浮液;超声助溶。
*生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (5.88 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.5 mg/mL (5.88 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 配方 4 中的溶解度: ≥ 2.5 mg/mL (5.88 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL 澄清 DMSO 储备液加入900 μL 玉米油中,混合均匀。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.3505 mL | 11.7525 mL | 23.5051 mL | |
| 5 mM | 0.4701 mL | 2.3505 mL | 4.7010 mL | |
| 10 mM | 0.2351 mL | 1.1753 mL | 2.3505 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。