| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| Other Sizes |
| 靶点 |
αvβ3 (IC50 = 4 nM, αvβ3-Vitronectin interaction); αvβ5 (IC50 = 79 nM, αvβ5-Vitronectin interaction); αvβ3 (IC50 = 0.61 nM); αvβ5 (IC50 = 8.4 nM); α5β1 (IC50 = 14.9 nM); STAT3
Cilengitide (EMD 121974) targets integrin αvβ3 with a Ki value of 4.1 nM (human recombinant αvβ3) [1] Cilengitide (EMD 121974) targets integrin αvβ5 with a Ki value of 79 nM (human recombinant αvβ5) [1] Cilengitide (EMD 121974) shows low affinity for integrins αIIbβ3, α5β1, and αvβ6 (Ki > 1000 nM) [1] |
|---|---|
| 体外研究 (In Vitro) |
西仑吉肽是一种具有环化 RGD (Arg-Gly-Asp) 基序的五肽。 Cilengitide 抑制整合素 αvβ3 和 ανβ5 介导的内皮细胞的附着和迁移[2]。在评估人黑色素瘤 M21 或 UCLA-P3 人肺癌细胞系的细胞粘附研究中,西仑吉肽抑制整合素介导的玻连蛋白结合,IC50 分别为 0.4 和 0.4 μM[2]。 celenegitide 的 IC50 为 2 μM,可防止人脐静脉内皮细胞粘附玻连蛋白[2]。 Cilengitide(5 μg/mL;12 小时)可诱导 B16 和 A375 细胞凋亡,并在体外抑制黑色素瘤细胞的活力(0–1 mg/mL;24-72 小时)[3]。 B16 和 A375 细胞形成集落的能力受到西来吉肽(5 μg/mL、10 μg/mL;2 周)的抑制[3]。使用塞来吉肽(0–20 μg/mL;12 小时)抑制 STAT3 磷酸化可降低 PD-L1 表达[3]。
人重组整合素结合实验中,西仑吉肽(Cilengitide, EMD 121974)(0.1-1000 nM)竞争性抑制[125I]-玻连蛋白与αvβ3和αvβ5的结合,Ki值分别为4.1 nM和79 nM [1] - 在人胶质母细胞瘤U87MG细胞中,西仑吉肽(Cilengitide, EMD 121974)(1-100 μM)剂量依赖性抑制细胞与玻连蛋白(αvβ3配体)和纤连蛋白(αvβ5配体)的黏附;100 μM浓度时黏附率分别降低82%和65%(p < 0.001) [1] - 西仑吉肽(Cilengitide, EMD 121974)(10-100 μM)抑制U87MG细胞的迁移和侵袭(Transwell实验);50 μM浓度较溶媒组迁移抑制58%,侵袭抑制63%(p < 0.01) [1] - 在小鼠黑色素瘤B16F10细胞中,10 μM 西仑吉肽(Cilengitide, EMD 121974) 增强抗PD-1抗体的细胞毒性,使T细胞介导的肿瘤细胞裂解率提高42%(p < 0.05) [3] - 西仑吉肽(Cilengitide, EMD 121974)(1-10 μM)上调B16F10细胞的MHC I类分子表达,10 μM浓度时上调35%,促进抗原呈递(流式细胞术分析) [3] |
| 体内研究 (In Vivo) |
在裸鼠中,西仑吉肽(每周腹腔注射 10、50 和 250 μg 3 次)可抑制 M21-L 黑色素瘤的生长[2]。在 B16 小鼠黑色素瘤模型中,克伦吉肽(50 mg/kg;腹膜内注射;每日)可改善 CD8+ T 细胞功能,并支持抗 PD1 单克隆抗体的抗 PD1 功效[3]。
在一项纳入84名晚期实体瘤患者的I/II期临床试验中,静脉输注西仑吉肽(Cilengitide, EMD 121974)(0.25-20 mg/kg,每周一次),32%的患者达到疾病稳定,中位无进展生存期(PFS)为3.8个月 [2] - 在荷B16F10黑色素瘤异种移植的C57BL/6小鼠中,腹腔注射西仑吉肽(Cilengitide, EMD 121974)(5 mg/kg,隔天一次)联合抗PD-1抗体(10 mg/kg,每周一次),较抗PD-1单药治疗肿瘤体积缩小68%(p < 0.01) [3] - 西仑吉肽(Cilengitide, EMD 121974) + 抗PD-1联合治疗使荷瘤小鼠的中位生存期延长52%(42天 vs. 单药组27.6天,p < 0.01) [3] - 小鼠中,5 mg/kg 西仑吉肽(Cilengitide, EMD 121974)(腹腔注射)使肿瘤内CD8+ T细胞浸润增加76%,调节性T细胞(Treg)比例降低38%(流式细胞术) [3] |
| 酶活实验 |
整合素结合试验[1]
整合素配体的活性和选择性通过固相结合试验确定,根据先前报道的方案,使用包被的细胞外基质蛋白和可溶性整合素。以下列化合物为内标:Cilengitide/西伦吉肽,c(RGDf(NMe)V) (αvβ3-0.54 nM, αvβ5-8 nM, α5β1-15.4 nM),线性肽RTDLDSLRT4 (αvβ6-33 nM;8 - 100 nM)和vαβtirofiban5 (IIbαβ3 - 1.2海里)。[1] 用ecm蛋白(1)(每孔100 μL)在碳酸缓冲液(15 mM Na2CO3, 35 mM NaHCO3, pH 9.6)中在4°C下包被96孔平底ELISA板过夜。然后用pbs - t缓冲液(磷酸盐缓冲盐水/Tween20, 137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, 2 mM KH2PO4, 0.01% Tween20, pH 7.4)洗涤每孔;3 × 200 μL),室温下用ts -b缓冲液(Tris-saline/BSA缓冲液;150μL /;20 mM Tris-HCl, 150 mM NaCl, 1 mM CaCl2, 1 mM MgCl2, 1 mM MnCl2, pH 7.5, 1% BSA)。同时,将化合物和内标品以1:5的稀释步骤,从20 μM到6.4 nM,在另一个板上配制稀释系列。用PBS-T (200 μL)洗涤三次后,从B-G中每孔转移50 ul稀释系列。A孔填入100 ul tsb溶液(空白),H孔填入50 ul ts -b缓冲液。将人整合素(2)在ts -b缓冲液中的溶液50 ul转移到h -b孔中,rt孵育1 h, PBS-T缓冲液洗涤3次,然后加入一抗(3)(每孔100 μL)。rt孵育1 h后,用PBS-T洗涤3次。然后,在板中加入二次过氧化物酶标记抗体(4)(100 μL/孔),rt孵育1 h。PBS-T洗涤三次后,快速加入SeramunBlau (50 μL/孔,Seramun Diagnostic GmbH, Heidesee, Germany), rt孵育5 min。用3 M H2SO4 (50 μL/孔)停止反应,在450 nm处用平板仪测定吸光度。每个化合物的IC50分两份进行测试,用OriginPro 7.5G软件分析得到的抑制曲线。拐点表示IC50值。测定的IC50均参照内标活度。 整合素αvβ3/αvβ5结合实验:制备表达人重组αvβ3或αvβ5的细胞膜制剂,与[125I]-玻连蛋白及系列浓度的西仑吉肽(Cilengitide, EMD 121974)(0.01 nM至1 μM)在25°C孵育60分钟;玻璃纤维滤膜过滤去除未结合的放射性配体;γ计数法测定结合放射性;采用Cheng-Prusoff方程计算Ki值 [1] - 配体竞争实验:玻连蛋白或纤连蛋白包被的酶标板中,加入西仑吉肽(Cilengitide, EMD 121974)(0.1-1000 nM)和荧光标记的αvβ3/αvβ5整合素片段;37°C孵育90分钟后,洗去未结合的整合素;检测荧光强度,绘制抑制曲线以验证结合特异性 [1] |
| 细胞实验 |
蛋白质印迹分析[3]
细胞类型: B16 和 A375 细胞 测试浓度: 0、5、10 和 20 μg/mL 孵育持续时间: 12 小时 实验结果: 在浓度大于 5 μg/mL 时抑制 PD-L1 表达和 STAT3 磷酸化。 细胞凋亡分析[3] 细胞类型: B16 和 A375 细胞 测试浓度: 5 μg/mL 孵育时间:12小时 实验结果:B16和A375细胞的凋亡率分别为15.27%和14.89%。 肿瘤细胞黏附实验:U87MG细胞接种到玻连蛋白或纤连蛋白包被的96孔板;加入西仑吉肽(Cilengitide, EMD 121974)(1-100 μM),37°C孵育2小时;洗涤去除未黏附细胞;固定黏附细胞并结晶紫染色,570 nm处测定吸光度以量化黏附率 [1] - 迁移和侵袭实验:8 μm孔径Transwell小室包被纤连蛋白(迁移)或基质胶(侵袭);上室加入含西仑吉肽(Cilengitide, EMD 121974)(10-100 μM)的无血清培养基培养的U87MG细胞(1×10⁵个/孔);下室加入含10%胎牛血清的培养基;24小时(迁移)或48小时(侵袭)后,染色并显微镜下计数迁移/侵袭细胞 [1] - T细胞介导的细胞毒性实验:B16F10细胞与小鼠脾脏T细胞(效应细胞:靶细胞=10:1)在西仑吉肽(Cilengitide, EMD 121974)(1-10 μM)和抗PD-1抗体(10 μg/mL)存在下共培养;48小时后,乳酸脱氢酶(LDH)释放法评估细胞毒性,计算裂解率 [3] - MHC I类分子表达实验:B16F10细胞用西仑吉肽(Cilengitide, EMD 121974)(1-10 μM)处理24小时;抗MHC I类抗体染色后流式细胞术分析;平均荧光强度(MFI)相对于溶媒组归一化 [3] |
| 动物实验 |
Animal/Disease Models: Nude mice bearing M21-L melanoma tumors[2]
Doses: 10, 50, and 250 μg Route of Administration: Dosed ip three times per week Experimental Results: Demonstrated inhibition of tumor growth with a reduction in both tumor volume (55%, 75%, and 89%, respectively) and tumor weight (23%, 38%, and 61%, respectively), when compared to controls. Animal/Disease Models: Female C57BL/6 mice (6-8 weeks old) with B16 cells sc[3] Doses: 50 mg/kg; with or without 10 mg/kg Anti-PD1 monoclonal antibody or isotype control ip every 3 days; Route of Administration: intraperitoneal (ip)injection; daily Experimental Results: Downregulated the expression of PD-L1 via STAT3 pathway and diminished the expression of PD-L1. Murine melanoma xenograft model: 6-week-old female C57BL/6 mice were subcutaneously injected with 2×10⁶ B16F10 cells into the right flank; when tumors reached 100 mm³, mice were randomly divided into 4 groups (n=10 per group): vehicle control, Cilengitide (EMD 121974) monotherapy, anti-PD-1 monotherapy, combination therapy [3] - Cilengitide (EMD 121974) was formulated in sterile physiological saline; administered via intraperitoneal injection at 5 mg/kg every other day for 3 weeks [3] - Anti-PD-1 antibody was administered via intraperitoneal injection at 10 mg/kg once weekly for 3 weeks; tumor volume was measured twice weekly with calipers; mice were euthanized when tumors exceeded 2000 mm³, and survival time was recorded [3] - Intratumoral immune cell analysis: At study end, tumors were harvested, dissociated into single-cell suspensions, stained with antibodies against CD8, CD4, and Foxp3, and analyzed by flow cytometry [3] - Clinical trial protocol: Patients with advanced solid tumors (glioblastoma, melanoma, non-small cell lung cancer) were enrolled in a dose-escalation study; Cilengitide (EMD 121974) was administered as a 1-hour intravenous infusion at doses ranging from 0.25 to 20 mg/kg once weekly for 6 weeks per cycle; tumor response was assessed by RECIST criteria every 2 cycles [2] |
| 药代性质 (ADME/PK) |
In humans, Cilengitide (EMD 121974) showed linear pharmacokinetics at doses 0.25-20 mg/kg; peak plasma concentration (Cmax) increased proportionally with dose, reaching 12.8 μg/mL at 20 mg/kg [2]
- The terminal elimination half-life (t1/2) of Cilengitide (EMD 121974) in humans was 2.8 ± 0.6 hours [2] - Plasma clearance of Cilengitide (EMD 121974) was 15.2 ± 3.1 mL/min/kg, and volume of distribution (Vd) was 0.38 ± 0.09 L/kg [2] - Cilengitide (EMD 121974) had a plasma protein binding rate of 25 ± 4% in human plasma (equilibrium dialysis assay) [2] - Oral bioavailability of Cilengitide (EMD 121974) was < 5% in preclinical studies (not detected in human plasma after oral administration) [2] |
| 毒性/毒理 (Toxicokinetics/TK) |
In the phase I/II clinical trial, the most common adverse events (AEs) of Cilengitide (EMD 121974) were fatigue (36%), nausea (28%), hypertension (22%), and headache (18%); 9% of patients experienced grade 3/4 AEs (hypertension, thrombosis), which were manageable with standard therapy [2]
- No significant changes in liver (ALT, AST) or kidney (creatinine, BUN) function markers were observed in patients treated with Cilengitide (EMD 121974) [2] - In mice treated with Cilengitide (EMD 121974) (5 mg/kg, i.p. for 3 weeks), no significant changes in body weight, food intake, or histopathological findings in major organs (liver, kidney, heart) were noted [3] - Cilengitide (EMD 121974) did not induce hematological toxicity (anemia, leukopenia) in humans or animals [2][3] |
| 参考文献 |
|
| 其他信息 |
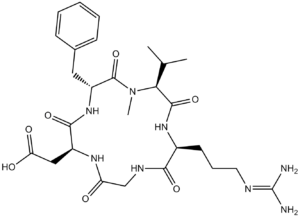
Cilengitide is an oligopeptide.
Cilengitide has been used in trials studying the treatment of Sarcoma, Gliomas, Lymphoma, Leukemia, and Lung Cancer, among others. Cilengitide is a cyclic Arg-Gly-Asp peptide with potential antineoplastic activity. Cilengitide binds to and inhibits the activities of the alpha(v)beta(3) and alpha(v)beta(5) integrins, thereby inhibiting endothelial cell-cell interactions, endothelial cell-matrix interactions, and angiogenesis. (NCI04) Drug Indication Treatment of high-grade glioma Cilengitide (EMD 121974) is a cyclic RGD peptide inhibitor of integrins αvβ3 and αvβ5, developed for the treatment of advanced solid tumors [1][2][3] - Its mechanism of action involves blocking αvβ3/αvβ5-mediated cell adhesion, migration, and angiogenesis, thereby inhibiting tumor progression; it also enhances anti-PD-1 therapy efficacy by modulating tumor immune microenvironment (increasing CD8+ T cell infiltration, reducing Tregs) [3] - Cilengitide (EMD 121974) demonstrated clinical activity in patients with recurrent glioblastoma, with a disease control rate of 41% in a subset analysis [2] - The drug is administered intravenously due to poor oral bioavailability, and its favorable toxicity profile supports combination with immunotherapies [2][3] |
| 分子式 |
C₂₇H₄₀N₈O₇
|
|
|---|---|---|
| 分子量 |
588.66
|
|
| 精确质量 |
588.302
|
|
| 元素分析 |
C, 55.09; H, 6.85; N, 19.04; O, 19.02
|
|
| CAS号 |
188968-51-6
|
|
| 相关CAS号 |
Cilengitide TFA;199807-35-7; Cilengitide;188968-51-6; 188969-00-8 (HCl)
|
|
| PubChem CID |
176873
|
|
| 序列 |
cyclo[L-arginyl-glycyl-L-alpha-aspartyl-D-phenylalanyl-N-methyl-L-valyl]
|
|
| 短序列 |
cyclo[Arg-Gly-Asp-D-Phe-N(Me)Val]
|
|
| 外观&性状 |
White to light yellow solid powder
|
|
| 密度 |
1.4±0.1 g/cm3
|
|
| 折射率 |
1.643
|
|
| LogP |
-2.46
|
|
| tPSA |
235.91
|
|
| 氢键供体(HBD)数目 |
7
|
|
| 氢键受体(HBA)数目 |
8
|
|
| 可旋转键数目(RBC) |
9
|
|
| 重原子数目 |
42
|
|
| 分子复杂度/Complexity |
1020
|
|
| 定义原子立体中心数目 |
4
|
|
| SMILES |
O=C1[C@]([H])(C([H])(C([H])([H])[H])C([H])([H])[H])N(C([H])([H])[H])C([C@@]([H])(C([H])([H])C2C([H])=C([H])C([H])=C([H])C=2[H])N([H])C([C@]([H])(C([H])([H])C(=O)O[H])N([H])C(C([H])([H])N([H])C([C@]([H])(C([H])([H])C([H])([H])C([H])([H])/N=C(\N([H])[H])/N([H])[H])N1[H])=O)=O)=O)=O
|
|
| InChi Key |
AMLYAMJWYAIXIA-VWNVYAMZSA-N
|
|
| InChi Code |
InChI=1S/C27H40N8O7/c1-15(2)22-25(41)33-17(10-7-11-30-27(28)29)23(39)31-14-20(36)32-18(13-21(37)38)24(40)34-19(26(42)35(22)3)12-16-8-5-4-6-9-16/h4-6,8-9,15,17-19,22H,7,10-14H2,1-3H3,(H,31,39)(H,32,36)(H,33,41)(H,34,40)(H,37,38)(H4,28,29,30)/t17-,18-,19+,22-/m0/s1
|
|
| 化学名 |
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: 100 mg/mL (169.88 mM) in PBS (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液; 超声助溶。
请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.6988 mL | 8.4939 mL | 16.9877 mL | |
| 5 mM | 0.3398 mL | 1.6988 mL | 3.3975 mL | |
| 10 mM | 0.1699 mL | 0.8494 mL | 1.6988 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。