| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 2mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| Other Sizes |
| 靶点 |
Tubulin; microtubule; Auristatin
|
|---|---|
| 体外研究 (In Vitro) |
2.5F-Fc 和 2.5F-Fc-MMAF 的 IC50 值相当(分别为 6.9±1.1 与 8.3±1.3 nM),表明整合素结合亲和力并未受到 MMAF 缀合的显着影响[1]。
2.5F-Fc-MMAF以低纳摩尔亲和力与人类肿瘤细胞结合[1] 进行竞争结合试验,比较2.5F-Fc、2.5F-Fc-MMAF和CTRL-Fc-MMAF对U87MG细胞的相对结合亲和力。细胞在4°C下与不同浓度的结蛋白-Fc蛋白和恒定量的AF488标记的2.5F肽竞争物一起孵育,以防止内化。使用流式细胞术测量荧光结合信号,并通过非线性回归分析确定半最大抑制浓度(IC50)值。2.5F-Fc和2.5F-Fc-MMAF的IC50值相似(分别为6.9±1.1和8.3±1.3 nmol/L),表明MMAF结合对整合素结合亲和力的影响可以忽略不计(图3A)。在高达200 nmol/L的浓度下,CTRL-Fc-MMAF没有竞争AF488-2.5F与U87MG细胞的结合,表明这种阴性对照蛋白缺乏可测量的整合素结合(补充图S2)。还测量了2.5F-Fc-MMAF对A2780和MB-468细胞系的相对结合亲和力,IC50值分别为1.1±1.2和1.2±1.2 nmol/L(图3B和C)。[1] 2.5F-Fc-MMAF抑制人类肿瘤细胞的增殖[1] 用2.5F-Fc-MMAF处理后,检测U87MG、A2780和MB-468细胞系的增殖,并与单独或联合添加的2.5F-Fc或接头修饰的MMAF的效果进行比较(图4)。在所有测试的细胞系中,单独使用2.5F-Fc处理在最高测试浓度(高达1μmol/L)下对细胞增殖表现出适度的抑制作用,这是通过细胞脱氢酶活性来测量的,它产生了一种甲赞染料,可以通过分光光度法检测到。2.5F-Fc在高浓度下的细胞毒性,特别是在A2780细胞中,在较小程度上在MB-468细胞中,可能是由于整合素靶向分子破坏细胞粘附的能力。在之前的一项研究中,当肿瘤细胞用高浓度的2.5F肽处理时,也观察到了类似的结果,这与U87MG细胞对分离诱导的凋亡更具抵抗力形成对比。单独使用Linker修饰的MMAF治疗在一定程度上抑制了细胞增殖;在2.5F-Fc加接头修饰的MMAF联合给药时,观察到类似的抑制水平,表明联合治疗缺乏协同作用。在所有三种测试的细胞系中都观察到了类似的趋势。用2.5F-Fc MMAF处理时,细胞增殖的抑制水平最高,在U87MG细胞中观察到的效果最大,这可能是由于与A2780和MB-468细胞相比,这些细胞上的整合素表达水平很高。2.5F-Fc-MMAF治疗的IC50值为:U87MG=9.2±1.1 nmol/L,A2780=26.1±1.1 nmol/L,MB-468=54.1±1.0 nmol/L。与单独使用2.5F-Fc-MMAF或接头修饰的MMAF相比,用CTRL-Fc-MMAF处理的细胞对增殖的抑制作用较小(补充图S3)。这些结果证明了2.5F-Fc-MMAF介导的药物递送的整合素靶向特异性,并表明MMAF与不结合整合素的CTRL-Fc结合会降低游离药物的非特异性活性。 |
| 体内研究 (In Vivo) |
2.5F-Fc-MMAF在U87MG异种移植物中起着有效的抗肿瘤作用[1]
接下来,测试了2.5F-Fc-MMAF在U87MG异种移植物模型中抑制肿瘤生长的能力。选择U87MG细胞进行这些研究,因为它们在用2.5F-Fc-MMAF处理后对细胞增殖的抑制反应最大。在一项初步研究中,nu/nu小鼠(每个治疗组n=5)在其右侧接种U87MG细胞,并允许肿瘤建立6天,在开始治疗前平均大小为35mm2。我们首先评估了通过腹腔注射(i.p.)给药的2.5F-Fc-MMAF的不同给药量和给药方案:10或5mg/kg每周给药两次或三次,或1mg/kg每周给药三次,持续3周。观察到对肿瘤消退的剂量反应效应,其中10mg/kg治疗组的效应最大(补充图S4)。10mg/kg剂量组在第50天均表现出80%的存活率,而对照组小鼠的存活率为0%(P=0.0189)。每周两次或三次以5mg/kg(P>0.99)或10mg/kg(P>0.999)的剂量给药,在肿瘤消退(补充图S4A)或生存益处(补充图S46)方面没有显著差异 基于这些初步结果,我们进行了一项更广泛的研究,测试了2.5F-Fc-MMAF与其单个成分(2.5F-Fc或接头修饰的MMAF)以及非结合性CTRL-Fc-MMAF对照的体内疗效,所有这些成分都以相同的给药频率和摩尔等量给药。如上所述,在nu/nu小鼠的侧腹接种U87MG细胞,并允许其建立6天,这次在开始治疗前平均肿瘤大小为47.5mm2。将小鼠分为五组(n=8-9):(i)未经治疗的对照组,(ii)2.5F-Fc-MMAF,(iii)CTRL-Fc-MMAF、(iv)2.5F-Fc(均以10mg/kg给药),或(v)接头修饰的MMAF(0.24mg/kg;对应于MMAF的摩尔当量)。每周两次通过腹腔注射给药化合物,共给药3周。治疗似乎耐受良好,任何治疗组均未观察到明显的体重减轻或不良事件(补充图S5)。2.5F-Fc-MMAF治疗再次出现明显的肿瘤消退;然而,我们假设,与初步实验相比,给药开始时较大的平均肿瘤大小(47.5mm2对35mm2)可能影响了反应的持久性。选择第15天进行统计比较,因为这是包括所有动物的研究的最后一天。在肿瘤接种后第15天,将治疗组的肿瘤大小与未治疗的对照组进行比较时,只有2.5F-Fc-MMAF给药导致生长显著下降(P<0.0001)。相比之下,单独服用2.5F-Fc或MMAF的组对肿瘤消退或生存益处没有显著影响,结果与未治疗的对照组相似(图5)。CTRL-Fc-MMAF对第15天肿瘤大小的影响不显著(P=0.7044)。与未治疗的对照组相比,在服用CTRL-Fc-MMAF的组中观察到对生存率的中度但无统计学意义的影响(P=0.0772)。MMAF的血清半衰期延长或Fc介导的细胞运输可能是由于其与CTRL-Fc融合蛋白的化学结合造成的。在其他研究中,与MMAF偶联的对照抗体也观察到了类似的中等效果。 |
| 酶活实验 |
竞争细胞结合试验[1]
为了测量结蛋白-Fc融合蛋白的相对结合亲和力,如前所述进行了竞争结合试验,并进行了一些修改。AlexaFluor 488偶联的EETI 2.5F(AF488-2.5F)被用作竞争对手,以比较2.5F-Fc、2.5F-Fc-MMAF和CTRL-Fc-MMAF的相对结合。简而言之,用细胞解离缓冲液分离4×104个细胞,用IBB(25 mmol/L TRIS,pH 7.4,150 mmol/L NaCl,2 mmol/L CaCl2,1 mmol/L MgCl2,1 mol/L MnCl2和0.1%BSA)洗涤,并在4°C下用2 nmol/L AF488-2.5F和不同浓度的结蛋白-Fc融合物在1 mL IBB中孵育2小时。如上所述,通过流式细胞术测定用1mL PBS/BSA洗涤两次后剩余的细胞结合荧光。调整后的荧光值是通过从样品的荧光信号几何平均值中减去阴性对照(仅细胞)的荧光信号的几何平均值来计算的。由此,结合百分比计算为每个样品的调整荧光除以每个细胞系的阳性对照的调整荧光×100。使用Prism通过非线性回归分析确定半最大抑制浓度(IC50)值。误差条表示三次实验的SD。 |
| 细胞实验 |
细胞增殖[1]
将细胞以每孔2000个细胞的密度接种在96孔板中,并在37°C、5%CO2的培养基中在上述每个细胞系中生长过夜。随后用100μL新鲜培养基处理细胞,该培养基含有不同浓度的结蛋白-Fc融合蛋白或接头修饰的MMAF,并在37°C、5%CO2下孵育5天。使用细胞计数试剂盒-8(CCK-8)通过向每个孔中加入等于培养体积10%的水溶性四唑盐WST-8来测量细胞增殖。在37°C下孵育1小时后,用Synergy H4微量滴定板读数器测量450 nm处的吸光度。细胞增殖以相对于未处理细胞对照的吸光度百分比表示。我们通过首先根据CCK-8+培养基(无细胞)的吸光度从每个孔中减去背景值来处理这些实验的数据。然后将最大增殖百分比报告为(样品-背景)/(对照-背景)×100。误差条表示三次实验的SD。 |
| 动物实验 |
Animal experiments
Animal procedures were carried out according to a protocol approved by the Stanford University Administrative Panels on Laboratory Animal Care (APLAC #22942). For tumor cell implantation, 6-week-old female nu/nu mice (Charles River Laboratory) were anesthetized with 2.5% isoflurane by inhalation with a flow rate of 1 L/minute. A volume of 100 μL of 50/50 PBS/Matrigel (Corning #356231), containing 5 × 106 U87MG cells, was injected subcutaneously into the flank. Tumors were allowed to grow for 6 days until reaching a size of approximately 30 to 50 mm2 in tumor area. At day 6 after inoculation, all mice were weighed and tumors measured. Mice were binned into experimental groups to ensure equivalent average tumor size and average weight across each group. All compounds tested were administered via intraperitoneal injection in 100 μL PBS, with dosing frequency and concentration dependent on therapeutic group as indicated. Tumors were measured three times weekly using digital calipers, and animal weight was recorded on each dosing day to monitor mice for weight loss as a measure of compound toxicity. Tumor area was calculated using area = x × y, where x is the longest axis of the tumor and y is the axis perpendicular. Euthanasia criteria were defined as 20% body weight loss or tumor size greater than 100 mm2 in area.
|
| 参考文献 | |
| 其他信息 |
Antibody-drug conjugates (ADC) have generated significant interest as targeted therapeutics for cancer treatment, demonstrating improved clinical efficacy and safety compared with systemic chemotherapy. To extend this concept to other tumor-targeting proteins, we conjugated the tubulin inhibitor monomethyl-auristatin-F (MMAF) to 2.5F-Fc, a fusion protein composed of a human Fc domain and a cystine knot (knottin) miniprotein engineered to bind with high affinity to tumor-associated integrin receptors. The broad expression of integrins (including αvβ3, αvβ5, and α5β1) on tumor cells and their vasculature makes 2.5F-Fc an attractive tumor-targeting protein for drug delivery. We show that 2.5F-Fc can be expressed by cell-free protein synthesis, during which a non-natural amino acid was introduced into the Fc domain and subsequently used for site-specific conjugation of MMAF through a noncleavable linker. The resulting knottin-Fc-drug conjugate (KFDC), termed 2.5F-Fc-MMAF, had approximately 2 drugs attached per KFDC. 2.5F-Fc-MMAF inhibited proliferation in human glioblastoma (U87MG), ovarian (A2780), and breast (MB-468) cancer cells to a greater extent than 2.5F-Fc or MMAF alone or added in combination. As a single agent, 2.5F-Fc-MMAF was effective at inducing regression and prolonged survival in U87MG tumor xenograft models when administered at 10 mg/kg two times per week. In comparison, tumors treated with 2.5F-Fc or MMAF were nonresponsive, and treatment with a nontargeted control, CTRL-Fc-MMAF, showed a modest but not significant therapeutic effect. These studies provide proof-of-concept for further development of KFDCs as alternatives to ADCs for tumor targeting and drug delivery applications.[1]
|
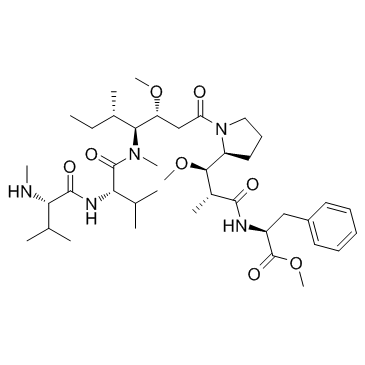
| 分子式 |
C40H67N5O8
|
|---|---|
| 分子量 |
746.000
|
| 精确质量 |
745.498
|
| 元素分析 |
C, 64.40; H, 9.05; N, 9.39; O, 17.16
|
| CAS号 |
863971-12-4
|
| 相关CAS号 |
MMAF;745017-94-1;MMAF hydrochloride;1415246-68-2
|
| PubChem CID |
57587881
|
| 外观&性状 |
Off-white to light yellow to be determined
|
| 密度 |
1.1±0.1 g/cm3
|
| 沸点 |
871.8±65.0 °C at 760 mmHg
|
| 闪点 |
481.0±34.3 °C
|
| 蒸汽压 |
0.0±0.3 mmHg at 25°C
|
| 折射率 |
1.513
|
| LogP |
4.66
|
| tPSA |
156
|
| 氢键供体(HBD)数目 |
3
|
| 氢键受体(HBA)数目 |
9
|
| 可旋转键数目(RBC) |
22
|
| 重原子数目 |
53
|
| 分子复杂度/Complexity |
1180
|
| 定义原子立体中心数目 |
9
|
| SMILES |
[C@@H]([C@@H]1CCCN1C(=O)C[C@@H](OC)[C@H]([C@@H](C)CC)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@@H](NC)C(C)C)(OC)[C@@H](C)C(=O)N[C@H](C(=O)OC)CC1C=CC=CC=1
|
| InChi Key |
WRVLBJXFSHALRZ-FUVGGWJZSA-N
|
| InChi Code |
InChI=1S/C40H67N5O8/c1-13-26(6)35(44(9)39(49)34(25(4)5)43-38(48)33(41-8)24(2)3)31(51-10)23-32(46)45-21-17-20-30(45)36(52-11)27(7)37(47)42-29(40(50)53-12)22-28-18-15-14-16-19-28/h14-16,18-19,24-27,29-31,33-36,41H,13,17,20-23H2,1-12H3,(H,42,47)(H,43,48)/t26-,27+,29-,30-,31+,33-,34-,35-,36+/m0/s1
|
| 化学名 |
Methyl ((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-N,3-dimethyl-2-((S)-3-methyl-2-(methylamino)butanamido)butanamido)-3-methoxy-5-methylheptanoyl)pyrrolidin-2-yl)-3-methoxy-2-methylpropanoyl)-L-phenylalaninate
|
| 别名 |
MMAFOMe; MMAF-OMe; 863971-12-4; methyl (2S)-2-[[(2R,3R)-3-methoxy-3-[(2S)-1-[(3R,4S,5S)-3-methoxy-5-methyl-4-[methyl-[(2S)-3-methyl-2-[[(2S)-3-methyl-2-(methylamino)butanoyl]amino]butanoyl]amino]heptanoyl]pyrrolidin-2-yl]-2-methylpropanoyl]amino]-3-phenylpropanoate; Monomethyl auristatin F methyl ester; SCHEMBL9921233; CHEMBL5180760; Monomethyl auristatin F methyl ester
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 该产品在溶液状态不稳定,请现配现用。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : ≥ 100 mg/mL (~134.05 mM)
|
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (3.35 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (3.35 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2.5 mg/mL (3.35 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 配方 4 中的溶解度: 10% DMSO+ 40% PEG300+ 5% Tween-80+ 45% saline: ≥ 2.5 mg/mL (3.35 mM) 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.3405 mL | 6.7024 mL | 13.4048 mL | |
| 5 mM | 0.2681 mL | 1.3405 mL | 2.6810 mL | |
| 10 mM | 0.1340 mL | 0.6702 mL | 1.3405 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
|
|
|
|
|