| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 体外研究 (In Vitro) |
体外活性:PF-477736 (128 nM) 在 CA46 和 HeLa 细胞中以剂量依赖性方式消除喜树碱诱导的 DNA 损伤检查点。 PF-477736 可有效消除吉西他滨诱导的 S 期停滞,并相应增加 HT29 细胞中的凋亡细胞群。 PF-477736 (540 nM) 在 HT29 细胞中以时间和剂量依赖性方式增强吉西他滨诱导的细胞毒性。在 MTT 测定中,PF-477736 增强了一组化疗药物对多种 p53 缺陷人类癌细胞系的生长抑制活性。向吉西他滨阻滞的细胞中添加 PF-477736 (360 nM) 会诱导 H2AX 磷酸化强度急剧增加,反映出 DNA 损伤位点附近有更多的 γ-H2AX 分子。 PF-477736 (0.5 nM) 在姜黄素存在的情况下选择性阻断 HL-60 细胞中的 p73 和 P53 磷酸化。 PF-477736 (360 nM) 抑制多西他赛诱导的组蛋白 H3 (Ser10) 和 Cdc25C (Ser216) 磷酸化,并增强 COLO205 细胞的凋亡。 PF-477736 (250 nM) 与 MK-1775 组合在 OVCAR-5 细胞中具有显着的协同细胞毒活性。 PF-477736 (250 nM) 与 MK-1775 结合会导致 OVCAR-5 细胞中 DNA 含量在 2N 至 4N 之间的细胞积累。 PF-477736 (250 nM) 与 MK-1775 结合会导致 DNA 复制结束前过早有丝分裂,受损的 DNA 会导致 OVCAR-5 细胞凋亡。激酶检测:检测在 96 孔板中于 30℃ 下进行 20 分钟,检测缓冲液含有 50 mM TRIS pH 7.5、0.4 M NaCl、4 mM PEP、0.15 mM NADH、28 单位乳酸脱氢酶/ mL、16 单位丙酮酸激酶/mL、3 mM DTT、0.125 mM Syntide-2、0.15 mM ATP 和 25 mM 氯化镁。使用 1 nM CHK1 激酶结构域启动测定。 CHK1 活性的抑制是通过测量不同浓度 PF-477736 存在下的初始速度来确定的。使用酶动力学和 Excel 软件对数据进行分析,并拟合竞争性抑制的动力学模型以获得 Ki 值。通过针对第 2 组约 100 种蛋白激酶筛选 1 μM 或 10 μM 的化合物来评估 PF-477736 的激酶选择性。细胞测定:IC50 测定测量 PF-477736 对 p53 缺陷型人类癌细胞系的抗增殖作用。将每行细胞以指数增长密度接种在 96 孔测定板的完全培养基中,并使其贴壁 16 小时。然后进行 PF-477736 的系列稀释,并将适当的对照添加到每个板中。将细胞与药物一起孵育 96 小时。孵育后,将用完全培养基稀释的MTT工作液添加至每孔中,并将细胞孵育4小时。离心并去除上清液后,将 DMSO 添加到每个孔中,并在 SpectraMax 读板器上在 540 nm 处读取板的读数。
|
||
|---|---|---|---|
| 体内研究 (In Vivo) |
PF-477736 (4 mg/kg iv) 在大鼠中的终末半衰期 (T1/2) 为 2.9 小时,AUC 为 5.72 μg×hr/mL,CLp 为 11.8 mL/min/kg。 PF-477736 剂量依赖性地增强 Colo205 异种移植小鼠模型中吉西他滨最大耐受剂量的抗肿瘤活性。 PF-477736 (12 mg/kg) 可诱导 Colo205 异种移植小鼠模型中组蛋白 H3 (Ser10) 和磷酸化组蛋白 H2AX 的磷酸化增加。 PF-477736 (15 mg/kg ip) 可增强 COLO205 和 MDA-MB-231 异种移植模型中多西紫杉醇诱导的肿瘤生长抑制和肿瘤生长延迟。 PF 477736(10 mg/kg,每日一次,腹膜内注射)与 MK-1775(30 mg/kg,每日两次,口服)联合使用,可对携带 OVCAR-5 异种移植物的小鼠产生更大的肿瘤生长抑制作用。
|
||
| 动物实验 |
|
||
| 参考文献 |
Mol Cancer Ther.2008 Aug;7(8):2394-404;Clin Cancer Res.2009 Jul 15;15(14):4630-40.
|
| 分子式 |
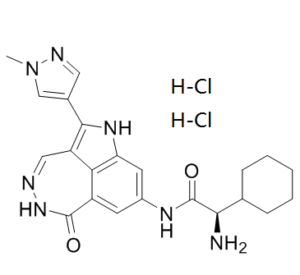
C22H27CL2N7O2
|
|
|---|---|---|
| 分子量 |
492.401481866837
|
|
| 精确质量 |
491.16
|
|
| CAS号 |
1247874-19-6
|
|
| 相关CAS号 |
1175132-90-7 (HCl);1071848-28-6 952238-93-6 (?HCl);1247874-19-6 (2HCl);952021-60-2;
|
|
| PubChem CID |
154731146
|
|
| 外观&性状 |
Typically exists as solid at room temperature
|
|
| tPSA |
130
|
|
| 氢键供体(HBD)数目 |
6
|
|
| 氢键受体(HBA)数目 |
5
|
|
| 可旋转键数目(RBC) |
4
|
|
| 重原子数目 |
33
|
|
| 分子复杂度/Complexity |
725
|
|
| 定义原子立体中心数目 |
1
|
|
| SMILES |
Cl.Cl.O=C([C@@H](C1CCCCC1)N)NC1C=C2C(NN=CC3=C(C4C=NN(C)C=4)NC(C=1)=C23)=O
|
|
| InChi Key |
RXRFKHCZZSOCOS-JQDLGSOUSA-N
|
|
| InChi Code |
InChI=1S/C22H25N7O2.2ClH/c1-29-11-13(9-25-29)20-16-10-24-28-21(30)15-7-14(8-17(27-20)18(15)16)26-22(31)19(23)12-5-3-2-4-6-12;;/h7-12,19,27H,2-6,23H2,1H3,(H,26,31)(H,28,30);2*1H/t19-;;/m1../s1
|
|
| 化学名 |
(2R)-2-amino-2-cyclohexyl-N-[2-(1-methylpyrazol-4-yl)-9-oxo-3,10,11-triazatricyclo[6.4.1.04,13]trideca-1,4,6,8(13),11-pentaen-6-yl]acetamide;dihydrochloride
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|---|
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.0309 mL | 10.1543 mL | 20.3087 mL | |
| 5 mM | 0.4062 mL | 2.0309 mL | 4.0617 mL | |
| 10 mM | 0.2031 mL | 1.0154 mL | 2.0309 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
 PF-00477736 abrogates the camptothecin-induced DNA damage checkpoint in a dose-dependent manner.Mol Cancer Ther.2008 Aug;7(8):2394-404. |
|---|
 PF-00477736 effectively abrogates the gemcitabine-induced S-phase arrest with a corresponding increase in apoptotic cell populations in the combination treatment compared with the gemcitabine treatment alone.Mol Cancer Ther.2008 Aug;7(8):2394-404. |
 A,PF-00477736 enhances gemcitabine-induced cytotoxicity in a time- and dose-dependent manner in HT29 cells as determined by cell survival assay. |
 A,PF-00477736 potentiates the antiproliferative effect of gemcitabine.B,in vitrocytotoxicity of PF-00477736 in selected cell lines with different DNA-damaging agents.Mol Cancer Ther.2008 Aug;7(8):2394-404. |
|---|
 A,in vitroeffects of gemcitabine ± PF-00477736 on the modulation of proteins involved in the G2DNA damage checkpoint pathway.B,gemcitabine + PF-00477736 combinationin vitroleads to increased DNA damage. |
 A,PF-00477736 potentiation of gemcitabine in human colon Colo205 xenograft model.B,summary of PF-00477736 potentiation of gemcitabine in human colon xenograft models.Mol Cancer Ther.2008 Aug;7(8):2394-404. |