| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
PFKFB3 (IC50 = 137 nM)
|
|---|---|
| 体外研究 (In Vitro) |
体外活性:PFK-158 是第一个在癌症患者中进行临床试验的 6-磷酸果糖-2-激酶/果糖-2,6-二磷酸酶 3 (PFKFB3) 抑制剂。 PFK-158 是一种小分子候选治疗药物,可灭活以前从未在人体临床试验中检测到的新型癌症代谢靶点。 PFK-158不仅是一流的抗癌药物,也是第一个通过抑制PFKFB3来靶向葡萄糖代谢的药物。 PFK-158 是重组 PFKFB3 的纳摩尔抑制剂。 PFK-158 抑制癌细胞中的 PFKFB3 活性和糖酵解。激酶测定:由于癌症中葡萄糖利用率升高支持多个水平的脂肪生成13,并考虑到它可能是化疗耐药性的另一个影响因素,因此检查了 PFK158 治疗是否可以调节脂质途径。结果显示,与化学敏感细胞相比,C13 和 HeyA8MDR 细胞具有更多的 LD(图 4 a 和 b),并且 PFK158 处理显着减少了这些细胞中 LD 的数量(图 4 c 和 d)。有趣的是,C13 和 HeyA8MDR 细胞中 PFKFB3 的基因下调(图 4 e 和 g)也导致 LD 减少。数据表明,与 OV2008 和 HeyA8 相比,PFK158 在体外与顺铂联合使用时,在 C13 和 HeyA8MDR 细胞中具有协同抗增殖作用(图 S3A-C 和 E-G,支持信息)。 PFK158 治疗可诱导脂肪自噬,并使化疗耐药细胞在体外和体内对化疗诱导的细胞毒性敏感。重要的是,该数据还表明,在耐药细胞中,用 BafA 抑制自噬比敏感细胞更能逆转 PFK158 诱导的对卡铂的化学敏感性。总之,这是首批研究之一,表明 PFK158(一种 PFKFB3 的特异性抑制剂)同时靶向糖酵解和脂肪生成途径(这两条途径在癌症中非常活跃),并促进脂肪自噬以抑制肿瘤生长。细胞分析:PFK-158不仅是一流的抗癌药物,而且是第一个通过抑制PFKFB3来靶向葡萄糖代谢的药物。 PFK-158 是重组 PFKFB3 的纳摩尔抑制剂。 PFK-158 抑制癌细胞中的 PFKFB3 活性和糖酵解。
|
| 体内研究 (In Vivo) |
PFK158 在大鼠和狗中具有良好的耐受性,从而产生可接受的临床前治疗指数。 PFK158 在多种人源性肿瘤临床前小鼠模型和同基因小鼠模型中非常有效。支持 IND 的安全性和毒性研究表明 PFK158 在大鼠和狗中具有良好的耐受性,并支持启动目前正在进行的 I 期试验。
PFK158单独在体内抑制肿瘤生长和腹水[1] 评估了PFK158单独使用和与CBPt联合使用对HeyA8MDR裸鼠原发性肿瘤生长和转移的疗效。联合治疗中观察到肿瘤生长明显减少(图6a-b)。尸检时,肿瘤重量(图6 c)、腹水量(图6 d)和Ki67染色(图6 e)显示,与所有其他治疗组相比,联合治疗在减少癌症进展方面更有效。对照组或任何药物治疗组均未观察到明显的体重减轻(数据未显示)。与这些数据一致,蛋白质印迹分析显示,联合治疗组中p-PFKFB3的表达降低,凋亡标志物切割胱天蛋白酶3的水平升高(图6f)。来自未处理对照组和治疗组的异种移植物冷冻切片的Bodipy(图6 g)和TUNEL染色(图6 h)的代表性图像显示,PFK158治疗在减少LDs方面更有效,而CBPt在抑制LDs方面几乎没有效果。同样,通过TUNEL染色评估,联合组的细胞死亡更多。这些数据表明PFK158加CBPt治疗在妇科癌症小鼠模型中导致显著增强的抗肿瘤活性 体内协同作用评估。[2] 首先,我们研究了PFK-158及其类似物或联合疗法在小鼠中的最大耐受剂量(MTD)(表S1)。结果表明,3PO、PFK-015和PFK-158的MTDs大于或等于75mg/kg,当ICR小鼠接受静脉注射(i.v.)时,分别为30mg/kg和60mg/kg。此外,MTD或联合疗法下的化合物对小鼠体重增加没有影响(图S2)。因此,选择15mg/kg(静脉注射)的剂量作为体内研究的安全剂量。监测小鼠存活率,直至感染后第3天。与类似物相比,PFK-158对全身感染小鼠的粘菌素显示出显著的协同作用(图4C和F)。在肺炎克雷伯菌H04感染小鼠模型中,粘菌素联合PFK-158治疗将存活率从10%(15mg/kg PFK-158或1.3mg/kg粘菌素单药治疗)提高到40%(15mg/kg PFD-158和1.3mg/kg联合治疗)。当使用粘菌素联合3PO治疗时,存活率也可以从10%提高到30%(图4A)。然而,粘菌素与PFK-015联合使用对该模型的存活率没有影响(图4B)。在HLCR阴沟肠杆菌D01感染小鼠模型中,当粘菌素与15mg/kg PFK-158治疗联合使用时,存活率从0%显著提高到60%。在阴沟肠杆菌D01感染模型中,粘菌素与3PO或PFK-015的联合使用将动物存活率略微提高到10%(图4C和D)。 |
| 酶活实验 |
研究了PFK-158治疗是否可以改变脂质途径,因为癌症中葡萄糖利用率的增加在多个水平上促进脂肪生成13,并且因为它可能是导致化疗耐药的另一个因素。结果显示,PFK158 处理显着减少了 C13 和 HeyA8MDR 细胞中 LD 的数量(图 4c 和 d),这些细胞的 LD 比化学敏感细胞多(图 4a 和 b)。有趣的是,当 PFKFB3 基因下调时,C13 和 HeyA8MDR 细胞中的 LD 降低(图 4e 和 g)。根据数据,与OV2008和HeyA8相比,PFK158和顺铂在体外对C13和HeyA8MDR细胞具有协同抗增殖作用(图S3A-C和EG,支持信息)。在体外和体内,PFK158 治疗会引起脂肪吞噬,并使化疗耐药细胞更容易受到化疗的细胞毒性作用。值得注意的是,结果还表明,与敏感细胞相比,更多的耐药细胞表现出 PFK158 诱导的对卡铂的化学敏感性,这可以通过用 BafA 阻断自噬来逆转。总而言之,这是首批研究之一,证明 PFK158(一种 PFKFB3 的特殊抑制剂)同时靶向脂肪生成和糖酵解途径(癌症中的两条高度活跃的途径),并促进脂肪自噬以阻止肿瘤生长。
2-[1-14C]-脱氧-d-葡萄糖摄取测定[1] 接种过夜的细胞用浓度逐渐增加的PFK-158(0-15μM)处理1小时,用PBS洗涤,置于无葡萄糖培养基中30分钟。加入2-[1-14C]-脱氧-d-葡萄糖(0.05μCi/mL),进一步孵育细胞1小时。用PBS洗涤后,在500μL 0.5%SDS中制备细胞裂解物,将400μL裂解物加入5 mL闪烁液中,在Tri-Carb 2910液体闪烁分析仪上测量计数。然后将计数归一化为Bradford测定法测量的蛋白质浓度,数据表示为未处理细胞的百分比对照。 抗菌药物和药敏试验。[1] 所有抗生素,包括粘菌素、多粘菌素B、替加环素、头孢他啶、头孢吡肟、氨曲南、美罗培南、阿米卡星、左氧氟沙星和呋喃妥因,都是商业购买的。制备抗生素的溶剂和稀释剂符合临床和实验室标准协会(CLSI)的指南。3PO、PFK-015和PFK158是商业购买的。根据CLSI指南,采用肉汤微量稀释法测定代表性抗生素的MIC。每个孔中的最终接种物约为5×105 CFU/ml。将微量滴定板在37°C下孵育18小时,用肉眼观察结果。实验在不同的日子里进行了三次。 组合效应的棋盘分析。[1] 通过肉汤微量稀释棋盘法筛选临床化合物库(n=688),以鉴定粘菌素的增效剂。我们研究了这些联合疗法对mcr-1阳性和mcr-1阴性粘菌素耐药肠杆菌科的抗菌活性。使用96孔圆底微量滴定板制备基于多粘菌素的组合,药物浓度连续稀释2倍。将两种药物在96孔板中混合,然后在阳离子调节的Mueller Hinton(CAMH)肉汤中加入终浓度为5×105 CFU/ml的标准细菌悬浮液。在37°C下孵育18小时后,也用肉眼观察结果。多粘菌素(PMB或CST)与PFK158或其类似物的联合作用是通过使用具有最高联合作用的浓度组合计算分数抑制浓度指数(FICI)来确定的:FICI=(联合用药中药物A的MIC/单独用药的MIC)+(联合用药时药物B的MIC/仅用药B的MIC)。当FICI≤0.5时,抗菌组合被定义为协同作用;0.5 根据Lu等人先前描述的方法,对大肠杆菌13-43、肺炎克雷伯菌H04和阴沟肠杆菌D01进行了时间杀伤曲线测定,并进行了小幅修改。简而言之,用3 ml CAMH肉汤将过夜培养的每种分离物的培养物稀释至终浓度约为106 CFU/ml。接下来,使用粘菌素(2 μg/ml)和PFK158(在与粘菌素结合时可以显示协同作用的最低浓度下)单独或组合添加。在37°C下孵育后0、1、3、5、7、9和24小时,通过将10μl连续稀释的样品一式三份铺在LB琼脂平板上,测定活细胞计数。结果记录为log10 CFU/ml。如果细菌杀灭率比最有效的单一疗法高2 log10单位,则粘菌素和PFK158的组合被认为是协同作用的。 扫描电子显微镜和透射电子显微镜。[1] SEM和TEM用于检查粘菌素-PFK-158组合对HLCR分离株E.cloacae D01细胞形态的影响。对数相培养物用2μg/ml粘菌素处理,4μg/mlPFK158,或两者同时在CAMH肉汤中培养4小时,如上所述用于时间杀伤研究。对于SEM和TEM研究,将样品转移到15ml聚丙烯管中,在6000×g下离心3分钟。丢弃上清液,重新悬浮细菌颗粒,并在1ml 2.5%戊二醛磷酸盐缓冲盐水(PBS)中洗涤。将试管在4°C下固定过夜。固定后,将试管再次在6000×g下离心3分钟,取出固定剂,最后将细菌颗粒重新悬浮在1 ml PBS。使用扫描电子显微镜进行SEM,使用透射电子显微镜进行TEM。 |
| 细胞实验 |
细胞系:OV2008 和 C13 细胞
浓度:10 µM 孵育时间:24 小时 结果:与卡铂 (CBPt) 联合治疗导致细胞凋亡显着增加。 细胞活力和药物组合测定[1] 将细胞接种在96孔板中,用浓度递增的药物处理48小时,如前所述,通过MTT法测定抑制浓度50%(IC50)值。19为了确定PFK-158是否与顺铂和卡铂协同作用,使用Chou-Talalay方法进行了恒比协同研究20,并使用CalcuSyn软件 计算了组合指数(CI)和剂量减少指数(DRI)。为了确定自噬在PFK-158介导的化疗耐药细胞致敏中的作用,将细胞用50 nM巴非霉素A(BafA)预处理2小时,然后用越来越高浓度的卡铂(CBPt)和PFK-158进一步处理。24小时后,通过MTT评估细胞存活率。 细胞凋亡测定[1] 简而言之,用PFK158、CBPt、紫杉醇(PTX)单独或联合处理细胞(1×106),并用FITC-Annexin V和PI(5μg/mL)对细胞进行双重染色,分析磷脂酰丝氨酸外化。如前所述,通过CellQuest Pro软件 采集和分析细胞。 使用2-NBDG进行细胞成像[1] 如前所述,使用2-NBDG测量活细胞的葡萄糖摄取。22简而言之,细胞在无葡萄糖培养基中用5μMPPFK158和2-NBDG处理30分钟,然后在蔡司-LSM 510荧光显微镜下检查。如前所述,使用Image J软件计算荧光强度。 |
| 动物实验 |
Female athymic nude mice (nu/nu) (5-6 weeks old) injected with HeyA8MDR cells[1]
15 mg/kg Intraperitoneal injection; once a week; for 4 weeks Female athymic nude mice (nu/nu) (5–6 weeks old) were randomized in six groups (n = 10) and HeyA8MDR cells (3 × 106) were injected intraperitoneally (i.p). Seven days after i.p., mice were treated with (i) PBS for control group, (ii) 25 mg/kg of PFK158 every 3rd day, (iii) 51 mg/kg of CBPt every 3rd day, (iv) PTX (15 mg/kg) every 5th day, (v) combination of CBPt (51 mg/kg) and PFK-158 (15 mg/kg) once a week, and (vi) PTX (5 mg/kg) and PFK-158 (25 mg/kg) once a week. The treatments were continued until the end of the study (28 days), however, control mice were sacrificed during week 3 as the tumor burden exceeded 10% of their body weight. Tumors and tissues were excised and preserved either in formalin or −80 °C. [1] All compounds were prepared in 5% ethanol, 5% Cremophor, and 90% D5W (5% dextrose in water). The safety study was conducted with female ICR mice. Mice were intravenously injected with a solvent, 75 mg/kg 3PO, 30 mg/kg PFK-015, or 60 mg/kg PFK158 (n = 8 per group). The body weight changes of the mice were monitored for a week postinjection. Female ICR mice (body weights of 18 to 20 g) were also used for the mouse systemic infection model. Mice were infected intraperitoneally with a 0.5-ml K. pneumoniae H04 or E. cloacae D01 bacterial suspension (100% minimum lethal dose) in 5% mucin. After 1 h of infection, colistin (1 mg/kg for K. pneumoniae H04 infection and 1.3 mg/kg for E. cloacae D01 infection), 3PO, PFK-015, or PFK158 (15 mg/kg), singly or in combination, was injected intravenously into the mice (n = 10 per group). A group of mice was treated with the same solvent as a control group. The experiments were performed in triplicate on different days. A log rank test was applied to compare the survival distributions of different samples.[2] |
| 参考文献 | |
| 其他信息 |
PFK-158 is a small molecule drug with a maximum clinical trial phase of I and has 1 investigational indication.
Metabolic alterations are increasingly recognized as important novel anti-cancer targets. Among several regulators of metabolic alterations, fructose 2,6 bisphosphate (F2,6BP) is a critical glycolytic regulator. Inhibition of the active form of PFKFB3ser461 using a novel inhibitor, PFK158 resulted in reduced glucose uptake, ATP production, lactate release as well as induction of apoptosis in gynecologic cancer cells. Moreover, we found that PFK158 synergizes with carboplatin (CBPt) and paclitaxel (PTX) in the chemoresistant cell lines, C13 and HeyA8MDR but not in their chemosensitive counterparts, OV2008 and HeyA8, respectively. We determined that PFK158-induced autophagic flux leads to lipophagy resulting in the downregulation of cPLA2, a lipid droplet (LD) associated protein. Immunofluorescence and co-immunoprecipitation revealed colocalization of p62/SQSTM1 with cPLA2 in HeyA8MDR cells uncovering a novel pathway for the breakdown of LDs promoted by PFK158. Interestingly, treating the cells with the autophagic inhibitor bafilomycin A reversed the PFK158-mediated synergy and lipophagy in chemoresistant cells. Finally, in a highly metastatic PTX-resistant in vivo ovarian mouse model, a combination of PFK158 with CBPt significantly reduced tumor weight and ascites and reduced LDs in tumor tissue as seen by immunofluorescence and transmission electron microscopy compared to untreated mice. Since the majority of cancer patients will eventually recur and develop chemoresistance, our results suggest that PFK158 in combination with standard chemotherapy may have a direct clinical role in the treatment of recurrent cancer.[1] In conclusion, this is one of the first studies to show that PFK158, a specific inhibitor of PFKFB3, simultaneously targets both the glycolytic and lipogenic pathways, two pathways that are very active in cancer, and promotes lipophagy to inhibit tumor growth. Since resistance to chemotherapy is a major impediment in prolonging survival cancer patients, it is imperative to identify therapeutic strategies to overcome chemoresistance. Toward this aim, the synergy that we observed between PFK158 and carboplatin in chemoresistant cells has tremendous clinical relevance as it could represent a novel therapeutic option for patients with recurrent chemoresistant disease.[1] As increasing numbers of colistin-resistant bacteria emerge, new therapies are urgently needed to treat infections caused by these pathogens. The discovery of new combination therapies is one important way to solve such problems. Here, we report that the antitumor drug PFK-158 and its analogs PFK-015 and 3PO can exert synergistic effects with colistin against colistin-resistant Enterobacteriaceae, including mcr-1-positive or high-level-colistin-resistant (HLCR) isolates, as shown by a checkerboard assay. The results of a time-kill assay revealed that colistin combined with PFK-158 continuously eliminated colistin-resistant Escherichia coli 13-43, Klebsiella pneumoniae H04, and Enterobacter cloacae D01 in 24 h. Images from scanning electron microscopy (SEM) at 5 h postinoculation confirmed the killing effect of the combination. Finally, in vivo treatment showed that PFK-158 had a better synergistic effect than its analogs. Compared to the corresponding rates after colistin monotherapy, the survival rates of systemically infected mice were significantly increased 30% or 60% when the mice received an intravenous injection of colistin in combination with 15 mg/kg of body weight PFK-158. These results have important implications for repurposing PFK-158 to combat colistin resistance.[2] In conclusion, one new class of potentiators of colistin was evaluated both in vitro and in vivo. PFK-158 not only decreased the MICs of colistin to eradicate both colistin-susceptible and colistin-resistant (mcr-1 or HLCR) Enterobacteriaceae in vitro but also enhanced the efficacy of colistin in vivo. This finding might shed light on the discovery of combination therapies for infections caused by colistin-resistant pathogens.[2] |
| 分子式 |
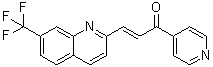
C18H11F3N2O
|
|
|---|---|---|
| 分子量 |
328.08
|
|
| 精确质量 |
328.082
|
|
| 元素分析 |
C, 65.85; H, 3.38; F, 17.36; N, 8.53; O, 4.87
|
|
| CAS号 |
1462249-75-7
|
|
| 相关CAS号 |
|
|
| PubChem CID |
71730058
|
|
| 外观&性状 |
White to light yellow solid powder
|
|
| 密度 |
1.3±0.1 g/cm3
|
|
| 沸点 |
466.3±45.0 °C at 760 mmHg
|
|
| 闪点 |
235.8±28.7 °C
|
|
| 蒸汽压 |
0.0±1.2 mmHg at 25°C
|
|
| 折射率 |
1.624
|
|
| LogP |
3.55
|
|
| tPSA |
42.8
|
|
| 氢键供体(HBD)数目 |
0
|
|
| 氢键受体(HBA)数目 |
6
|
|
| 可旋转键数目(RBC) |
3
|
|
| 重原子数目 |
24
|
|
| 分子复杂度/Complexity |
471
|
|
| 定义原子立体中心数目 |
0
|
|
| SMILES |
FC(C1C([H])=C([H])C2C([H])=C([H])C(/C(/[H])=C(\[H])/C(C3C([H])=C([H])N=C([H])C=3[H])=O)=NC=2C=1[H])(F)F
|
|
| InChi Key |
IAJOMYABKVAZCN-AATRIKPKSA-N
|
|
| InChi Code |
InChI=1S/C18H11F3N2O/c19-18(20,21)14-3-1-12-2-4-15(23-16(12)11-14)5-6-17(24)13-7-9-22-10-8-13/h1-11H/b6-5+
|
|
| 化学名 |
(E)-1-pyridin-4-yl-3-[7-(trifluoromethyl)quinolin-2-yl]prop-2-en-1-one
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: 2 mg/mL (6.09 mM) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 悬浮液;超声助溶。
例如,若需制备1 mL的工作液,可将100 μL 20.0 mg/mL澄清DMSO储备液加入400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: 2 mg/mL (6.09 mM) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 悬浊液; 超声助溶。 例如,若需制备1 mL的工作液,可将 100 μL 20.0mg/mL澄清的DMSO储备液加入到900μL 20%SBE-β-CD生理盐水中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 2 mg/mL (6.09 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 3.0480 mL | 15.2402 mL | 30.4804 mL | |
| 5 mM | 0.6096 mL | 3.0480 mL | 6.0961 mL | |
| 10 mM | 0.3048 mL | 1.5240 mL | 3.0480 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
|
|
|