| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 1mg |
|
||
| 2mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| Other Sizes |
|
| 靶点 |
LXR[1]
|
|---|---|
| 体外研究 (In Vitro) |
肿瘤免疫治疗仅限于免疫抑制肿瘤微环境引起的免疫抵抗。焦亡参与抗肿瘤免疫治疗作为一种新的方案,有望逆转免疫抑制。本文报道了酸性肿瘤微环境(TME)诱发的MRC纳米颗粒(MRC NPs)共同递送免疫激动剂RGX-104和光敏剂氯e6 (Ce6)用于焦热介导的免疫治疗。RGX-104通过转录激活ApoE来重塑TME,从而降低髓源性抑制细胞(MDSCs)的活性,这为强化焦亡埋下了伏笔。考虑到ce6触发的光动力疗法(PDT)可以增强氧化应激和细胞器破坏以增加免疫原性,免疫调节光动力MRC纳米药物将实施上述双管齐下的策略来增强气凝胶蛋白E (GSDME)依赖性焦亡。引入细胞水平MRC的RNA-seq分析,首次阐明作用于LXR/ApoE轴的RGX-104与焦亡之间的密切关系,其中RGX-104为焦亡参与抗肿瘤治疗提供了前提条件。简而言之,MRC具有良好的生物相容性,解决了疏水药物递送的障碍,成为一种强大的焦亡诱导剂,增强免疫功效。mrc诱导的焦亡联合抗pd -1阻断治疗可增强实体瘤的免疫应答,成功阻止侵袭性转移,并基于显著的抗肿瘤免疫延长生存期。MRC可能为免疫光热亡刺激剂增加基于热亡的免疫治疗开启一个新的窗口。[2]Adv Healthc Mater . 2022 Nov;11(21):e2201233.
|
| 体内研究 (In Vivo) |
当给患有可见肿瘤的小鼠口服 RGX-104(每天 100 毫克/公斤)时,可以有效抑制多种癌症类型的生长。 RGX-104 和抗 PD-1 的组合被发现比单独使用任何一种药物更有效。值得注意的是,在抗 PD-1 治疗的基础上接受 RGX-104 治疗的小鼠具有良好的耐受性,并且没有表现出明显的损伤 [1]。
|
| 细胞实验 |
MDSC体外增殖试验[1]
骨髓源性抑制细胞如前所述从荷瘤小鼠脾组织中分离。10万个细胞在聚l -赖氨酸包被板上四次镀。以1uM Abequolixron (RGX-104)或DMSO为载体处理3小时后,用4% PFA固定细胞15分钟,染色前用1X PBS洗涤3次。兔单克隆抗ki67抗体(1:400稀释)在4℃下过夜。细胞用Alexa Fluor 488二抗(1:200稀释,Invitrogen)在室温下孵育1小时,用DAPI反染(1:100稀释),用延长金贴载。为了分析Ki67阳性细胞的百分比,使用蔡司Axio Imager荧光显微镜在20倍放大下对每个重复的5个视野进行成像。使用CellProfiler软件进行图像分析。 MDSC黏附试验[1] 骨髓来源的抑制细胞从荷瘤小鼠脾组织中分离出来。10万个细胞分三次镀在聚l -赖氨酸包被板上。细胞用1uM Abequolixron (RGX-104)或DMSO作为载体处理2小时,以300 rpm振荡30分钟。之后,用4% PFA固定细胞15分钟,用1X PBS洗涤3次,用DAPI反染,用延长金贴壁。为了进行分析,使用蔡司Axio Imager荧光显微镜对每个重复的10个视场进行20倍放大成像。使用CellProfiler软件确定剩余细胞的数量。 体外MDSC细胞凋亡测定[1] 从WT、LXRαβ−/−、ApoE−/−或LRP8−/−小鼠中分离小鼠脾脏,匀浆形成单细胞悬液。细胞用1X ACK裂解缓冲液裂解并清除红细胞。使用髓源性抑制细胞分离试剂盒从细胞悬浮液中分离MDSCs。将分离的MDSCs涂于载玻片上,按指定浓度和时间用Abequolixron (RGX-104)或小鼠重组ApoE处理。然后用Cleaved Caspase-3抗体对样品进行染色。 将骨髓细胞与 B16F10 黑色素瘤细胞和 GM-CSF 一起培养 6 天。第 3 天,将 RGX-104 (2 μM) 添加到培养物中。第 6 天通过流式细胞术评估每 50 mL 培养液中 Gr-1high CD11b+ 细胞的平均数量[1]。 |
| 动物实验 |
Animal/Disease Models: NOD SCID or RAG mice injected with 1×106 SKOV3 ovarian cancer cells[1].
Doses: 100 mg/kg. Route of Administration: Oral administration daily for about 60 days. Experimental Results: Robustly suppressed tumor growth and progression. Mice[1] B16F10 cancer cells are subcutaneously injected into C57BL/6 mice. Following tumor growth to 5-10 mm3 in volume, mice are fed either control chow, chow supplemented with GW3965 (100 mg/kg), or chow supplemented with RGX-104 (100 mg/kg)[1]. RGX-104 was administered either through formulated drug chow at 100mg/kg/day or 50mg/kg/day or delivered via intraperitoneal injection (80mg/kg/day) in a vehicle suspension consisting of corn oil and ethanol (2.5% by volume) as indicated in each figure. Control cohorts were treated with either normal chow (Purina 5001) or with vehicle consisting of corn oil and ethanol (2.5% by volume), respectively. Tumor measurements were taken on the days indicted throughout the course of the experiment with calipers. For survival analysis, mice were euthanized when total tumor burden approached IACUC guidelines with a tumor burden exceeding 1,500 mm3 in volume. For the relevant experiments, anti-PD-1 mAb (clone RMP1-14) or a control isotype-matched antibody was administered at 10mg/kg intraperitoneally on days 3, 6, and 9 post-tumor injection. Gvax was generated as previously described and administered at high frequency (every 3 days) during the experiments as indicated.[1] |
| 参考文献 | |
| 其他信息 |
Abequolixron is an orally bioavailable agonist of the nuclear receptor liver X receptor beta (LXRbeta; NR1H2; LXR-b), with potential immunomodulating and antineoplastic activities. Upon oral administration, abequolixron selectively targets and binds to LXRbeta, thereby activating LXRbeta-mediated signaling, leading to the transcription of certain tumor suppressor genes and the downregulation of certain tumor promoter genes. This particularly activates the expression of apolipoprotein E (ApoE), a tumor suppressor protein, in tumor cells and certain immune cells. This activates the innate immune system, resulting in depletion of immunosuppressive myeloid-derived suppressor cells (MDSCs), tumor cells and endothelial cells in the tumor microenvironment. This reverses immune evasion, enhances anti-tumor immune responses and inhibits proliferation of tumor cells. LXRbeta, a member of the oxysterol receptor family, which is in the nuclear receptor family of transcription factors, plays a key role in cholesterol transport, glucose metabolism and the modulation of inflammatory responses; activation of LXRbeta suppresses tumor cell invasion, angiogenesis, tumor progression, and metastasis in a variety of tumor cell types. The expression of the ApoE protein becomes silenced in human cancers as they grow, become invasive, and metastasize; ApoE silencing is related to reduced survival in cancer patients. The LXR-ApoE pathway regulates the ability of cancers to evade the immune system and recruit blood vessels.
|
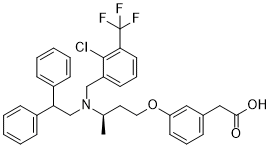
| 分子式 |
C34H33CLF3NO3
|
|
|---|---|---|
| 分子量 |
596.078939199448
|
|
| 精确质量 |
595.21
|
|
| 元素分析 |
C, 68.51; H, 5.58; Cl, 5.95; F, 9.56; N, 2.35; O, 8.05
|
|
| CAS号 |
610318-54-2
|
|
| 相关CAS号 |
RGX-104 hydrochloride;610318-03-1
|
|
| PubChem CID |
10218693
|
|
| 外观&性状 |
White to off-white solid powder
|
|
| LogP |
6.3
|
|
| tPSA |
49.8Ų
|
|
| 氢键供体(HBD)数目 |
1
|
|
| 氢键受体(HBA)数目 |
7
|
|
| 可旋转键数目(RBC) |
13
|
|
| 重原子数目 |
42
|
|
| 分子复杂度/Complexity |
783
|
|
| 定义原子立体中心数目 |
1
|
|
| SMILES |
C[C@H](CCOC1=CC=CC(=C1)CC(=O)O)N(CC2=C(C(=CC=C2)C(F)(F)F)Cl)CC(C3=CC=CC=C3)C4=CC=CC=C4
|
|
| InChi Key |
ZLJZDYOBXVOTSA-XMMPIXPASA-N
|
|
| InChi Code |
InChI=1S/C34H33ClF3NO3/c1-24(18-19-42-29-16-8-10-25(20-29)21-32(40)41)39(22-28-15-9-17-31(33(28)35)34(36,37)38)23-30(26-11-4-2-5-12-26)27-13-6-3-7-14-27/h2-17,20,24,30H,18-19,21-23H2,1H3,(H,40,41)/t24-/m1/s1
|
|
| 化学名 |
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 本产品在运输和储存过程中需避光。 |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.17 mg/mL (3.64 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 21.7 mg/mL澄清DMSO储备液加入400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: 2.08 mg/mL (3.49 mM) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 悬浊液; 超声助溶。 例如,若需制备1 mL的工作液,可将 100 μL 20.8 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: ≥ 0.83 mg/mL (1.39 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.6776 mL | 8.3881 mL | 16.7763 mL | |
| 5 mM | 0.3355 mL | 1.6776 mL | 3.3553 mL | |
| 10 mM | 0.1678 mL | 0.8388 mL | 1.6776 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
LXR Agonist Treatment Robustly Suppresses Tumor Growth and Progression across a Broad Set of Mouse and Human Tumors.Cell.2018 Feb 8;172(4):825-840.e18. |
|---|
 LXR Agonism Reduces Tumor-Infiltrating and Systemic Myeloid-Derived Suppressor Cells.Cell.2018 Feb 8;172(4):825-840.e18. |
|