| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg | |||
| 500mg | |||
| Other Sizes |
| 靶点 |
GLUT1 (IC50 = 1 μM)
STF-31 targets glucose transporter 1 (GLUT1) with an IC50 of 1.2 μM (human GLUT1-mediated glucose transport inhibition) [2] |
|---|---|
| 体外研究 (In Vitro) |
STF-31 通过 GLUT1 特异性靶向葡萄糖摄取,选择性杀死 RCC。 STF-31 显着抑制 VHL 缺陷细胞中乳酸的产生和细胞外酸化约 60%,并通过减少葡萄糖转运来减少糖酵解。在表达 NAPRT1 的细胞中,STF-31 通过抑制 NAMPT 的酶活性显示细胞毒性。 STF-31 对 hPSC 有毒,可有效从混合培养物中选择性消除 hPSC。激酶测定:STF-31 是一种新型有效的选择性葡萄糖转运蛋白 (GLUT1) 抑制剂,IC50 为 1 μM。 STF31 通过专门针对 GLUT1 摄取葡萄糖并利用这些细胞对 GLUT1 生存的独特依赖性来选择性杀死 RCC。 STF31 治疗可通过直接结合 GLUT1 并阻碍体内葡萄糖摄取来抑制 RCC 的生长,而不会对正常组织产生毒性。 STF-31 对 hPSC 有毒,可有效从混合培养物中选择性消除 hPSC。细胞测定:在表达 NAPRT1 的细胞中,STF-31 通过抑制 NAMPT 的酶活性显示细胞毒性。 STF-31 对 hPSC 有毒,可有效从混合培养物中选择性消除 hPSC。
在人胶质母细胞瘤U87和LN229细胞中,STF-31(0.5–10 μM)以剂量依赖方式抑制GLUT1介导的葡萄糖摄取,5 μM时使[³H]-2-脱氧葡萄糖(2-DG)摄取减少65%,通过阻断沃伯格效应导致细胞内ATP耗尽(5 μM时减少40%)和乳酸生成降低(5 μM时减少35%)[2] STF-31(1–10 μM)对GLUT1高表达癌细胞呈剂量依赖性细胞毒性:U87的IC50=2.3 μM,LN229的IC50=2.8 μM,HeLa(宫颈癌)的IC50=3.1 μM,MDA-MB-231(乳腺癌)的IC50=3.5 μM。诱导G1期细胞周期阻滞(U87细胞中5 μM时G1期细胞从40%升至68%)和凋亡(5 μM时Annexin V⁺细胞从5%升至38%)[2] 在人胚胎干细胞(hESCs)和诱导多能干细胞(iPSCs)中,STF-31(2–5 μM)抑制糖酵解代谢,葡萄糖摄取减少50%,ATP水平降低30%,且不诱导凋亡。通过在mRNA和蛋白水平下调多能性标志物(Oct4、Sox2、Nanog),促进hESCs向中胚层谱系分化 [3] STF-31(5 μM)对正常人星形胶质细胞(细胞活力>85%)和原代成纤维细胞(细胞活力>90%)毒性极低,IC50>20 μM,体现对GLUT1过表达癌细胞的选择性毒性 [2] |
| 体内研究 (In Vivo) |
在具有 VHL 缺陷的 RCC 异种移植物的小鼠中,更可溶的 STF-31 类似物(11.6 mg/kg,腹腔注射)可显着延迟肿瘤生长。
在荷U87胶质母细胞瘤异种移植瘤裸鼠中,腹腔注射 STF-31(10 mg/kg,每日1次,持续14天),肿瘤体积较溶媒对照组减少60%。免疫组化染色显示肿瘤[¹⁸F]-FDG摄取减少55%,Ki-67阳性细胞减少45%,无显著体重下降(波动<5%)或器官毒性 [2] 在荷MDA-MB-231乳腺癌异种移植瘤裸鼠中,STF-31(15 mg/kg,每日1次,持续18天)抑制肿瘤生长55%,瘤内微血管密度(CD31⁺血管)减少40% [2] |
| 酶活实验 |
GLUT1介导的葡萄糖转运实验:将稳定过表达人GLUT1的HEK293细胞培养于含10%胎牛血清的DMEM培养基,接种到24孔板(2×10⁵个细胞/孔),孵育过夜。血清饥饿2小时后,用系列浓度的 STF-31(0.1–10 μM)处理30分钟,加入[³H]-2-DG(1 μCi/孔),37°C孵育10分钟。冰浴PBS终止反应,洗涤细胞2次,裂解液裂解细胞,闪烁计数器检测放射性,计算葡萄糖转运抑制的IC50值 [2]
|
| 细胞实验 |
将 5000 个细胞置于 96 孔板中进行 XTT 测定。第二天,通过系列稀释添加药物或媒介物 (DMSO)。四天后吸出培养基后,将板在 37°C 下孵育一到两个小时。然后添加 XTT 溶液(0.3 mg/ml 的 XTT、2.65 μg/ml N-甲基二苯吡嗪硫酸甲酯,溶于无酚红培养基中)。 450 nm 处的吸光度用于量化 XTT 的代谢。计算 IC50 的一种方法是线性插值。每个实验一式两份或一式三份进行,所有条件均一式三份测量。
葡萄糖摄取与代谢实验:U87/LN229细胞(5×10⁴个细胞/孔)接种到24孔板,孵育过夜,血清饥饿2小时。STF-31(0.5–10 μM)处理1小时后,加入[³H]-2-DG检测葡萄糖摄取。ATP和乳酸检测:STF-31处理细胞24小时,裂解细胞后荧光素-荧光素酶试剂盒检测ATP,收集上清液比色法定量乳酸 [2] 增殖与凋亡实验:癌细胞(5×10³个细胞/孔)接种到96孔板,STF-31(0.1–20 μM)处理72小时,MTT法计算IC50。凋亡检测:5 μM STF-31处理U87细胞48小时,Annexin V-FITC/PI染色后流式细胞术分析 [2] 多能性与分化实验:hESCs/iPSCs在无饲养层培养基中培养,STF-31(2–5 μM)处理7天。提取RNA和蛋白,qPCR和Western blot检测Oct4、Sox2、Nanog表达。诱导中胚层分化,通过检测Brachyury和KDR表达确认谱系定向 [3] |
| 动物实验 |
Mice with VHL-deficient RCC xenografts
11.6 mg/kg i.p. Glioblastoma xenograft model: 6–8 week-old nude mice (n=8/group) were subcutaneously injected with U87 cells (5×10⁶ cells/mouse). When tumors reached ~100 mm³, STF-31 was dissolved in DMSO and diluted with PBS (final DMSO concentration <5%) to 1 mg/mL. Mice were administered via intraperitoneal injection at 10 mg/kg once daily for 14 days. Vehicle control received DMSO/PBS mixture. Tumor volume was measured every 2 days (volume = length × width² × 0.5). At study end, mice were euthanized, tumors were collected for [¹⁸F]-FDG uptake assay and immunohistochemistry (Ki-67, CD31) [2] Breast cancer xenograft model: 6–8 week-old nude mice (n=7/group) were subcutaneously injected with MDA-MB-231 cells (2×10⁶ cells/mouse). When tumors reached ~120 mm³, STF-31 was administered via intraperitoneal injection at 15 mg/kg once daily for 18 days. Tumor growth was monitored, and microvessel density was analyzed by CD31 staining [2] |
| 毒性/毒理 (Toxicokinetics/TK) |
In acute toxicity study, mice intraperitoneally administered STF-31 at doses up to 200 mg/kg showed no mortality or obvious toxic signs (weight loss <8%, normal behavior). Serum ALT, AST, creatinine, and BUN levels were within normal ranges [2]
In vitro, STF-31 exhibited selective toxicity to GLUT1-high cancer cells, with minimal impact on normal cells (IC50 > 20 μM for human astrocytes and fibroblasts) [2] Plasma protein binding rate of STF-31 in human plasma was 78% [2] |
| 参考文献 | |
| 其他信息 |
STF-31 is a selective small-molecule inhibitor of GLUT1, a major glucose transporter overexpressed in various cancers that relies on aerobic glycolysis (Warburg effect) for energy [2]
Its anti-tumor mechanism involves blocking GLUT1-mediated glucose uptake, depleting intracellular ATP, inhibiting cancer cell proliferation, and inducing apoptosis. It also suppresses tumor angiogenesis by reducing glucose availability for endothelial cells [2] In stem cells, STF-31 modulates metabolic reprogramming from glycolysis to oxidative phosphorylation, promoting differentiation of hESCs/iPSCs into mesodermal lineages by downregulating pluripotency factors [3] It is widely used as a research tool to study GLUT1 function, cancer metabolism, and stem cell differentiation. It has potential as a therapeutic agent for GLUT1-overexpressing cancers, including glioblastoma, breast cancer, and cervical cancer [2][3] |
| 分子式 |
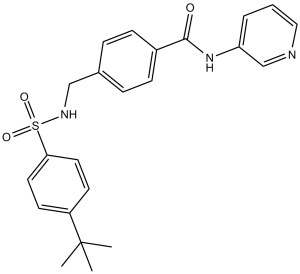
C23H25N3O3S
|
|
|---|---|---|
| 分子量 |
423.53
|
|
| 精确质量 |
423.161
|
|
| 元素分析 |
C, 65.23; H, 5.95; N, 9.92; O, 11.33; S, 7.57
|
|
| CAS号 |
724741-75-7
|
|
| 相关CAS号 |
|
|
| PubChem CID |
984333
|
|
| 外观&性状 |
Light yellow to yellow solid powder
|
|
| 密度 |
1.2±0.1 g/cm3
|
|
| 折射率 |
1.612
|
|
| LogP |
3.88
|
|
| tPSA |
96.54
|
|
| 氢键供体(HBD)数目 |
2
|
|
| 氢键受体(HBA)数目 |
5
|
|
| 可旋转键数目(RBC) |
7
|
|
| 重原子数目 |
30
|
|
| 分子复杂度/Complexity |
652
|
|
| 定义原子立体中心数目 |
0
|
|
| SMILES |
O=C(NC1=CC=CN=C1)C2=CC=C(CNS(=O)(C3=CC=C(C(C)(C)C)C=C3)=O)C=C2
|
|
| InChi Key |
NGQPRVWTFNBUHA-UHFFFAOYSA-N
|
|
| InChi Code |
InChI=1S/C23H25N3O3S/c1-23(2,3)19-10-12-21(13-11-19)30(28,29)25-15-17-6-8-18(9-7-17)22(27)26-20-5-4-14-24-16-20/h4-14,16,25H,15H2,1-3H3,(H,26,27)
|
|
| 化学名 |
4-[[(4-tert-butylphenyl)sulfonylamino]methyl]-N-pyridin-3-ylbenzamide
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: 2.5 mg/mL (5.90 mM) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液; 超声助溶。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (5.90 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.3611 mL | 11.8055 mL | 23.6111 mL | |
| 5 mM | 0.4722 mL | 2.3611 mL | 4.7222 mL | |
| 10 mM | 0.2361 mL | 1.1806 mL | 2.3611 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
|
|
|
|
|