| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 2mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
PI3Kγ (IC50 = 9 nM); PI3Kα (IC50 = 39 nM); PI3Kδ (IC50 = 43 nM); PI3Kβ (IC50 = 113 nM); DNA-PK (IC50 = 150 nM)
|
|---|---|
| 体外研究 (In Vitro) |
PI3K-IN-1 (25 μM) 阻断 PI3K/Akt 信号通路。由于 -SMA、Col-1 和 Timp-1 的表达相对较低,TGF-1 诱导的肌成纤维细胞转化也受到 PI3K 抑制剂 PI3K-IN-1 的抑制。
|
| 体内研究 (In Vivo) |
在小鼠模型中,XL765 (30 mg/kg) 和氯喹 (50 mg/kg) 联合使用可显着抑制 BxPC-3 异种移植物的生长,而单独使用相同剂量的 XL765 则没有抑制作用。 [2] 在颅内植入 GBM 39-luc 细胞的裸鼠中,口服 XL765 导致中位肿瘤生物发光与对照相比减少 12 倍以上,并提高中位生存率。与单独使用替莫唑胺 (TMZ) 相比,XL765 和 TMZ 的组合导致中位生物发光减少 140 倍,中位生存期略有改善。 [3]
|
| 酶活实验 |
PI3K 同工型的激酶活性通过使用荧光素酶-荧光素偶联化学发光的激酶反应后消耗的 ATP 百分比来测量,其中 ATP 浓度大约等于每个激酶的 Km。通过将测试化合物、ATP 和激酶混合在 20 μL 体积中来启动激酶反应。 PI3Kα、PI3Kβ、PI3Kγ 和 PI3Kδ 终酶浓度分别为 0.5、8、20 和 2 nM。 DNA-PK(DNA 蛋白激酶)和 VPS34 使用类似的检测形式。 VPS34 检测缓冲液含有 20 mM Tris-HCl、pH 7.5、3.5 mM MnCl2、100 mM NaCl、1 mM DTT 和 0.01% 胆酰胺丙基二甲基铵丙磺酸盐 (CHAPS)。值得注意的是,将含有不同浓度的测试化合物的 0.5 μL DMSO 与 10 μL 酶溶液(2×浓度)混合。通过添加 10 μL 肝磷脂酰肌醇和 ATP 溶液(2×浓度)来启动激酶反应。 VPS34、ATP 和磷脂酰肌醇的检测浓度分别为 40 nM、1 μM 和 5 μM。
|
| 细胞实验 |
细胞(胰腺癌细胞系(HcG25、Panc89、PA-TU8988T、Panc2.13、MiaPaCa2、Panc10.05、Panc8.13、BxPC-3等)在铺板后24小时用XL765处理并收获用于凋亡或自噬XL765 处理后 24、48 或 72 小时进行测定。通过荧光激活细胞分选 (FACS),通过膜联蛋白 V 阳性细胞的总百分比来确定细胞凋亡。通过活体活体细胞检测 XL765 处理的细胞中的酸性囊泡细胞器 (AVO)吖啶橙染色。AVO 形成的程度表示为 XL765 处理的细胞中吖啶橙荧光强度 (FL3) 与对照细胞相比增加的倍数。XL765 对 I 类 PI3K 有活性(IC50 = 39、113、9 和 43 nM) XL765 还抑制 DNA-PK (IC50 = 150 nM) 和 mTOR (IC50 = 157 nM),但不抑制 XL-147,其显示 IC50 值 > 15 μM。XL765 治疗导致以剂量依赖性方式降低 13 种 PDA 细胞系中的细胞活力。XL765 是一种双靶点 PI3K/mTOR 抑制剂,与 PI3K 选择性抑制剂 XL147 和 XL147 相比,可在更多细胞系中以更低的浓度抑制细胞生长和凋亡。 PIK90。通过使用单一目标化合物的组合可以重现该效果。 XL765 显着降低 mTOR 靶点 S6、S6K 和 4EBP1 的磷酸化,这与更大的细胞凋亡诱导相关,而不是单独抑制 PI3K。 XL765 处理会导致 MIAPaCa-2 细胞中自噬体的积累,并在稳定表达 LC3-GFP 构建体的 MIAPaCa-2 细胞中产生显着的剂量依赖性 AVO 诱导和 LC3-II 刺激。
|
| 动物实验 |
Female Nu/Nu mice inoculated s.c. with BxPC-3 cells
30 mg/kg Oral gavage once a day |
| 药代性质 (ADME/PK) |
Absorption, Distribution and Excretion
Orally available |
| 参考文献 | |
| 其他信息 |
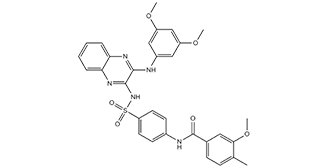
XL765 is a sulfonamide obtained by formal condensation of the sulfonic acid group of 4-[(3-methoxy-4-methylbenzoyl)amino]benzenesulfonic acid with the primary aromatic amino group of N-(3,5-dimethoxyphenyl)quinoxaline-2,3-diamine. A dual PI3K/mTOR inhibitor used in cancer treatment. It has a role as an EC 2.7.1.137 (phosphatidylinositol 3-kinase) inhibitor, an antineoplastic agent and a mTOR inhibitor. It is a sulfonamide, a quinoxaline derivative, an aromatic amine, a member of benzamides and an aromatic ether.
XL765 is an orally available small molecule that has been shown in preclinical studies to selectively inhibit the activity of phosphoinositide-3 kinase (PI3K) and mammalian target of rapamycin (mTOR). It is being developed by Exelixis, Inc. Drug Indication For the treatment of various forms of cancer. Mechanism of Action XL765 inhibits the activity of phosphoinositide-3 kinase (PI3K), which is frequently activated in tumors and promotes cell growth, survival and resistance to chemotherapy and radiotherapy. XL765 also inhibits mammalian target of rapamycin (mTOR), which also is activated frequently in human tumors and plays a central role in tumor cell growth. XL765 potently inhibits Class I PI3K isoforms and mTOR. Pharmacodynamics XL765 is an orally available small molecule that has been shown in preclinical studies to selectively inhibit the activity of phosphoinositide-3 kinase (PI3K) and mammalian target of rapamycin (mTOR). Activation of PI3K is a frequent event in human tumors, promoting tumor cell growth, survival, and resistance to chemotherapy and radiotherapy. mTOR is also frequently activated in human tumors and plays a central role in tumor cell growth. mTOR can be activated via upregulation of PI3K, or via PI3K-independent mechanisms. Inactivation of PI3K has been shown to inhibit growth and induce apoptosis (programmed cell death) in tumor cells, whereas inactivation of mTOR has been shown to inhibit the growth of tumor cells. In preclinical studies, XL765 slowed tumor growth or caused tumor shrinkage in multiple preclinical cancer models, including breast, lung, ovarian, and prostate cancers, and gliomas. XL765 has also been shown to enhance the anti-tumor effects of several chemotherapeutic agents in preclinical cancer models. XL765 has at least a 24-hour duration of action against both PI3K and mTOR readouts in tumors in vivo following a single oral (PO) dose of 30-100 mg/kg. |
| 分子式 |
C31H29N5O6S
|
|---|---|
| 分子量 |
599.66
|
| 精确质量 |
599.183
|
| 元素分析 |
C, 62.09; H, 4.87; N, 11.68; O, 16.01; S, 5.35
|
| CAS号 |
1349796-36-6
|
| 相关CAS号 |
1349796-36-6;934493-76-2;
|
| PubChem CID |
49867926
|
| 外观&性状 |
Light yellow to yellow solid powder
|
| 密度 |
1.4±0.1 g/cm3
|
| 折射率 |
1.674
|
| LogP |
5.96
|
| tPSA |
149.15
|
| 氢键供体(HBD)数目 |
3
|
| 氢键受体(HBA)数目 |
10
|
| 可旋转键数目(RBC) |
10
|
| 重原子数目 |
43
|
| 分子复杂度/Complexity |
993
|
| 定义原子立体中心数目 |
0
|
| SMILES |
S(C1C([H])=C([H])C(=C([H])C=1[H])N([H])C(C1C([H])=C([H])C(C([H])([H])[H])=C(C=1[H])OC([H])([H])[H])=O)(N([H])C1C(=NC2=C([H])C([H])=C([H])C([H])=C2N=1)N([H])C1C([H])=C(C([H])=C(C=1[H])OC([H])([H])[H])OC([H])([H])[H])(=O)=O
|
| InChi Key |
HJSSPYJVWLTYHG-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C31H29N5O6S/c1-19-9-10-20(15-28(19)42-4)31(37)33-21-11-13-25(14-12-21)43(38,39)36-30-29(34-26-7-5-6-8-27(26)35-30)32-22-16-23(40-2)18-24(17-22)41-3/h5-18H,1-4H3,(H,32,34)(H,33,37)(H,35,36)
|
| 化学名 |
N-[4-[[[3-[(3,5-dimethoxyphenyl)amino]-2-quinoxalinyl]amino]sulfonyl]phenyl]-3-methoxy-4-methyl-benzamide
|
| 别名 |
SAR245409 analogue; SAR245409 analogue; SAR 245409analogue; XL765 analogue; XL 765 analogue; XL-765 analogue; Voxtalisib analogue
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO: ~12 mg/mL (20.0 mM)
Water: <1 mg/mL Ethanol: <1 mg/mL |
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (4.17 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: 2.5 mg/mL (4.17 mM) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 悬浊液; 超声助溶。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 View More
配方 3 中的溶解度: 30% PEG400+0.5% Tween80+5%Propylene glycol: 30mg/mL 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 1.6676 mL | 8.3381 mL | 16.6761 mL | |
| 5 mM | 0.3335 mL | 1.6676 mL | 3.3352 mL | |
| 10 mM | 0.1668 mL | 0.8338 mL | 1.6676 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
|
J Mol Med, 2011, 89(9), 877-889. |
|