| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 2mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| 1g |
|
||
| Other Sizes |
|
| 靶点 |
Natural substrate of luciferase (Luc) enzyme
|
|---|---|
| 体外研究 (In Vitro) |
1. 注意事项:
a) D-荧光素盐(钠盐或钾盐)在水性缓冲液(pH 6.1-6.5)中表现出高达100mM的高溶解度。储备溶液可以用不含ATP的水制备,并在-20°C的避光/黑暗中储存。游离酸必须用适当的碱中和才能溶解。在较高的pH值下,荧光素在碱性催化下会形成脱氢荧光素,并外消旋为L-异构体(L-荧光素)。 b) D-荧光素可用于任何现有的报告分析或ATP分析系统。 c) 如果测试ATP,请戴手套并使用无ATP容器,以尽量减少所有可能的ATP污染源。仅使用无菌无ATP水和试剂。使用高压灭菌水制备所有试剂。 2.实验方案:该方案仅供参考,可根据您的具体要求进行调整 以下方案是D-Luciferin钠/钾盐的制备示例。它适用于大多数细胞类型和体内动物使用。 2.1体外生物发光图像分析示例 a) 在无菌水中制备100 mM(100-200X)荧光素储备溶液。混合均匀。立即使用或一次性分装,在-20°C下避光储存,避免冻融循环。 b) 在预热的组织培养基中制备0.5-1mM D-荧光素工作溶液。 c) 从培养的细胞中吸出培养基。 d) 向细胞中加入荧光素工作溶液,在成像前在37°C下孵育5-10分钟。 2.2体内生物发光图像分析示例 a) 在DPBS中制备15mg/mL荧光素储备溶液,不含Mg2+和Ca2+。混合均匀。 b) 过滤器通过0.2μM过滤器从溶液中去除细菌。立即使用或一次性分装,并在-20°C下避光储存,以避免冻融循环。 c) 成像前10-15分钟,腹腔注射150mg/kg(或10μL/g荧光素储备溶液)动物体重的荧光素。 注意:应在每种动物模型上进行荧光素动力学研究,以确定峰值信号时间。 2.3荧光素报告基因检测示例 a) 在无菌水中制备100 mM荧光素储备溶液。立即使用或一次性分装,在-20°C下避光储存,避免冻融循环。 b) 在pH 7.8的25 mM Tricine缓冲液中制备1 mM D-荧光素工作溶液和3 mM ATP、1 mM DTT和15 mM MgSO4。 c) 将5-10μL细胞裂解液转移到微孔板上。使用裂解试剂或不含裂解物的缓冲溶液作为空白。 d) 根据制造商的说明,向发光计中注入荧光素工作溶液。 e) 立即注入200μL荧光素工作溶液,积分时间为10秒。 |
| 体内研究 (In Vivo) |
目前最流行的技术是生物发光成像(BLI),它使用D-荧光素作为底物,萤火虫荧光素酶(Fluc)作为报告基因。通过绘制总信号强度与 D-荧光素注射后的时间量的关系图来创建时间-强度曲线。除了峰值信号之外,在 D-荧光素注射后的特定时间间隔(5、10、15 和 20 分钟)还鉴定了峰值信号的替代信号。为了描述 D-荧光素注射后时间变化的模式,给定时间-强度曲线中的信号根据曲线中的峰值信号进行标准化 [3]。每克体重注射10μL D-荧光素原液(腹腔或静脉注射);对于 20 g 小鼠来说,150 mg/kg 的常规剂量约为 200 µL。室温解冻后,将 D-荧光素(钠盐或钾盐)溶解在 dPBS(不含钙或镁)中,直至最终浓度达到 15 mg/mL。移取 5–10 mL 无菌水预润湿 0.22 μm 过滤器;丢弃水。使用准备好的 0.22 μm 注射器过滤器过滤 D-荧光素溶液,以确保其无菌。[3]
脑源性神经营养因子(BDNF)在许多脑功能中起着至关重要的作用,包括记忆巩固。以前,我们产生了一种Bdnf-Luciferase转基因(Bdnf-Luc)小鼠品系,使用体内生物发光成像来观察Bdnf表达的变化。我们使用d-荧光素类似物TokeOni成功地观察到活小鼠大脑中活动依赖性Bdnf的诱导,TokeOni分布在大脑中并产生近红外生物发光。在这项研究中,我们比较了d-荧光素、TokeOni和另一种产生近红外光的d-荧光素类似物seMpai在Bdnf-Luc小鼠全身内产生的生物发光信号模式。正如最近报道的那样,在使用TokeOni时,在野生型小鼠中观察到肝脏背景信号。当使用d-荧光素和TokeOni时,从含有肝脏的区域强烈观察到生物发光信号。此外,我们在使用TokeOni时检测到了来自大脑的信号。与d-荧光素和TokeOni相比,seMpai在Bdnf-Luc小鼠全身广泛检测到信号。特别是在含有骨骼肌的区域,seMpai产生的信号很强。总的来说,当使用不同的萤光素酶底物时,Bdnf-Luc小鼠的生物发光信号模式会有所不同。因此,通过选择合适的底物,可以可视化Bdnf在感兴趣的组织和器官中的表达。[4] |
| 酶活实验 |
D-荧光素是所有萤光素酶的天然底物,这些萤光素酶催化生物发光昆虫产生光。本综述涵盖了D-荧光素和衍生物或类似物的合成,它们是美国萤火虫Photinus pyralis荧光素酶的底物或抑制剂,Photinus piralis是体外和光学成像技术中更常用的酶[1]。
|
| 细胞实验 |
有机阴离子转运蛋白1(SLC22A6/OAT1)在肾小管排泄内源性和外源性阴离子物质(包括药物)中起着关键作用。由于伴随药物对OAT1功能的抑制可能会在临床实践中引起药代动力学药物相互作用(DDI),因此评估OAT1抑制效力的体外摄取研究可用于预测和避免DDI,并推荐用于药物开发中的候选药物。在本章中,我们描述了一种基于生物发光(BL)检测的快速、高灵敏度的OAT1功能测定方法,该方法使用D-荧光素作为活细胞中的底物。测量原理简单地依赖于D-荧光素被识别为OAT1底物的生化特征,BL强度取决于细胞内D-荧光素水平和萤光素酶活性,从而可以定量分析OAT1介导的D-荧光素转运。BL测量可以在1分钟内完成,而不需要去除细胞外摄取溶液和洗涤细胞的实验程序,这两者都涉及使用同位素标记或荧光化合物的传统摄取研究。本方法适用于高通量筛选,以识别和避免药物开发中潜在的OAT1抑制剂[5]。
|
| 动物实验 |
The peak signal or the signal at a predetermined, fixed time point after D-luciferin injection may be used for the quantitative analysis of in vivo bioluminescence imaging. We repeatedly performed sequential bioluminescence imaging after subcutaneous injection of D-luciferin in mice bearing subcutaneous tumors. The peak time in each measurement became shorter early after cell inoculation, presumably due to gradual establishment of intratumoral vasculature, and reached a plateau of about 10 min on day 10. Although the correlation between the signal at a fixed time point and the peak signal was high, the signal at 5 or 10 min normalized for the peak signal was lower for earlier days, which caused overestimation of tumor growth. The time course of the signals after D-luciferin injection may vary with time after cell inoculation, and this variation should be considered when determining the imaging protocol for quantitative bioluminescence tumor monitoring.[2]
|
| 参考文献 |
[1]. Giuseppe Meroni, et al. D-Luciferin, derivatives and analogues: synthesis and in vitro/in vivo luciferase-catalyzed bioluminescent activity. ARKIVOC 2009 (i) 265-288.
[2]. Rajesh Shinde, et al. Luciferin derivatives for enhanced in vitro and in vivo bioluminescence assays. Biochemistry. 2006 Sep 19;45(37):11103-12. [3]. Inoue Y, et al. Timing of imaging after d-luciferin injection affects the longitudinal assessment of tumor growthusing in vivo bioluminescence imaging. Int J Biomed Imaging. 2010;2010:471408. [4]. Bioluminescence imaging using d-luciferin and its analogs for visualizing Bdnf expression in living mice; different patterns of bioluminescence signals using distinct luciferase substrates. J Biochem 2022 Oct 19;172(5):321-327. [5]. A Simple and Rapid Bioluminescence-Based Functional Assay of Organic Anion Transporter 1 as a D-Luciferin Transporter. Methods Mol Biol 2022:2524:119-126. |
| 其他信息 |
Staining Example 1:
D-Luciferin potassium may be used as a substrate of luciferases for in vivo imaging. Method: For bioluminescence imaging. 1). Anesthetize mice, then inject mice with D-Luciferin potassium (75 mg/kg) for image. 2). Use the bioluminescence imaging system for image. Staining Example 2: D-Luciferin potassium may be used as a substrate of luciferases for in vivo imaging to monitor tumor growth. Method: For bioluminescence imaging. 1). Inject D-Luciferin potassium (150 mg/kg; intraperitoneal injection) into the mice. 2). Use a bioluminescence imaging system for image. Staining Example 3: D-Luciferin potassium may be used as a substrate of luciferases for a split-luciferase (LUC) assay. Method: For split-luciferase (LUC) assay. 1). Incubate plant sample (leaves) with D-Luciferin potassium (1 mM; 10 min) luciferin. 2). Use a Photek camera to capture signals and images. Staining Example 4: D-Luciferin may be used as a substrate of luciferases for in vivo imaging to monitor tumor growth. Method: For bioluminescence imaging. 1). Inject D-Luciferin potassium (150 mg/kg; intraperitoneal injection) into the mice. 2). Use IVIS Lumina XRMS Series for bioluminescence imaging. |
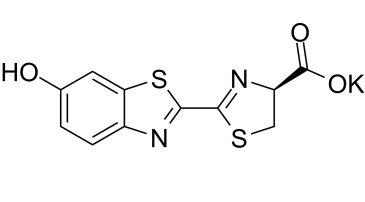
| 分子式 |
C11H7KN2O3S2
|
|---|---|
| 分子量 |
318.4
|
| 精确质量 |
317.9535
|
| 元素分析 |
C, 41.49; H, 2.22; K, 12.28; N, 8.80; O, 15.07; S, 20.14
|
| CAS号 |
115144-35-9
|
| 相关CAS号 |
D-Luciferin sodium;103404-75-7;D-Luciferin;2591-17-5; 103404-75-7 (Sodium)
|
| PubChem CID |
135478035
|
| 外观&性状 |
Typically exists as Light yellow to yellow solids at room temperature
|
| LogP |
1.384
|
| tPSA |
136.32
|
| 氢键供体(HBD)数目 |
1
|
| 氢键受体(HBA)数目 |
7
|
| 可旋转键数目(RBC) |
2
|
| 重原子数目 |
19
|
| 分子复杂度/Complexity |
396
|
| 定义原子立体中心数目 |
1
|
| SMILES |
[K+].S1C(C2=NC3C([H])=C([H])C(=C([H])C=3S2)O[H])=N[C@@]([H])(C(=O)[O-])C1([H])[H]
|
| InChi Key |
PWQWXGFOCJCDIF-SREJTOIWSA-M
|
| InChi Code |
InChI=1S/C11H8N2O3S2.K/c14-5-1-2-6-8(3-5)18-10(12-6)9-13-7(4-17-9)11(15)16/h1-3,7,13H,4H2,(H,15,16)/q+1/p-1/b10-9-/t7-/m1./s1
|
| 化学名 |
potassium (S,Z)-2-(6-oxobenzo[d]thiazol-2(6H)-ylidene)thiazolidine-4-carboxylate
|
| 别名 |
D-Luciferin potassium salt; Potassium (S)-2-(6-hydroxybenzo[d]thiazol-2-yl)-4,5-dihydrothiazole-4-carboxylate; D-Luciferin (potassium); D-Luciferin (potassium salt); 4-Thiazolecarboxylic acid, 4,5-dihydro-2-(6-hydroxy-2-benzothiazolyl)-, potassium salt (1:1), (4S)-; (S)-2-(6-Hydroxy-2-benzothiazolyl)-2-thiazoline-4-carboxylic acid potassium salt; D-Luciferin,potassium salt; D-Luciferin potassium
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 请将本产品存放在密封且受保护的环境中(例如氮气保护),避免吸湿/受潮和光照。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
H2O : ~25 mg/mL (~78.52 mM)
|
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: 8.33 mg/mL (26.16 mM) in PBS (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液; 超声助溶。 (<60°C).
请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 3.1407 mL | 15.7035 mL | 31.4070 mL | |
| 5 mM | 0.6281 mL | 3.1407 mL | 6.2814 mL | |
| 10 mM | 0.3141 mL | 1.5704 mL | 3.1407 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。