| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 1mg |
|
||
| 2mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
| 靶点 |
Wnt; Traf2- and Nck-interacting kinase (TNIK) (IC50 = 21 nM)
|
||
|---|---|---|---|
| 体外研究 (In Vitro) |
NCB-0846 具有抗 Wnt 特性。 TNIK 以非活性构象与 NCB-0846 结合;这种结合模式似乎对于 Wnt 抑制至关重要。 NCB-0846 对 TNIK 具有抑制作用,IC50 为 21 nM。此外,NCB-0846 还可抑制 FLT3、JAK3、PDGFRα、TRKA、CDK2/CycA2 和 HGK。在 0.1 至 0.3 μM 浓度下,NCB-0846 加速 TNIK 磷酸化 TCF4 的迁移,在 3 μM 浓度下,它完全阻止 TNIK 磷酸化。除了抑制 HCT116 细胞生长外,NCB-0846 对相同细胞在软琼脂中形成集落的能力具有更强的抑制作用(-20 倍)[1]。
NCB-0846抑制TGFβ1诱导的A549细胞EMT。这种抑制与抑制Sma和Mad相关蛋白2/3(SMAD2/3)磷酸化和核转位有关。EMT的抑制是通过抑制TGFβ受体I型(TGFBR1)基因介导的,至少部分是通过诱导靶向TGFBR1转录物的microRNAs[miR-320(a、b和d)和miR-186]。 结论:NCB-0846通过转录下调TGFBRI表达,在药理学上阻断肺癌细胞的TGFβ/SMAD信号传导和EMT诱导,为预防肺癌患者转移提供了一种潜在的有前景的方法[2]。 |
||
| 体内研究 (In Vivo) |
NCB-0846 可抑制将 HCT116 细胞移植到免疫功能低下的小鼠体内而产生的肿瘤形成。 NCB-0846 处理后,异种移植物中 Wnt 靶基因表达(AXIN2、MYC 和 CCND1)下调。 NCB-0846 导致亚 G1 细胞群增加。当聚 (ADP-核糖) 聚合酶 1 裂解时会诱导细胞凋亡 [1]。
NCB-0846可口服,并抑制了通过将HCT116细胞接种到免疫缺陷小鼠体内而建立的肿瘤的生长(图3c,左)。小鼠的体重在NCB-0846给药开始时下降,但逐渐恢复(图3c,右)。施用NCB-0846后,异种移植物中Wnt靶基因(AXIN2、MYC和CCND1)的表达降低(图3d)。 然后在Apcmin/+小鼠中研究了NCB-0846对Wnt驱动的肿瘤发生的影响。NCB-0846的盐酸盐是水溶性的,随后用于口服给药。NCB-0846的给药在出生后10周开始,小鼠在15周龄时被翻松。NCB-0846剂量依赖性地减少了小肠肿瘤的多样性和尺寸(图3g)。尽管NCB-0846对结肠肿瘤发生的影响在统计学上并不显著,但鉴于所检查的动物数量较少,Apcmin/+小鼠的结肠肿瘤发展普遍缺乏,这一发现可能不是决定性的。主动Wnt信号传导将单个肠上皮细胞转化为腺瘤,NCB-0846被认为可以抑制这种肿瘤的发生过程。结肠中发生的肿瘤数量也有所减少,但由于结肠肿瘤的数量和检查的动物数量很少,这一差异未能达到统计学意义。[1] NCB-0846抑制转移的潜力[2] 最后,我们探讨了NCB-0846的EMT抑制活性是否影响转移。在NCB-0846或NCB-0970存在或不存在的情况下,用TGFβ1处理A549细胞48小时 h,然后通过尾静脉注射到免疫缺陷小鼠体内(每组8只)。注射七周后,处死小鼠,在组织切片中对其肺转移进行数字定量(图5a)。该动物实验主要用于评估全身注射后立即栓塞在外周肺血管中的癌症细胞的经内皮迁移/外渗能力。 在注射TGFβ1处理的细胞的小鼠中,转移性病变占肺面积的38%,但差异显著(P < 0.001) 注射了经NCB-0846处理的细胞的小鼠肺部中的抗体减少(图5b)。我们通过组织切片的显微镜检查证实完全没有转移。同时,与注射过DMSO(对照组)或NCB-0970细胞的小鼠相比,注射过NCB-0846处理细胞的小鼠的平均肺重量因缺乏肺转移负荷而显著降低(图5c)。这些结果支持NCB-0846对EMT的抑制损害了TGFβ1诱导的肺癌细胞转移潜能的观点。 |
||
| 酶活实验 |
迁移率变化分析[1]
使用QuickScout筛选辅助试剂盒通过迁移率变化分析52测量TNIK的酶活性。使用LabChip EZ Reader II定量反应产物。使用非线性回归分析从剂量-反应曲线计算IC50值(图2b)。 激酶选择性分析[1] 使用非放射性测定法评估化合物对50种人类蛋白激酶的选择性。抑制剂浓度为0.1时测定抑制百分比 M与Km浓度下的ATP(图2c和补充表1)。 |
||
| 细胞实验 |
免疫荧光显微镜[2]
细胞以2.5或5.0接种 × 104 将每孔的胶原蛋白涂覆在8孔培养载玻片(BioCoat)上。血清饥饿24小时后,将细胞与单独的二甲亚砜(DMSO)(对照组)、TGFβ1(5 ng/ml)和DMSO、TGF-β1和NCB-0846(1µM)或TGFβ1和NCB-970(1µM)培养48小时 h,用4%多聚甲醛固定。如前所述,用一抗(列于补充表S1中)对固定细胞进行免疫染色。18在4℃下孵育过夜后 将细胞与Alexa Fluor 488或Alexa Fluor 568偶联的相关二抗一起孵育,并分别与TOTO3或鬼笔环肽共染色,以显示细胞核或丝状肌动蛋白。用LSM 5 PASCAL激光共聚焦显微镜系统检查细胞。 伤口闭合试验[2] A549细胞在5.0℃下接种 × 105 6孔板中每孔的血清饥饿24小时 h在融合细胞单层上产生划痕之前。然后,用单独的DMSO(对照组)、TGFβ1(5 ng/ml)和DMSO、TGF-β1和NCB-0846(3µM)或TGFβ1和NCB-970(3µM)处理受伤的单层48小时 h.通过测量三次无细胞区域的宽度来确定迁移程度。 自动实时细胞迁移分析[2] 细胞被镀(1.0× 104 将细胞/孔)一式三份放置在嵌入微电极的xCelligence E培养板上。当细胞达到汇合状态(由稳态阻抗指示)时,用无菌P200微量移液器尖端产生划痕,并用单独的DMSO(对照组)、TGFβ1(5 ng/ml)和DMSO、TGFβ2和NCB-0846(3µM)或TGFβ1和NCB-970(3µM)处理细胞40分钟 h.使用xCelligence仪器实时监测刮擦前后细胞单层的阻抗以及全阻抗的恢复情况。 细胞侵袭试验[2] 使用预涂有20μm孔径的16孔透孔板(CIM板16)评估细胞侵袭 µl在MEM培养基中以1:40稀释的Matrigel。微电极位于上腔膜的下侧。将含有10%FCS的培养基加入下腔室,并在4℃时将细胞接种到上腔室 × 104 在无血清培养基中每孔。A549细胞分别用DMSO单独处理(对照组)、TGFβ1(5 ng/ml)和DMSO处理,TGFβ1和NCB-0846处理(3µM),或TGFβ1与NCB-970处理(3μM)。使用xCelligence仪器实时监测迁移细胞的阻抗。使用随仪器提供的RTCA软件2.0进行数据分析。 定量PCR[2] 根据制造商的说明,用RNeasy Mini Kit或miRNeasy MiniKit分离总RNA。使用高容量cDNA逆转录试剂盒或MicroRNA逆转录试剂盒制备cDNA。分别使用TaqMan基因表达测定或TaqMan MicroRNA测定来测量mRNA和miRNA的相对表达。使用比较阈值循环(CT)方法对扩增进行定量。19β-Actin(ACTB)或U6用作内部对照。预设计的引物和探针组列于补充表S2中。 miRNA微阵列分析[2] 使用miRNeasy Mini试剂盒从单独用DMSO(对照)、TGFβ1(5 ng/ml)和DMSO、TGFβ2和NCB-0846(3µM)或TGFβ1和NCB-970(3µM)处理的A549细胞制备总RNA,并使用安捷伦人类miRNA微阵列试剂盒进行miRNA表达谱分析8 × 60 K rel.21.0符合制造商的协议。使用特征提取软件11.5.1.1使用默认参数对扫描图像进行分析,以获得背景减影值。GeneView文件是使用安捷伦11.5.1.1版特征提取软件生成的。微阵列数据以登录号GSE95766(2017年3月8日发布)保存在NCBI基因表达综合数据库中。 寡核苷酸转染[2] 将siTβRI或siNC以5μmol/L的终浓度转染到细胞中 nM与Lipofectamine 2000混合并在12小时血清饥饿后更换转染培养基。然后将细胞与或不与TGFβ1(5 ng/ml)一起孵育48小时 h.用终浓度为50μg/ml的Lipofectamine 2000转染所有模拟物和抑制剂 nM,在37℃下孵育 48°C h. 萤光素酶报告基因测定[2] 用携带三个拷贝的SMAD结合元件(SBE)pGL4.48-luc2P/SBE/Hygro的萤光素酶报告质粒转染的A549细胞用DMSO(对照)或TGF-β1(2ng/ml)处理60分钟 在不同浓度下,使用不同浓度的NCB-0846或NCB-970,持续5分钟 h、 并测定其萤光素酶活性。 |
||
| 动物实验 |
|
||
| 参考文献 | |||
| 其他信息 |
Canonical Wnt/β-catenin signalling is essential for maintaining intestinal stem cells, and its constitutive activation has been implicated in colorectal carcinogenesis. We and others have previously identified Traf2- and Nck-interacting kinase (TNIK) as an essential regulatory component of the T-cell factor-4 and β-catenin transcriptional complex. Consistent with this, Tnik-deficient mice are resistant to azoxymethane-induced colon tumorigenesis, and Tnik(-/-)/Apc(min/+) mutant mice develop significantly fewer intestinal tumours. Here we report the first orally available small-molecule TNIK inhibitor, NCB-0846, having anti-Wnt activity. X-ray co-crystal structure analysis reveals that NCB-0846 binds to TNIK in an inactive conformation, and this binding mode seems to be essential for Wnt inhibition. NCB-0846 suppresses Wnt-driven intestinal tumorigenesis in Apc(min/+) mice and the sphere- and tumour-forming activities of colorectal cancer cells. TNIK is required for the tumour-initiating function of colorectal cancer stem cells. Its inhibition is a promising therapeutic approach. [1]
Background: Metastasis is the primary cause of death in cancer patients, and its management is still a major challenge. Epithelial to mesenchymal transition (EMT) has been implicated in the process of cancer metastasis, and its pharmacological interference holds therapeutic promise. Methods: Traf2- and Nck-interacting kinase (TNIK) functions as a transcriptional coregulator of Wnt target genes. Given the convergence of Wnt and transforming growth factor-β (TGFβ) signalling, we examined the effects of a small-molecule TNIK inhibitor (named NCB-0846) on the TGFβ1-induced EMT of lung cancer cells. Results: NCB-0846 inhibited the TGFβ1-induced EMT of A549 cells. This inhibition was associated with inhibition of Sma- and Mad-Related Protein-2/3 (SMAD2/3) phosphorylation and nuclear translocation. NCB-0846 abolished the lung metastasis of TGFβ1-treated A549 cells injected into the tail veins of immunodeficient mice. The inhibition of EMT was mediated by suppression of the TGFβ receptor type-I (TGFBR1) gene, at least partly through the induction of microRNAs targeting the TGFBR1 transcript [miR-320 (a, b and d) and miR-186].[2] |
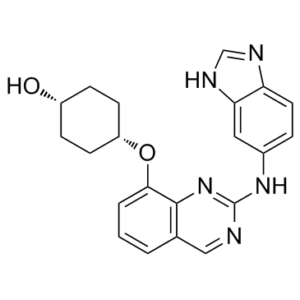
| 分子式 |
C21H21N5O2
|
|
|---|---|---|
| 分子量 |
375.42
|
|
| 精确质量 |
375.17
|
|
| 元素分析 |
C, 67.18; H, 5.64; N, 18.65; O, 8.52
|
|
| CAS号 |
1792999-26-8
|
|
| 相关CAS号 |
2749881-54-5; 1792999-26-8
|
|
| PubChem CID |
91801204
|
|
| 外观&性状 |
Light yellow to yellow solid powder
|
|
| LogP |
3.6
|
|
| tPSA |
96
|
|
| 氢键供体(HBD)数目 |
3
|
|
| 氢键受体(HBA)数目 |
6
|
|
| 可旋转键数目(RBC) |
4
|
|
| 重原子数目 |
28
|
|
| 分子复杂度/Complexity |
515
|
|
| 定义原子立体中心数目 |
0
|
|
| SMILES |
C1CC(CCC1O)OC2=CC=CC3=CN=C(N=C32)NC4=CC5=C(C=C4)N=CN5
|
|
| InChi Key |
FYWRWBSYRGSWIQ-UHFFFAOYSA-N
|
|
| InChi Code |
InChI=1S/C21H21N5O2/c27-15-5-7-16(8-6-15)28-19-3-1-2-13-11-22-21(26-20(13)19)25-14-4-9-17-18(10-14)24-12-23-17/h1-4,9-12,15-16,27H,5-8H2,(H,23,24)(H,22,25,26)
|
|
| 化学名 |
|
|
| 别名 |
|
|
| HS Tariff Code |
2934.99.9001
|
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
|
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
|
|||
|---|---|---|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.25 mg/mL (5.99 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 22.5 mg/mL澄清的DMSO储备液加入到400 μL PEG300中,混匀;再向上述溶液中加入50 μL Tween-80,混匀;然后加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.25 mg/mL (5.99 mM) (饱和度未知) in 10% DMSO + 90% Corn Oil (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 22.5 mg/mL 澄清 DMSO 储备液加入到 900 μL 玉米油中并混合均匀。 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.6637 mL | 13.3184 mL | 26.6368 mL | |
| 5 mM | 0.5327 mL | 2.6637 mL | 5.3274 mL | |
| 10 mM | 0.2664 mL | 1.3318 mL | 2.6637 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
Reduced tumorigenicity ofTnik-deficient mice.Nat Commun.2016 Aug 26;7:12586. |
|---|
Identification of a novel TNIK inhibitor.Nat Commun.2016 Aug 26;7:12586. |
NCB-0846inhibits cancer cell growthin vitroandin vivo.Nat Commun.2016 Aug 26;7:12586. |
Structural basis of TNIK inhibition.Nat Commun.2016 Aug 26;7:12586. |
|---|
TNIK inhibition abrogates colorectal cancer stemness.Nat Commun.2016 Aug 26;7:12586. |
Patient-derived cancer-initiating cells.Nat Commun.2016 Aug 26;7:12586. |