| 规格 | 价格 | |
|---|---|---|
| 500mg | ||
| 1g | ||
| Other Sizes |
| 靶点 |
p2x1 Receptor
|
|---|---|
| 体外研究 (In Vitro) |
NF449 抑制 GTP[γS] 与 rGsα-s 的结合率,而对与 rGiα-1 的结合影响不大(IC50=140 nM),抑制外源添加的 Gsα-s 对 S49 环化膜(缺乏内源性 Gsα)中腺苷酸环化酶活性的刺激,并阻断 β-肾上腺素受体与 Gs 的偶联(EC50=7.9 μM)[2]。
P2X受体是由细胞外ATP和相关核苷酸门控的阳离子通道。由于P2X受体的广泛分布和亚型的高度多样性,需要强效和选择性的拮抗剂来分析它们在完整组织中的作用。基于苏拉明作为先导化合物,已经描述了几种衍生物,其阻断重组P2X受体的效力比苏拉明高几个数量级。在这里,我们描述了苏拉明类似物4,4',4'',4''-(羰基双(亚氨基-5,1,3-苯三基双(羰基氨基))四-苯-1,3-二磺酸(NF449)的特性,即其分别拮抗ATP或α-β-亚甲基腺苷5'-三磷酸诱导的同源大鼠P2X(1)-P2X(4)受体或异源P2X(1+5)和P2X(2+3)受体的内向电流的效力NF449最有效地阻断了P2X(1)和P2X(1+5)受体,IC(50)值分别为0.3 nM和0.7 nM。阻断同源P2X(3)或异源P2X(2+3)受体(IC(50)分别为1.8和0.3微M)需要高出3到4个数量级的NF449浓度。NF449对同聚P2X(2)受体(IC(50)47微M)和同聚P2X(4)受体(IC(50)>300微M)的效力最低。总的来说,这些结果表明NF449是迄今为止结合P2X(1)亚基的受体(如P2X(2)同聚体和P2X(1+5)异聚体)最有效和最具选择性的拮抗剂。[1] 目的是确定新描述的P2X1拮抗剂NF449[4,4',4'',4''-(羰基双(亚氨基-5,1,3-苯三酰双(羰基氨基)))四苯-1,3-二磺酸八钠盐]是否可以选择性拮抗血小板P2X1受体,以及它如何影响血小板功能NF449抑制α,β-亚甲基腺苷5'-三磷酸诱导的形状变化(IC50=83+/-13nM;n=3)和钙内流(pA2=7.2+/-0.1;n=3;pIC50=6.95),以防止P2X1受体脱敏。NF449也拮抗了P2Y1受体介导的钙升高,但效力较低(IC50=5.8+/-2.2微M;n=3)。相比之下,它是P2Y12介导的腺苷酸环化酶活性抑制的非常弱的拮抗剂。NF449选择性阻断P2X1受体导致胶原诱导的聚集减少,证实了该受体在胶原诱导的血小板活化中的作用。 |
| 体内研究 (In Vivo) |
在 10 mg/kg 剂量下,NF449 可抑制 5 g/mL 胶原蛋白诱发的野生型小鼠血小板体外聚集,但不影响 5 μM ADP 诱导的聚集。在较高剂量(50 mg/kg)下,NF449 不仅可抑制 10 g/mL 胶原蛋白诱发的体外血小板聚集,还可抑制 5 μM ADP 诱发的体外血小板聚集,表明对 P2Y1 和/或 P2Y12 受体具有非选择性抑制作用[3]。
|
| 酶活实验 |
Binding assay [2]
[35S]GTP[γS]与rGsα-S和rGiα-1(2-4pmol/测定)的结合如所述进行。β-肾上腺素能受体用拮抗剂[125I]CYP标记;在TEMA缓冲液(单位:50 Tris⋅HCl,pH 7.5,5 MgCl2,1 EDTA,1抗坏血酸)中孵育大鼠心肌膜(8-12μg/次测定)或S49环膜(3-6μg/次检测),并在图例中注明[125I]CYP、异丙肾上腺素、苏拉明类似物和GTP[γS]的浓度。如参考文献20所述,在S49环细胞膜中用低聚Gs(3 pmol rGsα-s和10 pmol纯化的βγ二聚体/反应的组合)重建高亲和力激动剂结合。在100μM异丙肾上腺素存在下测定非特异性结合(<15%的总结合)。A1腺苷受体用激动剂[125I]HPIA标记。结合反应在50μl含TEMA缓冲液、8单位/ml腺苷脱氨酶、人脑膜(约6-9μg)或稳定转染的293细胞膜(12-15μg)、1 nM[125I]HPIA中进行,无论是否存在浓度递增的苏拉明类似物。在1μM CPA(N6环戊基腺苷)存在下测定非特异性结合(<10%的总结合)。血管紧张素II 1型受体用拮抗剂[125I]saralasin II或激动剂[125I]Angiotensin II标记。在含有TEMA缓冲液、12.5μg/ml截短型人ACTH11-24、100μM杆菌肽、肾小球膜(5μg)、0.5 nM[125I]沙拉酶II或[125I]血管紧张素II的30μl中,在GTP[γS]和苏拉明类似物浓度增加的情况下进行结合试验。在存在1μM未标记的saralasin([125I]血管紧张素II)或血管紧张素Ⅱ([125I]saralasin)的情况下,测定非特异性结合(≤总结合的20%)。在30°C下60分钟后,通过玻璃纤维过滤器(预先浸泡在1%BSA中用于血管紧张素受体结合)过滤来停止结合反应。 腺苷酸环化酶活性的测定。[2] 通过添加rGsα-s,腺苷酸环化酶活性被重建为S49环化膜,如所述,只需稍作修改;在30°C下,将rGsα-s(0.1 mg/ml)在缓冲液(单位为mM:Hepes⋅NaOH,pH 7.6,1 EDTA,1 DTT,0.01 GTP[γs],10 MgSO4,0.1%Lubrol)中预活化30分钟,并稀释至适量的rGsα-s。或者,将失活的rGsα-s稀释在缺乏GTP[αs]和MgSO4的缓冲液中。S49环细胞膜(12.5μg)在冰上与20μl的rGsα-s预孵育20分钟;通过加入30μl底物溶液开始反应,在10μMNF449或10μM NF503存在和不存在的情况下,产生(以mM计)50 Hepes⋅NaOH,pH 7.6,1 EDTA,0.1 DTT,0.05[α-32P]ATP(约400 cpm/pmol),9 MgCl2,1 MgSO4,1μM GTP[γS]或10μM GTP。在20°C下孵育30分钟。 |
| 细胞实验 |
非洲爪蟾卵母细胞中重组P2X受体的电生理电流记录[1]
合成P2X受体cRNAs,并将其以5ng/μl(rP2X2)或0.5μg/μl的浓度(rP2X1、rP2X3、rP2X4、rP2X5)以50nl的体积注射到如前所述(Schmalzing等人,1991)制备的胶原酶脱乳爪蟾卵母细胞中。对于异源寡聚体rP2X1+5和rP2X2+3受体的表达,使用1:1的cRNAs比率,每个比率为0.5μg/μl。如前所述,在环境温度(22-24°C)和-60 mV的保持电位下,在标称无Ca2+的蛙林格氏溶液中注射RNA后2-6天,对全细胞电流进行了两次电极电压钳记录(Rettinger和Schmalzing,2003,Rettinger and Schmal zing,2004)。 为了分析NF449介导的对快速脱敏rP2X1和rP2X3受体电流的抑制作用,以4分钟的间隔用1μM ATP激活受体3至5次,持续10秒,ATP的浓度接近各自的EC50值(Rettinger和Schmalzing,2003,Rettinger and Schmidzing,2004),以获得恒定和可重复的电流反应。在此平衡期后,在ATP与NF449共施用之前,将表达rP2X1或rP2X3受体的卵母细胞与所需浓度的NF449预孵育指定时间。在非脱敏或缓慢脱敏的rP2X2和rP2X4受体上,NF449通常与10μM ATP联合使用。为了激活rP2X1+5和rP2X2+3受体,αβmeATP(1μM)被用作激动剂。 每次清除激动剂或激动剂和NF449后,由适当的激动剂引发对照反应,以监测下降或上升伪影,并检查拮抗作用的完全可逆性。为了测定IC50值,仅当NF449应用前后记录的对照反应之间的差异小于10%时,才使用反应。通过假设减速或加速的线性特征来纠正剩余的错误。浓度抑制曲线和所得IC50值来自Hill方程对合并数据点的非线性最小二乘拟合:(1) 其中Imax表示不存在NF449时的峰值电流响应,I表示各个NF449浓度下的峰值电流反应,nH表示希尔系数。结果以n个实验的平均值±SEM表示。 |
| 动物实验 |
Intravenous injection of 10 mg/kg NF449 into mice resulted in selective inhibition of the P2X1 receptor and decreased intravascular platelet aggregation in a model of systemic thromboembolism (35 +/- 4 versus 51 +/- 3%) (P = 0.0061; n = 10) but without prolongation of the bleeding time (106 +/- 16 versus 78 +/- 7 s; n = 10) (N.S.; P = 0.1209). At a higher dose (50 mg/kg), NF449 inhibited the three platelet P2 receptors. This led to a further reduction in platelet consumption compared with mice injected with saline (13 +/- 4 versus 42 +/- 3%) (P = 0.0002; n = 5). NF449 also reduced dose-dependently the size of thrombi formed after laser-induced injury of mesenteric arterioles. Overall, our results indicate that NF449 constitutes a new tool to investigate the functions of the P2X1 receptor and could be a starting compound in the search for new antithrombotic drugs targeting the platelet P2 receptors. [3]
|
| 参考文献 | |
| 其他信息 |
Suramin acts as a G protein inhibitor because it inhibits the rate-limiting step in activation of the Galpha subunit, i.e., the exchange of GDP for GTP. Here, we have searched for analogues that are selective for Gsalpha. Two compounds have been identified: NF449 (4,4',4",4'"-[carbonyl-bis[imino-5,1,3-benzenetriyl bis-(carbonylimino)]]tetrakis-(benzene-1,3-disulfonate) and NF503 (4, 4'-[carbonylbis[imino-3,1-phenylene-(2, 5-benzimidazolylene)carbonylimino]]bis-benzenesulfonate). These compounds (i) suppress the association rate of guanosine 5'-[gamma-thio]triphosphate ([35S]GTP[gammaS]) binding to Gsalpha-s but not to Gialpha-1, (ii) inhibit stimulation of adenylyl cyclase activity in S49 cyc- membranes (deficient in endogenous Gsalpha) by exogenously added Gsalpha-s, and (iii) block the coupling of beta-adrenergic receptors to Gs with half-maximum effects in the low micromolar range. In contrast to suramin, which is not selective, NF503 and NF449 disrupt the interaction of the A1-adenosine receptor with its cognate G proteins (Gi/Go) at concentrations that are >30-fold higher than those required for uncoupling of beta-adrenergic receptor/Gs tandems; similarly, the angiotensin II type-1 receptor (a prototypical Gq-coupled receptor) is barely affected by the compounds. Thus, NF503 and NF449 fulfill essential criteria for Gsalpha-selective antagonists. The observations demonstrate the feasibility of subtype-selective G protein inhibition. [2]
|
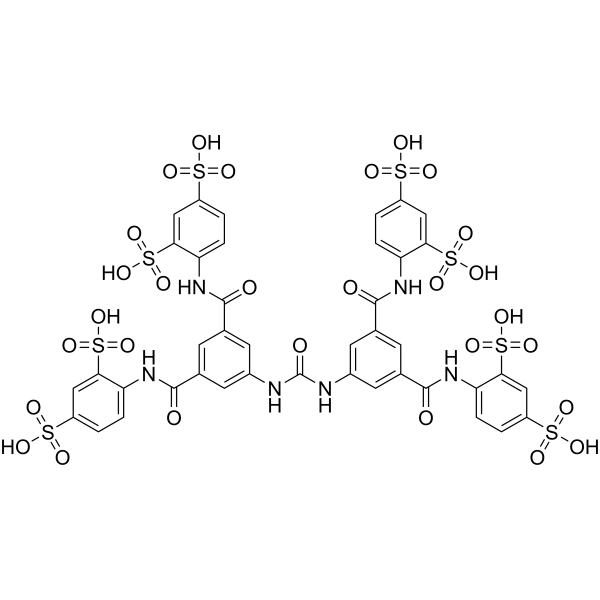
| 分子式 |
C41H32N6O29S8
|
|---|---|
| 分子量 |
1329.24
|
| 精确质量 |
1503.75349
|
| 元素分析 |
C, 32.72; H, 1.61; N, 5.58; Na, 12.22; O, 30.83; S, 17.04
|
| CAS号 |
389142-38-5
|
| 相关CAS号 |
627034-85-9
|
| 外观&性状 |
Typically exists as solids at room temperature
|
| tPSA |
682Ų
|
| SMILES |
[Na]OS(C1=CC=C(NC(C2C=C(NC(NC3=CC(C(NC4=CC=C(S(O[Na])(=O)=O)C=C4S(O[Na])(=O)=O)=O)=CC(C(NC4=CC=C(S(O[Na])(=O)=O)C=C4S(O[Na])(=O)=O)=O)=C3)=O)C=C(C(NC3=CC=C(S(O[Na])(=O)=O)C=C3S(O[Na])(=O)=O)=O)C=2)=O)C(S(O[Na])(=O)=O)=C1)(=O)=O
|
| InChi Key |
KCBZSNWCUJBMHF-UHFFFAOYSA-F
|
| InChi Code |
InChI=1S/C41H32N6O29S8.8Na/c48-37(44-29-5-1-25(77(53,54)55)15-33(29)81(65,66)67)19-9-20(38(49)45-30-6-2-26(78(56,57)58)16-34(30)82(68,69)70)12-23(11-19)42-41(52)43-24-13-21(39(50)46-31-7-3-27(79(59,60)61)17-35(31)83(71,72)73)10-22(14-24)40(51)47-32-8-4-28(80(62,63)64)18-36(32)84(74,75)76;;;;;;;;/h1-18H,(H,44,48)(H,45,49)(H,46,50)(H,47,51)(H2,42,43,52)(H,53,54,55)(H,56,57,58)(H,59,60,61)(H,62,63,64)(H,65,66,67)(H,68,69,70)(H,71,72,73)(H,74,75,76);;;;;;;;/q;8*+1/p-8
|
| 化学名 |
octasodium;4-[[3-[[3,5-bis[(2,4-disulfonatophenyl)carbamoyl]phenyl]carbamoylamino]-5-[(2,4-disulfonatophenyl)carbamoyl]benzoyl]amino]benzene-1,3-disulfonate
|
| 别名 |
nf449; 627034-85-9; NF449 octasodium salt; 389142-38-5; 4,4',4'',4'''-[Carbonylbis(imino-5,1,3-benzenetriyl-bis(carbonylimino))]tetrakis-1,3-benzenedisulfonic acid, octasodium salt; octasodium;4-[[3-[[3,5-bis[(2,4-disulfonatophenyl)carbamoyl]phenyl]carbamoylamino]-5-[(2,4-disulfonatophenyl)carbamoyl]benzoyl]amino]benzene-1,3-disulfonate; Lopac-N-4784; CHEMBL1253351;
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 溶解度 (体外实验) |
May dissolve in DMSO (in most cases), if not, try other solvents such as H2O, Ethanol, or DMF with a minute amount of products to avoid loss of samples
|
|---|---|
| 溶解度 (体内实验) |
注意: 如下所列的是一些常用的体内动物实验溶解配方,主要用于溶解难溶或不溶于水的产品(水溶度<1 mg/mL)。 建议您先取少量样品进行尝试,如该配方可行,再根据实验需求增加样品量。
注射用配方
注射用配方1: DMSO : Tween 80: Saline = 10 : 5 : 85 (如: 100 μL DMSO → 50 μL Tween 80 → 850 μL Saline)(IP/IV/IM/SC等) *生理盐水/Saline的制备:将0.9g氯化钠/NaCl溶解在100 mL ddH ₂ O中,得到澄清溶液。 注射用配方 2: DMSO : PEG300 :Tween 80 : Saline = 10 : 40 : 5 : 45 (如: 100 μL DMSO → 400 μL PEG300 → 50 μL Tween 80 → 450 μL Saline) 注射用配方 3: DMSO : Corn oil = 10 : 90 (如: 100 μL DMSO → 900 μL Corn oil) 示例: 以注射用配方 3 (DMSO : Corn oil = 10 : 90) 为例说明, 如果要配制 1 mL 2.5 mg/mL的工作液, 您可以取 100 μL 25 mg/mL 澄清的 DMSO 储备液,加到 900 μL Corn oil/玉米油中, 混合均匀。 View More
注射用配方 4: DMSO : 20% SBE-β-CD in Saline = 10 : 90 [如:100 μL DMSO → 900 μL (20% SBE-β-CD in Saline)] 口服配方
口服配方 1: 悬浮于0.5% CMC Na (羧甲基纤维素钠) 口服配方 2: 悬浮于0.5% Carboxymethyl cellulose (羧甲基纤维素) 示例: 以口服配方 1 (悬浮于 0.5% CMC Na)为例说明, 如果要配制 100 mL 2.5 mg/mL 的工作液, 您可以先取0.5g CMC Na并将其溶解于100mL ddH2O中,得到0.5%CMC-Na澄清溶液;然后将250 mg待测化合物加到100 mL前述 0.5%CMC Na溶液中,得到悬浮液。 View More
口服配方 3: 溶解于 PEG400 (聚乙二醇400) 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 0.7523 mL | 3.7615 mL | 7.5231 mL | |
| 5 mM | 0.1505 mL | 0.7523 mL | 1.5046 mL | |
| 10 mM | 0.0752 mL | 0.3762 mL | 0.7523 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。