| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 1mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| Other Sizes |
|
| 靶点 |
CYP2C8 (Ki = 4.82 μM); CYP2J2 (Ki = 5.75 μM)
|
|---|---|
| 体外研究 (In Vitro) |
Salvianolic Acid C 对 CYP2C8 和 CYP2J2 的 Ki 值分别为 4.82 和 5.75 μM,使其成为 CYP2C8 的非竞争性校正剂和 CYP2J2 的中度混合校正剂 [1]。 5 μM 丹酚酸 C 大大减少了 LPS 产生的 NO 的产生。丹酚酸 C 显着降低了 iNOS 的表达。丹酚酸 C 可防止 LPS 引起的 TNF-α、IL-1β、IL-6 和 IL-10 的过度产生。 LPS 产生的 NF-κB 活化被丹酚酸 C 抑制。在 BV2 小行星细胞中,C 还可以上调 HO-1 和 Nrf2 的表达 [2]。
丹酚酸C/SalC对细胞活力的影响[2] MTT法检测SalC对BV2小胶质细胞活力的影响。结果表明,1 μg/mL LPS对BV2小胶质细胞活力无明显影响。在0 ~ 20 μM浓度范围内,SalC对细胞活力没有影响(图1B),而在50和100 μM浓度范围内,SalC略微降低细胞活力。 SalC/丹酚酸C对lps处理BV2细胞NO、iNOS、PGE2和COX-2水平的影响[2] 采用Griess试剂测定NO释放量。如图2A所示,LPS刺激BV2细胞上清液中NO含量较对照组明显上调。1和5 μM SalC能显著抑制LPS诱导的NO生成(P < 0.01,P < 0.01)。为了明确抑制NO产生的原因,我们采用免疫荧光和Western方法进一步研究了iNOS的表达。如图2B-D所示,正常对照组iNOS表达极低,但LPS刺激可显著上调iNOS表达。SalC显著降低iNOS的表达。以上结果表明,SalC对NO生成的抑制作用是通过抑制iNOS表达实现的。进一步研究了SalC对PGE2和COX-2的影响。ELISA法检测PGE2的分泌。如图2E所示,LPS刺激导致细胞中PGE2含量显著增加(P < 0.01)。1和5 μM SalC显著降低lps诱导的PGE2上调(P < 0.05,P < 0.01)。Western blot法检测COX-2的表达。SalC显著降低LPS刺激诱导的COX-2表达(图2F)。以上结果表明,SalC可以显著抑制iNOS和COX-2的表达,从而阻断NO和PGE2的合成。 SalC/丹酚酸C抑制lps诱导的TNF - α、IL - 1β、IL - 6和IL - 10过量生成[2] 然后测量BV2小胶质细胞中TNF - α、IL - 1β、IL - 6和IL - 10的产生。结果显示,LPS刺激可显著增加BV2小胶质细胞中TNF - α、IL - 1β、IL - 6和IL - 10的产生(P < 0.01,图3A-D),而SalC可显著降低BV2小胶质细胞中TNF - α、IL - 1β、IL - 6和IL - 10的产生。如图3E-H所示,与对照组相比,LPS显著刺激了TNF - α、IL - 1β、IL - 6和IL - 10 mRNA的转录。SalC显著降低TNF - α、IL - 1β、IL - 6和IL - 10 mRNA的转录。 SalC/丹酚酸C抑制lps诱导的NF - κB活化[2] 免疫荧光结果显示,LPS刺激后p‑NF‑κB p65的核易位明显增加,而SalC可以抑制p‑NF‑κB p65的核易位(图4A)。Western blot法检测炎症相关蛋白的表达。活化形式的p‑NF‑κB p65在LPS刺激下显著增加(p < 0.01),SalC(0.1、1和5 μM)以浓度依赖的方式抑制LPS诱导的NF‑κB活化(p < 0.01,图4B、C)。图4 B、D表明p - IκBα水平在LPS组显著增加(p < 0.01),而SalC(0.1, 1和5 μM)下调p - IκBα水平显著(p < 0.05,p < 0.01和p < 0.01)。 SalC/丹酚酸C增加了BV2小胶质细胞中Nrf2和HO‑1的表达[2] Nrf2信号通路在炎症反应和氧化应激的调控中发挥重要作用。图5显示,LPS刺激组的细胞核Nrf2水平与正常对照组相比无显著差异(P > 0.05),Nrf2下游蛋白HO‑1的表达在两组之间也无显著差异(P > 0.05)。但SalC(0.1, 1和5 μM) Nrf2的表达明显增加(P < 0.01),以及其下游蛋白质HO - 1 (P < 0.05,P < 0.01和P < 0.01)。与LPS组相比,SalC(1和5 μM)也显著提高了抗氧化酶NQO1的表达(P < 0.01)。 SalC/丹酚酸C通过Nrf2通路抑制NF - κB活化[2] 阐明SalC是否通过Nrf2途径抑制NF - κB活化。使用siRNA技术敲除Nrf2。结果显示,Nrf2敲低逆转了SalC对TNF - α、IL - 1β、IL - 6和IL - 10产生的抑制作用(图6B-E)。此外,免疫荧光结果还显示,Nrf2敲低逆转了SalC对NF - κB核易位的抑制作用(图6A)。 AMPK/Nrf2信号通路参与了SalC/丹酚酸C对NF - κB 的抑制作用[2] 在信号通路研究中,我们使用特异的Nrf2 siRNA来阐明Nrf2与NF - κB p65之间的相互作用。利用AMPK抑制剂化合物C研究Nrf2上游蛋白。结果表明,复方C在BV2小胶质细胞和原代小胶质细胞中均逆转了SalC对Nrf2的激活作用。此外,化合物C预孵育也逆转了SalC对NF - κB的抑制作用。用Nrf2 siRNA处理可逆转SalC对NF - κB的抑制作用(图10)。上述结果表明,AMPK/Nrf2信号通路参与了SalC对NF - κB和神经炎症的抑制作用。 |
| 体内研究 (In Vivo) |
丹酚酸 C (20 mg/kg) 处理显着降低了逃避潜伏期。此外,与LPS模型组相比,丹酚酸C(10和20mg/kg)治疗组的平台穿越次数显着更高。与模型组相比,全身注射丹酚酸 C 可以降低大鼠脑组织 TNF-α、IL-1β 和 IL-6 水平。大脑皮层和海马体用于 iNOS 和 COX-2 水平的建模。丹参酚酸 C(5、10 和 20 mg/kg)治疗显着降低了皮质和海马的水平,而 p-AMPK、Nrf2、HO-1 和 NQO1 的水平呈剂量依赖性增加[2]。
SalC/丹酚酸C抑制大鼠神经炎症,改善记忆行为[2] 脂多糖诱导SD大鼠神经炎症。如图7A所示,Morris水迷宫实验中,LPS模型组大鼠的逃避潜伏期明显高于对照组(P < 0.01),而SalC(20 mg/kg)处理可显著降低大鼠的逃避潜伏期(P < 0.05)。此外,LPS模型组大鼠与对照组大鼠相比,穿越部位次数较少。与LPS模型组相比,SalC(10和20 mg/kg)处理显著增加了平台穿越次数(P < 0.05和P < 0.01,图7B)。上述结果表明,LPS模型组大鼠空间学习记忆功能受损,而SalC处理可减轻该损伤。与模型组相比,全身给药LPS可显著上调大鼠脑TNF - α、IL - 1β和IL - 6水平,而SalC可下调大鼠脑TNF - α、IL - 1β和IL - 6水平(图7C)。大鼠大脑皮层和海马区的iNOS和COX‑2水平高于对照组,而SalC处理显著下调了大鼠大脑皮层和海马区的iNOS和COX‑2水平(图7D-F)。进一步的免疫荧光研究表明,LPS增加了皮层和海马中GFAP和Iba1阳性细胞的荧光强度,SalC处理抑制了LPS诱导的神经炎症,降低了GFAP和Iba1的荧光强度(图7G-I)。 SalC/丹酚酸C激活AMPK/Nrf2,抑制NF - κB信号通路[2] 如图8所示,SalC(5、10和20 mg/kg)剂量依赖性地增加了大鼠大脑皮层和海马中p - AMPK、Nrf2、HO - 1和NQO1的水平。此外,全身给药LPS诱导NF - κB信号通路的激活,而SalC(5、10和20 mg/kg)剂量依赖性地抑制NF - κB p65磷酸化和i - κBα磷酸化(图9)。 |
| 酶活实验 |
酶动力学分析[1]
分别测定紫杉醇6-羟基化和阿斯咪唑o -去甲基阿斯咪唑对CYP2C8和CYP2J2的探针活性。制备了总体积为200 μL的培养混合物,培养混合物中有机溶剂的最终浓度小于1% (v/v)。孵育混合物如下:重组P450酶、nadph生成系统(10 mM葡萄糖6-磷酸、0.5 mM NADP、10 mM MgCl2、1单位葡萄糖6-磷酸脱氢酶)、100 mM磷酸钾缓冲液(pH 7.4)和一定浓度的探针底物。紫杉醇和阿斯咪唑在甲醇中溶解。在37 °C下进行5分钟的预孵育,然后加入nadph生成系统开始反应。根据初步实验(补充表1),所有孵育均在时间和蛋白浓度线性条件下进行。在培养混合物中加入不同浓度的紫杉醇(0.2 ~ 50 μmol· L−1)和阿斯咪唑(0.05 ~ 50 μmol· L−1)。使用Michaelis-Menten模型(GraphPad Prism 5, CA, USA)对酶活性-底物浓度数据进行非线性回归分析,确定了不同浓度的标记底物的Km(作用速率为其最大速度的一半时的底物浓度)和Vmax(给定条件下酶催化反应的最大初始速度)值。采用液相色谱-串联质谱(LC-MS/MS)测定培养混合物中代谢物的最终浓度。 筛选丹参类化合物对CYP2C8和CYP2J2的抑制作用[1] 孵育混合物中含有CYP2C8或CYP2J2、nadph生成系统、底物(终浓度 ~ Km)和单一测试化合物的不同浓度(0-50 μmol·L−1),在100 mM磷酸盐缓冲液(pH 7.4)中孵育。亲水组分(丹酚酸,SAs,例如丹酚酸C)溶解在水中,亲脂组分(TSTs)溶解在二甲亚砜中,其最终浓度小于混合物的1% (v/v)。以槲皮素和那那唑分别作为CYP2C8和CYP2J2的阳性对照。所有孵育均为三次,取平均值进行分析。 在抑制剂存在的情况下,CYP2C8和CYP2J2的活性以相应对照的百分比表示。从抑制百分比与逻辑抑制剂浓度的图中,通过使用非线性回归分析将剩余酶活性百分比(Y)与初始抑制剂浓度(X)数据的对数拟合到eq.(1)中,计算相应的IC50值(酶抑制50%所需的抑制剂浓度)。 (1)Y = 100/(1 + 10X−LogIC50) 抑制型研究[1] 当IC50值低于15 μmol·L−1时,测定丹参组分对特定CYPs的抑制类型和Ki值(抑制剂的抑制常数,等于酶/抑制剂复合物的解离常数)。采用紫杉醇(2.5、5和10 μmol·L−1)、阿斯米唑(0.5、1和2 μmol·L−1)和不同浓度的丹参成分构建Lineweaver-Burk和Dixon图,并估计其抑制类型和Ki值。其他程序与可逆抑制研究相似。 时间依赖性抑制研究[1] 当IC50值小于5 μmol·L−1时,采用传统的IC50移位法测定丹参组分对CYP2C8和CYP2J2的抑制作用。几种不同浓度的测试化合物与重组CYPs(2至10倍浓度)预孵育,有或没有nadph生成系统,在37 °C下,15 min。失活孵育后,将等分液(20-100 μL)转移到含有nadph生成系统和CYPs底物的新鲜孵育管(终体积200 μL)中。孵育、淬火、样品提取和分析程序与抑制型研究相同。 根据nadph生成系统的存在和不存在(式(5))确定的IC50值来计算IC50移位,明显的左移位(IC50移位bbbb2)表明存在基于机制的失活剂。 (5)IC50shift = IC50(-NADPH) / IC50(+NADPH) DI对CYP2C8 抑制作用的时间和浓度依赖性测定[1] 预孵育混合物中含有100 mmol·L−1磷酸钾缓冲液(pH 7.4)、重组CYP2C8(10 nmol·L−1)和各种浓度(0.5 ~ 8 μmol·L−1)的DI,总体积为100 μL。单独加入溶剂制备不含试验化合物的对照样品。在37 °C的预孵育液中,加入20 μL的nadph生成系统,继续孵育30 min。在孵育0、5、10、20和30 min时,收集50 μL的混合物,加入到由100 mM磷酸钾缓冲液(pH 7.4)、10 μmol·L−1紫杉醇和nadph生成系统组成的测定混合物(50 μL)中,用于测定紫杉醇羟化酶活性。将CYP2C8活性测定液在37 ℃下孵育20 min 后,加入100 μL乙腈制咪达唑仑终止反应。采用LC-MS/MS法测定6-羟基紫杉醇的浓度。 标记代谢物的测定[1] 采用部分验证的LC-MS/MS方法对紫杉醇的6-羟基化代谢物进行定量分析。重组CYP2C8体系在37 °C孵育后,加入100 μL的乙腈(内标)配制的20.16 ng·mL−1咪达唑仑停止反应。涡流混合1 min,然后以12,000 rpm离心10 min。将得到的上清液5 μL注入到由安捷伦1100系列高效液相色谱系统与API 4000质谱联用组成的LC-MS/MS系统中,该系统配备电喷雾电离(ESI)源进行离子生成。色谱柱为C18(1.8 μm, 100 × 4.6 mm;Agilent, USA)和分析物用乙腈(A)和0.1%甲酸水溶液(B)洗脱,流速为0.4 mL·min - 1,使用以下梯度程序:0-0.3 min, 60% A;0.3-2 min, 60%-90% A;2-4 min, 90% A;4-5.1min, 90%-60% a,柱温保持在40 °C。离子喷雾电压设置为5.0 kV进行正离子电离,加热器气体温度为550 ℃。氮气用作雾化气体(50psi)、辅助气体(55psi)和幕帘气体(15psi)。对6-羟基紫taxol m/z 870.4 ~ 286.3和咪达唑安定m/z 326.3 ~ 291.1的前体离子到产物离子的跃迁进行了多重反应监测(MRM)实验,前者的聚类势(DP)为60 V,碰撞能(CE)为−23 eV,后者的DP为60 V, CE为40 eV,没有内部干扰。6-羟基紫杉醇在1.17 ~ 117 nmolmL−1的浓度范围内呈线性。日内、日间精密度(CV%)分别小于2.7 ~ 8.2%和4.8 ~ 11.4%,准确度分别为96.2 ~ 109.5%和101.6 ~ 106.5%。在浓度为2.00、10.0和80.0 nmol·mL−1时,平均回收率为97.6 ~ 100.3%,基质效应为87.3 ~ 92.4%。在自动进样器条件下,6-羟基紫杉醇在处理后的样品中稳定(92.1-103.3%)至少24 h。 |
| 细胞实验 |
BV2小胶质细胞与原代大鼠小胶质细胞的培养及分组[2]
采用终浓度为1 μg/mL的LPS刺激建立细胞损伤模型。实验分为以下组:正常对照组(培养基),LPS刺激模型组(1 μg / mL有限合伙人),Salvianolic Acid C/ SalC低剂量组(1 μg / mL有限合伙人 + 0.1μM SalC), SalC中间剂量组(1 μg / mL有限合伙人 + 1 μM SalC),和SalC高剂量组(1 μg / mL有限合伙人 + 5 μM SalC)。BV2和原代小胶质细胞均用20 μM AMPK抑制剂化合物C预孵育1 h,然后用SalC处理。 MTT试验[2] MTT法测定Salvianolic Acid C /SalC对细胞活力的影响。首先,以1 × 104个细胞/孔的密度在96孔板上接种BV2小胶质细胞。然后将细胞与不同浓度的SalC和1 μg/mL LPS共孵育24 h。随后,移除上清液,并在每口井中加入MTT。孵育4 h后,每孔加入100 μL DMSO,在SpectraMax M5酶标仪上测定490 nm波长处的吸光度。 NO检测[2] 采用Griess法检测上清液中NO水平。实验结束时,将50 μL上清液转入新孔。然后加入50 μL Griess Reagent I混合。加入Griess试剂II 50 mL混合。最后,在540 nm处测量吸光度,计算NO浓度。 酶联免疫吸附试验(ELISA) [2] LPS刺激和Salvianolic Acid C /SalC孵育后,收集培养基上清液。炎症介质TNF - α、IL - 1β、IL - 6、IL - 10和PGE2的浓度根据生产厂家说明书采用相应的ELISA试剂盒检测。同时收集对照组、LPS模型组和LPS + SalC处理组大鼠脑组织中炎症介质TNF - α、IL - 1β、IL - 6浓度,并按上述说明书进行测定。 免疫荧光测定[2] 免疫荧光法观察iNOS和p‑NF‑κB p65的表达或细胞内定位。首先,将BV2小胶质细胞以1 × 每孔104个细胞的密度接种于96孔板上,孵育24 h。不同浓度Salvianolic Acid C/SalC与LPS共孵育24 h后,取出上清液。用4%多聚甲醛固定BV2小胶质细胞15 min。细胞用0.3% Triton X-100孵育10 min,随后用5% BSA阻断1 h,用抗iNOS和p‑NF‑κB p65一抗在4 °C孵育过夜。然后加入荧光二抗,孵育1.5 h。加入Hoechst 33258孵育30 min。最后,在Cellomics ArrayScan®VTI成像平台下获取荧光图像并进行测量 Nrf2 siRNA转染[2] 细胞接种于6孔板。24 h后,每孔加入0.8 mL siRNA转染培养基。与Nrf2 siRNA或对照siRNA孵育6 h后,再次加入正常培养基。细胞与不同浓度Salvianolic Acid C/SalC和1 μg/mL LPS孵育24 h。最后进行酶联免疫吸附试验、免疫荧光试验和免疫印迹法。 |
| 动物实验 |
Systemic neuroinflammation animal model and drug treatment [2]
Sprague–Dawley (SD) rats (210–240 g) were housed under a temperature of 21–24 °C, with a 12 h light/12 h dark cycle and a relative humidity of 50%. Rats were randomly divided into five groups (n = 12 for each group): control group, LPS model group and LPS + Salvianolic Acid C/SalC treated groups (SalC at 5, 10 and 20 mg/kg/day doses). Systemic administration of LPS was used to induce neuroinflammation in rats, which was approved by many previous reported studies. Rat systemic neuroinflammation was induced according to the previous reported procedure. Briefly, to induce systemic inflammation, LPS model group rats were i.p. administered with LPS in normal saline at 500 μg/kg dose for seven days. And during the seven days, the control group rats were i.p. administrated with only normal saline. The LPS + SalC treated groups were i.p. administered with SalC at doses of 5, 10, or 20 mg/kg each day 1 h after LPS injection for also seven days. Morris water maze test was performed 3 h after SalC injection. |
| 参考文献 | |
| 其他信息 |
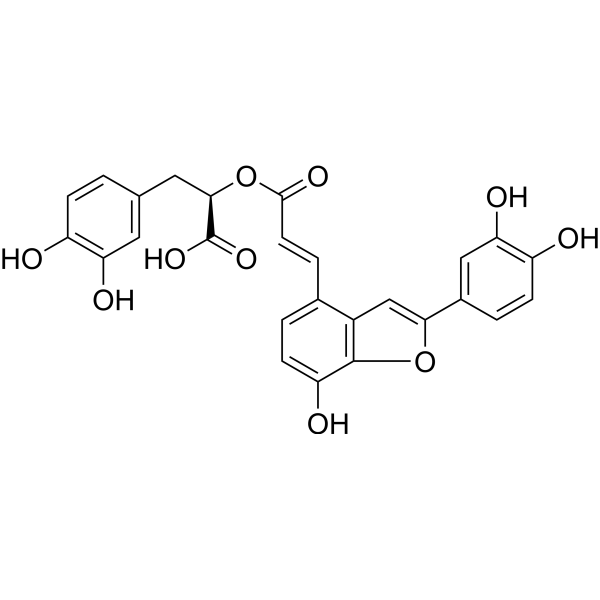
Salvianolic acid C is a member of benzofurans.
Salvianolic acid C has been reported in Salvia miltiorrhiza, Origanum vulgare, and other organisms with data available. The use of Chinese herbal medicines and natural products has become increasingly popular in both China and Western societies as an alternative medicine for the treatment of diseases or as a health supplement. Danshen, the dried root of Salvia miltiorrhiza (Fam.Labiatae), which is rich in phenolic acids and tanshinones, is a widely used herbal medicine for the treatment of cardio-cerebrovascular diseases. The goal of this study was to examine the inhibitory effects of fifteen components derived from Danshen on CYP2C8 and CYP2J2, which are expressed both in human liver and cardiovascular systems. Recombinant CYP2C8 and CYP2J2 were used, and the mechanism, kinetics, and type of inhibition were determined. Taxol 6-hydroxylation and astemizole O-desmethyastemizole were determined as probe activities for CYP2C8 and CYP2J2, respectively. Metabolites formations were analyzed using liquid chromatography-tandem mass spectrometry (LC-MS/MS). The results demonstrated that salvianolic acid A was a competitive inhibitor of CYP2C8 (Ki = 2.5 μM) and mixed-type inhibitor of CYP2J2 (Ki = 7.44 μM). Salvianolic Acid C had moderate noncompetitive and mixed-type inhibitions on CYP2C8 (Ki = 4.82 μM) and CYP2J2 (Ki = 5.75 μM), respectively. Tanshinone IIA was a moderate competitive inhibitor of CYP2C8 (Ki = 1.18 μM). Dihydrotanshinone I had moderate noncompetitive inhibition on CYP2J2 (Ki = 6.59 μM), but mechanism-based inhibition on CYP2C8 (KI = 0.43 μM, kinact = 0.097 min-1). Tanshinone I was a moderate competitive inhibitor of CYP2C8 (Ki = 4.20 μM). These findings suggested that Danshen preparations appear not likely to pose a significant risk of drug interactions mediated by CYP2C8 after oral administration; but their inhibitory effects on intestinal CYP2J2 mediated drug metabolism should not be neglected when they are given orally in combination with other drugs. Additionally, this study provided novel insights into the underling pharmacological mechanisms of Danshen components from the perspective of CYP2C8 and CYP2J2 inhibition. [1] In summary, our data indicate that TI, TIIA, Cry, DI, SAA, SAB and Salvianolic Acid C/SAC have inhibitory effects, to a varying degree, on CYP2C8 or CYP2J2 with IC50 values lower than 50 μmol·L−1. However, the IC50/Ki values determined in the current study are more than fifty times higher than the reported plasma concentration of these compounds in healthy humans following oral dosing of Danshen preparations. Therefore, neither Danshen preparations nor these components appear likely to pose a significant risk of drug interactions mediated by CYP2C8 after oral administration; however, their inhibitory effects on intestinal CYP2J2 mediated drug metabolism should not be neglected when they are given in combination with other drugs. Additionally, this study provided new insights into the underling pharmacological mechanisms of Danshen components from the perspective of CYP2C8 and CYP2J2 inhibition, which are very useful for deep understanding the interactions between Danshen and drug metabolizing enzymes.[1] Neurodegenerative diseases are closely related to neuroinflammation. Drugs targeting inflammation have been proved to be effective in many animal models. Salvianolic Acid C (SalC) is a compound isolated from Salvia miltiorrhiza Bunge, a plant with reported effects of inhibiting inflammation. However, the anti-inflammation effects and biological mechanisms of SalC on LPS-stimulated neuroinflammation remain unknown. The aim of this paper was to study its protective effects and its anti-inflammation mechanisms. LPS was used both in vivo and in vitro to induce neuroinflammation in SD rats and microglia cells. MTT assay was carried out to detect cell viability. The levels of TNF‑α, IL‑1β, IL‑6, IL‑10 and PGE2 were detected by ELISA method. The expressions of p‑AMPK, p‑NF‑κB p65, p‑IκBα, Nrf2, HO‑1 and NQO1 proteins were examined by Western blot analysis. The nuclear translocation of NF‑κB p65 was studied by immunofluorescence assay. The specific Nrf2 siRNA was used to clarify the interaction between Nrf2 and NF‑κB p65. The AMPK inhibitor Compound C was used study the upstream protein of Nrf2. Results showed that LPS induced the overexpression of inflammatory cytokines and mediated the phosphorylation and nuclear translocation of NF‑κB p65 in rat brains and microglia cells. SalC reversed the inflammatory response induced by LPS and inhibited the NF‑κB activation. SalC also upregulated the expression of p‑AMPK, Nrf2, HO‑1 and NQO1. But the anti-inflammation and NF‑κB inhibition effects of SalC were attenuated by transfection with specific Nrf2 siRNA or interference with the potent AMPK inhibitor Compound C. In conclusion, SalC inhibited LPS-induced inflammatory response and NF‑κB activation through the activation of AMPK/Nrf2 signaling both in vivo and in vitro. [2] In summary, the above results demonstrated that Salvianolic Acid C/SalC inhibited LPS-induced production of inflammatory cytokines through the inactivation of NF‑κB signaling. And the inactivation of NF‑κB was triggered by AMPK/Nrf2 signaling.[2] |
| 分子式 |
C26H20O10
|
|---|---|
| 分子量 |
492.4310
|
| 精确质量 |
492.105
|
| CAS号 |
115841-09-3
|
| PubChem CID |
13991590
|
| 外观&性状 |
Light yellow to yellow solid powder
|
| 密度 |
1.6±0.1 g/cm3
|
| 沸点 |
844.2±65.0 °C at 760 mmHg
|
| 闪点 |
464.4±34.3 °C
|
| 蒸汽压 |
0.0±3.3 mmHg at 25°C
|
| 折射率 |
1.752
|
| LogP |
3.12
|
| tPSA |
177.89
|
| 氢键供体(HBD)数目 |
6
|
| 氢键受体(HBA)数目 |
10
|
| 可旋转键数目(RBC) |
8
|
| 重原子数目 |
36
|
| 分子复杂度/Complexity |
802
|
| 定义原子立体中心数目 |
1
|
| SMILES |
C1=CC(=C(C=C1C[C@H](C(=O)O)OC(=O)/C=C/C2=C3C=C(OC3=C(C=C2)O)C4=CC(=C(C=C4)O)O)O)O
|
| InChi Key |
GCJWPRRNLSHTRY-VURDRKPISA-N
|
| InChi Code |
InChI=1S/C26H20O10/c27-17-5-1-13(9-20(17)30)10-23(26(33)34)35-24(32)8-4-14-2-7-19(29)25-16(14)12-22(36-25)15-3-6-18(28)21(31)11-15/h1-9,11-12,23,27-31H,10H2,(H,33,34)/b8-4+/t23-/m1/s1
|
| 化学名 |
(2R)-3-(3,4-dihydroxyphenyl)-2-[(E)-3-[2-(3,4-dihydroxyphenyl)-7-hydroxy-1-benzofuran-4-yl]prop-2-enoyl]oxypropanoic acid
|
| 别名 |
Salvianolic acid C; 115841-09-3; UNII-I16H9Z53ZL; I16H9Z53ZL; (2R)-3-(3,4-dihydroxyphenyl)-2-[(E)-3-[2-(3,4-dihydroxyphenyl)-7-hydroxy-1-benzofuran-4-yl]prop-2-enoyl]oxypropanoic acid; Benzenepropanoic acid, alpha-(((2E)-3-(2-(3,4-dihydroxyphenyl)-7-hydroxy-4-benzofuranyl)-1-oxo-2-propen-1-yl)oxy)-3,4-dihydroxy-, (alphaR)-; Benzenepropanoic acid, alpha-[[(2E)-3-[2-(3,4-dihydroxyphenyl)-7-hydroxy-4-benzofuranyl]-1-oxo-2-propen-1-yl]oxy]-3,4-dihydroxy-, (alphaR)-; BENZENEPROPANOIC ACID, .ALPHA.-(((2E)-3-(2-(3,4-DIHYDROXYPHENYL)-7-HYDROXY-4-BENZOFURANYL)-1-OXO-2-PROPEN-1-YL)OXY)-3,4-DIHYDROXY-, (.ALPHA.R)-;
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month 注意: 请将本产品存放在密封且受保护的环境中(例如氮气保护),避免吸湿/受潮和光照。 |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO : ~50 mg/mL (~101.54 mM)
|
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (5.08 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (5.08 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.0307 mL | 10.1537 mL | 20.3075 mL | |
| 5 mM | 0.4061 mL | 2.0307 mL | 4.0615 mL | |
| 10 mM | 0.2031 mL | 1.0154 mL | 2.0307 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。