| 规格 | 价格 | 库存 | 数量 |
|---|---|---|---|
| 10 mM * 1 mL in DMSO |
|
||
| 2mg |
|
||
| 5mg |
|
||
| 10mg |
|
||
| 25mg |
|
||
| 50mg |
|
||
| 100mg |
|
||
| 250mg |
|
||
| 500mg |
|
||
| Other Sizes |
|
| 靶点 |
SIRT2 (IC50 = 10 μM); SIRT1 (IC50 = 21 μM); SIRT3 (IC50 = 67 μM); HDAC8; MDM-2/p53
The primary targets of Tenovin-6 include class III HDACs (SIRT1, SIRT2), dihydroorotate dehydrogenase (DHODH), and autophagic flux-related proteins (indirect regulation). - SIRT1: IC50 = 2.5 μM (fluorescence-based deacetylation assay) [3] - SIRT2: IC50 = 1.8 μM (same assay as SIRT1) [3] ; - DHODH: Ki = 0.3 μM (enzyme activity assay, monitoring dihydroorotate oxidation) [2] ; |
|---|---|
| 体外研究 (In Vitro) |
Tenovin-6 比水溶性较差的 tenovin-1 对酵母的毒性更大,其 IC50 为 30 μM,可抑制酿酒酵母培养物的生长。在 MCF-7 细胞中,tenovin-6 显着提高内源 K382-Ac p53 水平[1]。 Tenovin-6(0 至 15 μM)剂量依赖性地增加不同细胞类型中 LC3-II 的水平,并且这种增加与 ATG5/7 相关。此外,使用 tenovin-6 可以防止由 torin 1 引起的 SQSTM1/p62 降解,并提高有或没有 torin 1 的自噬囊泡的数量和强度。自噬体和溶酶体之间的融合不受 tenovin-6 的影响,但会影响自溶酶体的酸化和溶酶体的水解活性。 Tenovin-6 抑制自噬,但不抑制 p53 激活,通过敲低或敲除来抑制 Sirtuin 1 不能模拟 tenovin-6 对 LC3B 积累的影响[3]。 Tenovin-6 (0、1、2.5、5 或 10 μM) 以剂量和时间依赖性方式有效抑制所有 OCI-Ly1、DHL-10、U2932、RIVA、HBL1 和 OCI-Ly10 细胞系的细胞增殖。 Tenovin-6 通过抑制传统的自噬途径而不激活 p53,持续升高 DLBCL 细胞系中 LC3B-II 的水平,且升高与 SIRT1/2/3 和 p53 无关。通过外源性细胞死亡途径,tenovin-6 引起细胞凋亡[4]。 Tenovin-6 抑制 UM 细胞的生长,对 12.8 μM、11.0 μM、14.58 μM 和 9.62 μM 细胞的 IC50 值分别为 92.1、Mel 270、Omm 1 和 Omm 2.3 [5]。
葡萄膜黑色素瘤(UM)细胞抗增殖活性(文献[3]):1)OCM-1A细胞(UM):IC50=1.2 μM(MTT法,72小时);2)C918细胞(UM):IC50=1.5 μM(相同实验);3)5 μM Tenovin-6使克隆形成减少82%(vs对照组),并清除癌症干细胞(CSCs,CD133⁺细胞从18%降至2.1%,流式细胞术)。[3] - p53通路激活(文献[3]):1)2 μM Tenovin-6处理OCM-1A细胞24小时:Western blot显示乙酰化p53(3.2倍)、p21(4.5倍)和Cleaved Caspase-3(5.8倍)上调;2)siRNA敲低p53逆转65%的抗增殖效应,证实p53依赖性。[3] - DHODH抑制(文献[2]):1)1 μM Tenovin-6处理A549细胞48小时:尿苷合成减少72%(HPLC检测);2)外源性尿苷(100 μM)逆转80%的细胞生长抑制,证实嘧啶合成阻断。[2] - 自噬抑制(文献[4][5]):1)HeLa细胞(文献[4]):2 μM Tenovin-6处理24小时,LC3-II(3.8倍)和p62(4.2倍)水平升高(Western blot),提示自噬流阻断;2)弥漫大B细胞淋巴瘤(DLBCL)细胞(文献[5]):3 μM Tenovin-6减少自噬体-溶酶体融合(免疫荧光:LC3斑点与LAMP1共定位减少68%)。[4][5] |
| 体内研究 (In Vivo) |
Tenovin-6(50 mg/kg,腹膜内注射)可预防小鼠肿瘤生长[1]。
葡萄膜黑色素瘤异种移植模型(文献[3]):携带OCM-1A异种移植瘤的雌性BALB/c裸鼠(6-8周龄)随机分为3组(每组6只):1)溶媒组(5% DMSO + 95%玉米油,灌胃,每日1次);2)Tenovin-6 15 mg/kg组(口服,每日1次);3)Tenovin-6 30 mg/kg组(口服,每日1次)。28天后:1)肿瘤生长抑制率(TGI)=62%(15 mg/kg)和85%(30 mg/kg);2)肿瘤重量:15 mg/kg组0.45 g,30 mg/kg组0.22 g,对照组1.38 g;3)肿瘤免疫组化:CD133⁺ CSCs减少78%(30 mg/kg),乙酰化p53和Cleaved Caspase-3阳性细胞增加3.5倍。[3] - DLBCL异种移植模型(文献[5]):携带SU-DHL-4异种移植瘤的NOD/SCID小鼠用Tenovin-6 20 mg/kg(腹腔注射,每日1次)处理21天:1)TGI=72%(vs溶媒对照);2)肿瘤自噬标志物(LC3-II、p62)增加2.8倍(Western blot),证实体内自噬抑制。[5] |
| 酶活实验 |
在 Fluor de Lys 荧光检测系统中,使用纯化的成分进行检测。使用 1 mM 的 NAD+ 和 7 μM 的相关 FdL 底物。反应中的最终DMSO浓度低于0.25%,因此tenovin在DMSO中溶解。与SirT2和SirT3相比,SirT1和HDAC8各需要1个单位的酶,而SirT2和SirT3需要5个单位。反应在37℃下进行一小时。
SIRT1/SIRT2去乙酰化实验(文献[3]):1)将重组人SIRT1/SIRT2(10 nM)与荧光标记的乙酰化组蛋白H3肽(50 μM)在反应缓冲液(50 mM Tris-HCl,1 mM NAD⁺,pH8.0)中混合;2)加入Tenovin-6(0.1 μM至20 μM),37°C孵育60分钟;3)10%三氯乙酸终止反应,测定荧光强度(激发360 nm,发射460 nm);4)抑制率拟合四参数逻辑模型计算IC50。[3] - DHODH酶活性实验(文献[2]):1)将纯化人DHODH(20 nM)与二氢乳清酸(100 μM)、泛醌(50 μM)在实验缓冲液(20 mM Tris-HCl,pH7.5)中孵育;2)加入Tenovin-6(0.01 μM至5 μM),37°C监测290 nm处吸光度(二氢乳清酸氧化)30分钟;3)双倒数作图法(Lineweaver-Burk)计算Ki。[2] |
| 细胞实验 |
MTS 测定用于评估细胞活力。在 96 孔板中,将 UM 细胞接种到每个孔中(5,000 个细胞/孔),第二天用对照或 Tenovin-6(浓度从 0 增加到 20 μM)处理 68 小时,然后添加 20 μL MTS /well 在 490 nm 波长下读取。 IC50通过曲线拟合S形剂量反应曲线来计算。
葡萄膜黑色素瘤细胞增殖实验(文献[3]):1)OCM-1A/C918细胞以3×10³细胞/孔接种于96孔板,过夜培养;2)加入Tenovin-6(0.1 μM至10 μM),37°C、5% CO₂孵育72小时;3)加入10 μL MTT(5 mg/mL),孵育4小时;DMSO溶解甲瓒;4)测定570 nm处吸光度;细胞活力=(处理组/对照组吸光度)×100%;GraphPad Prism计算IC50。[3] - 自噬流实验(文献[4]):1)转染GFP-LC3质粒的HeLa细胞接种于24孔板,用2 μM Tenovin-6处理24小时;2)4%多聚甲醛固定细胞,DAPI染核;3)荧光显微镜计数GFP-LC3斑点(自噬体),ImageJ分析与溶酶体标志物LAMP1的共定位。[4] - 癌症干细胞球形成实验(文献[3]):1)OCM-1A细胞(1×10³细胞/孔)接种于超低吸附板,使用干细胞培养基;2)加入Tenovin-6(1 μM、3 μM),每2天换液;3)7天后计数直径>50 μm的球;球形成率=(处理组/对照组球数量)×100%。[3] |
| 动物实验 |
50 mg/kg
ARN8 melanoma cells were injected into the flank of SCID mice and allowed to develop into tumors. OCM-1A xenograft protocol (literature [3]): 1) Female BALB/c nude mice (6-8 weeks old) were acclimated for 1 week; 2) 5×10⁶ OCM-1A cells (suspended in Matrigel:PBS = 1:1) were subcutaneously injected into right flank; 3) When tumors reached 100-150 mm³, mice were randomized into 3 groups (n=6): Vehicle (5% DMSO + 95% corn oil, oral gavage, 0.2 mL/mouse, once daily); Tenovin-6 15 mg/kg (dissolved in vehicle, oral, once daily); Tenovin-6 30 mg/kg (same vehicle/route); 4) Tumor volume (length × width² / 2) and body weight were measured every 3 days; after 28 days, mice were euthanized, tumors harvested for IHC/Western blot. [3] - SU-DHL-4 xenograft protocol (literature [5]): 1) NOD/SCID mice (6-8 weeks old, male) were acclimated for 1 week; 2) 2×10⁶ SU-DHL-4 cells (suspended in PBS) were subcutaneously injected into right flank; 3) When tumors reached 150 mm³, mice were treated with Tenovin-6 20 mg/kg (dissolved in 5% DMSO + 10% Cremophor EL + 85% saline, intraperitoneal injection, 0.1 mL/mouse, once daily) or vehicle; 4) After 21 days, mice were euthanized, tumors collected for autophagy marker detection. [5] |
| 毒性/毒理 (Toxicokinetics/TK) |
Subchronic toxicity in xenograft mice (literatures [3][5]): 1) BALB/c nude mice (literature [3]): Tenovin-6 30 mg/kg (oral, 28 days) caused 7% body weight loss (recovered by day 21), serum ALT/AST/BUN/Cr within normal ranges; 2) NOD/SCID mice (literature [5]): Tenovin-6 20 mg/kg (i.p., 21 days) showed no liver/kidney histopathological damage, WBC count unchanged vs. control. [3][5]
- Plasma protein binding (literature [2]): Human plasma binding rate of Tenovin-6 = 91.5 ± 2.4% (ultrafiltration assay, n=3). [2] |
| 参考文献 |
|
| 其他信息 |
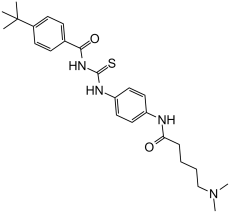
Tenovin-6 is a monocarboxylic acid amide obtained by formal condensation of the carboxy group of 5-(dimethylamino)pentanoic acid with the aromatic amino group of N-[(4-aminophenyl)carbamothioyl]-4-tert-butylbenzamide. It has a role as an antineoplastic agent, a Sir2 inhibitor and a p53 activator. It is a monocarboxylic acid amide, a member of thioureas and a tertiary amino compound.
Core mechanism of Tenovin-6 (literatures [2][3][4][5]): 1) SIRT1/SIRT2 inhibition: Stabilizes acetyl-p53, activates p21/Bax-mediated apoptosis/cell cycle arrest [3]; 2) DHODH inhibition: Blocks de novo pyrimidine synthesis, limits cancer cell proliferation [2]; 3) Autophagy inhibition: Blocks autophagosome-lysosome fusion, enhances apoptosis by reducing "autophagic survival" [4][5]. [2][3][4][5] - Therapeutic advantage (literature [3]): Tenovin-6 eliminates uveal melanoma CSCs (CD133⁺ cells), addressing CSC-mediated recurrence; its efficacy is 2-3 fold higher than Tenovin-1 (IC50 1.2 μM vs. 3.5 μM in OCM-1A cells). [3] - Clinical relevance (literature [5]): Tenovin-6 is effective in diffuse large B-cell lymphoma (DLBCL) cells resistant to rituximab (IC50 3.2 μM in rituximab-resistant SU-DHL-4/R cells), providing a new option for refractory DLBCL. [5] |
| 分子式 |
C25H34N4O2S
|
|---|---|
| 分子量 |
454.63
|
| 精确质量 |
454.24
|
| CAS号 |
1011557-82-6
|
| 相关CAS号 |
Tenovin-6 Hydrochloride;1011301-29-3
|
| PubChem CID |
24772043
|
| 外观&性状 |
White to off-white solid
|
| 密度 |
1.2±0.1 g/cm3
|
| 折射率 |
1.617
|
| LogP |
3.64
|
| tPSA |
105.56
|
| 氢键供体(HBD)数目 |
3
|
| 氢键受体(HBA)数目 |
4
|
| 可旋转键数目(RBC) |
9
|
| 重原子数目 |
32
|
| 分子复杂度/Complexity |
616
|
| 定义原子立体中心数目 |
0
|
| SMILES |
O=C(NC(NC1=CC=C(NC(CCCCN(C)C)=O)C=C1)=S)C2=CC=C(C(C)(C)C)C=C2
|
| InChi Key |
BVJSXSQRIUSRCO-UHFFFAOYSA-N
|
| InChi Code |
InChI=1S/C25H34N4O2S/c1-25(2,3)19-11-9-18(10-12-19)23(31)28-24(32)27-21-15-13-20(14-16-21)26-22(30)8-6-7-17-29(4)5/h9-16H,6-8,17H2,1-5H3,(H,26,30)(H2,27,28,31,32)
|
| 化学名 |
4-tert-butyl-N-[[4-[5-(dimethylamino)pentanoylamino]phenyl]carbamothioyl]benzamide
|
| 别名 |
Tenovin-6; Tenovin6; Tenovin 6
|
| HS Tariff Code |
2934.99.9001
|
| 存储方式 |
Powder -20°C 3 years 4°C 2 years In solvent -80°C 6 months -20°C 1 month |
| 运输条件 |
Room temperature (This product is stable at ambient temperature for a few days during ordinary shipping and time spent in Customs)
|
| 溶解度 (体外实验) |
DMSO: ~98 mg/mL (~215.6 mM)
Water: <1 mg/mL (slightly soluble or insoluble) Ethanol: <1 mg/mL (slightly soluble or insoluble) |
|---|---|
| 溶解度 (体内实验) |
配方 1 中的溶解度: ≥ 2.5 mg/mL (5.50 mM) (饱和度未知) in 10% DMSO + 40% PEG300 + 5% Tween80 + 45% Saline (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。
例如,若需制备1 mL的工作液,可将100 μL 25.0 mg/mL澄清DMSO储备液加入到400 μL PEG300中,混匀;然后向上述溶液中加入50 μL Tween-80,混匀;加入450 μL生理盐水定容至1 mL。 *生理盐水的制备:将 0.9 g 氯化钠溶解在 100 mL ddH₂O中,得到澄清溶液。 配方 2 中的溶解度: ≥ 2.5 mg/mL (5.50 mM) (饱和度未知) in 10% DMSO + 90% (20% SBE-β-CD in Saline) (这些助溶剂从左到右依次添加,逐一添加), 澄清溶液。 例如,若需制备1 mL的工作液,可将 100 μL 25.0 mg/mL澄清DMSO储备液加入900 μL 20% SBE-β-CD生理盐水溶液中,混匀。 *20% SBE-β-CD 生理盐水溶液的制备(4°C,1 周):将 2 g SBE-β-CD 溶解于 10 mL 生理盐水中,得到澄清溶液。 请根据您的实验动物和给药方式选择适当的溶解配方/方案: 1、请先配制澄清的储备液(如:用DMSO配置50 或 100 mg/mL母液(储备液)); 2、取适量母液,按从左到右的顺序依次添加助溶剂,澄清后再加入下一助溶剂。以 下列配方为例说明 (注意此配方只用于说明,并不一定代表此产品 的实际溶解配方): 10% DMSO → 40% PEG300 → 5% Tween-80 → 45% ddH2O (或 saline); 假设最终工作液的体积为 1 mL, 浓度为5 mg/mL: 取 100 μL 50 mg/mL 的澄清 DMSO 储备液加到 400 μL PEG300 中,混合均匀/澄清;向上述体系中加入50 μL Tween-80,混合均匀/澄清;然后继续加入450 μL ddH2O (或 saline)定容至 1 mL; 3、溶剂前显示的百分比是指该溶剂在最终溶液/工作液中的体积所占比例; 4、 如产品在配制过程中出现沉淀/析出,可通过加热(≤50℃)或超声的方式助溶; 5、为保证最佳实验结果,工作液请现配现用! 6、如不确定怎么将母液配置成体内动物实验的工作液,请查看说明书或联系我们; 7、 以上所有助溶剂都可在 Invivochem.cn网站购买。 |
| 制备储备液 | 1 mg | 5 mg | 10 mg | |
| 1 mM | 2.1996 mL | 10.9980 mL | 21.9959 mL | |
| 5 mM | 0.4399 mL | 2.1996 mL | 4.3992 mL | |
| 10 mM | 0.2200 mL | 1.0998 mL | 2.1996 mL |
1、根据实验需要选择合适的溶剂配制储备液 (母液):对于大多数产品,InvivoChem推荐用DMSO配置母液 (比如:5、10、20mM或者10、20、50 mg/mL浓度),个别水溶性高的产品可直接溶于水。产品在DMSO 、水或其他溶剂中的具体溶解度详见上”溶解度 (体外)”部分;
2、如果您找不到您想要的溶解度信息,或者很难将产品溶解在溶液中,请联系我们;
3、建议使用下列计算器进行相关计算(摩尔浓度计算器、稀释计算器、分子量计算器、重组计算器等);
4、母液配好之后,将其分装到常规用量,并储存在-20°C或-80°C,尽量减少反复冻融循环。
计算结果:
工作液浓度: mg/mL;
DMSO母液配制方法: mg 药物溶于 μL DMSO溶液(母液浓度 mg/mL)。如该浓度超过该批次药物DMSO溶解度,请首先与我们联系。
体内配方配制方法:取 μL DMSO母液,加入 μL PEG300,混匀澄清后加入μL Tween 80,混匀澄清后加入 μL ddH2O,混匀澄清。
(1) 请确保溶液澄清之后,再加入下一种溶剂 (助溶剂) 。可利用涡旋、超声或水浴加热等方法助溶;
(2) 一定要按顺序加入溶剂 (助溶剂) 。
 |
|---|
 |